Белки - это сложные высокомолекулярные природные соединения,
построенные из α-аминокислот. В аминокислотах амино- (–NH2) и карбоксильная (–COOH) группы присоединены к одному и тому же атому углерода, который называют α-углеродом (см. рисунок).
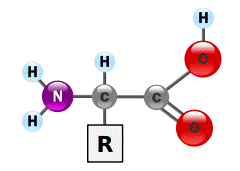
По современным представлениям, в белках α-аминокислоты соединены между собой пептидными (амидными) связями в пептидные цепи. Образование пептидных связей происходит в результате взаимодействия карбоксила одной аминокислоты с аминогруппой другой. При этом из двух аминокислот образуются пептиды с выделением одной молекулы воды:
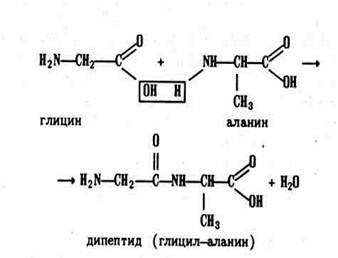
Из трёх аминокислот образуются трипептиды, из большого числа аминокислот – полипептиды.
У образовавшегося дипептида на концах молекулы остаются те же функциональные группы, что и в каждой аминокислоте, – карбоксил и аминогруппа. Поэтому дипептид может одним из своих концов реагировать с третьей аминокислотой, образуя трипептид:
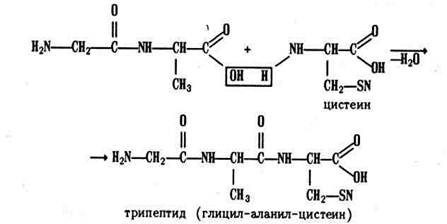
Подобным образом трипептид превращается в тетрапептид, затем в пентапептид и т. д. Теоретически длина полипептидной цепи может быть сколь угодно большой. Структуру такой цепи в общем виде можно выразить схемой:
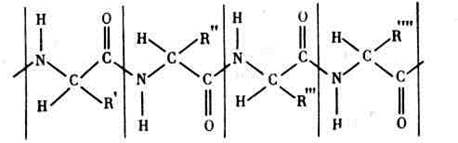
Где R', R", R'", R'"' - боковые радикалы аминокислот, вертикальными линиями ограничены отдельные аминокислотные остатки.
Число аминокислотных остатков, входящих в молекулы отдельных белков, весьма различно: в инсулине их 51, в миоглобине – около 140. Поэтому и молекулярная масса белков колеблется в очень широких пределах – от 10 000 до нескольких миллионов.
В настоящее время установлено, что большинство белков состоит из 22 качественно различных о-аминокислот. Отсюда следует, что в белковых макромолекулах отдельные остатки аминокислот должны многократно повторяться в самых различных сочетаниях. Этим объясняется существование огромного числа различных белков.
Гидролиз белков, по существу, сводится к гидролизу полипептидных связей. К этому же сводится и переваривание белков. При пищеварении белковые молекулы гидролизуются до аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть - на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал.
В структуре белка различают четыре уровня организации:
Первичная структура белка – его химическая
структура, т.е. последовательность чередования аминокислотных остатков в полипептидной цепи данного белка.
Вторичная структура белка – это спиралевидная структура полипептидной цепочки в пространстве. Скручивание ее в спираль происходит под действием водородной связи полярных групп соседних аминокислот.
Третичная структура – компактная упаковка спиралевидной цепочки в пространстве.
Четвертичная представлена соединением в одну субъединицу нескольких полипептидных цепочек, сочлененных между собой небелковыми связями и ориентированы в пространстве в виде глобул или волокон (глобулярные и фибриллярные белки).
В создании 2, 3 и 4-й структур участвуют водородные, ионные и гидрофобные связи. Ионные возникают между щелочными и кислотными группами белка, а гидрофобные взаимодействия возникают между неполярными участками белковой молекулы.
По составу белки подразделяются на простые (протеины), которые состоят только из остатков АК и сложные (протеиды), в которых полипептидная цепь соединена с небелковыми компонентами – простетической группой.
Простые белки по растворимости делятся на:
растворимые в слабых кислотах, — это наиболее простые
белки и обладают невысокой молекулярной массой и проявляют основные свойства (суммарный заряд — положительный):
- Протамины обладают сильноосновными свойствами, растворимы в слабых кислотах, содержат до 80% аминокислот основной природы (лизин, гистидин, аргинин);
- гистоны обладают менее основными свойствами, чем протамины (содержание аминокислот основной природы до 30%), они выполняют стабилизирующую функцию при формировании третичной структуры ДНК у эукариот.
белкии, растворимые в воде и растворах нейтральных солей, обладают более высокой молекулярной массой, чем гистоны и протамины, часто выполняют в организме каталитическую функцию:
альбумины хорошо растворяются в воде и высаживаются и из насыщенных растворов нейтральных солей;
глобулины растворяются в слабых растворах нейтральных солей, высаживаются при высоких концентрациях нейтральных солейе и и выполняют защитные функции в организме.
Белки, растворимые в спиртах и растворах щелочей, — это высокомолекулярные белки, нерастворимые в воде, встречаются в семенах растений, выполняют запасные функции:
— проламины нерастворимы в воде и солях, растворимы в 70 % спирте, содержат много пролина;
— глютелины нерастворимы в воде и разбавленных растворах нейтральных солей, растворимы в разбавленных щелочных растворах (0,2...2% растворах едкого натра) и выполняют не только запасную функцию, но обладают и биологической активностью.
 2014-02-12
2014-02-12 2171
2171
