Внутренняя энергия идеального газа – это сумма кинетических энергий всех его молекул:
U =∑ W к= N 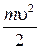 ,
,
где N – число молекул в газе. А так как 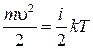 , где i – число степеней свободы молекулы, то
, где i – число степеней свободы молекулы, то
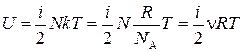 .
.
Таким образом, внутренняя энергия идеального газа зависит только от его температуры и не зависит от давления: U = U (T)≠ f (p).
3.5. Теплоёмкость термодинамической системы
Если ТД системе сообщить некоторую теплоту dQ, то, вообще говоря, температура системы повысится на некоторую величину dT, причём dQ пропорционально dT. Эту линейную зависимость для малых количеств теплоты можно записать в виде
dQ = C 0 dT. (5)
Коэффициент пропорциональности С 0 в формуле (5) называется теплоёмкостью системы (тела).
Определение 1. Теплоёмкость, отнесённая к единице массы,
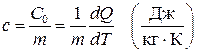 , (6)
, (6)
называется удельной теплоёмкостью те ла.
Определение 2. Теплоёмкость, отнесённая к молю тела,
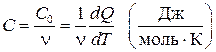 , (7)
, (7)
называется молярной теплоёмкостью тела.
Из сравнения (6) и (7), а также с учётом, что ν= m/M, получаем, что
С = сМ.
Далее везде под термином «теплоёмкость» будем понимать именно молярную теплоёмкость.
3.6. Теплоёмкости идеального газа
Так как теплота Q не является функцией состояния системы, а зависит от условий нагрева, то и молярная теплоёмкость С тоже зависит от условий нагрева: нагрев при V =const, нагрев при р =const или при других условиях. Таким образом, «теплоёмкость вообще» определённого значения для газа не имеет: в зависимости от условий нагрева, теплоёмкость С может принимать любое значение от 0 до ∞, и даже может быть отрицательной.
Рассмотрим два варианта нагрева идеального газа: при постоянном объёме и при постоянном давлении. Соответствующие этим условиям молярные теплоёмкости будем обозначать СV и С р:
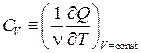 ,
, 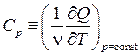 .
.
Вариант 1: V =const (газ нагревают в жёстком баллоне (рис. 1)).
 Так как dQ=pdV+dU | V =const= dU =
Так как dQ=pdV+dU | V =const= dU =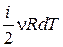 ,
,
то СV =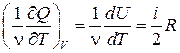
(здесь берётся полная производная, так как U имеет единственный аргумент Т). Таким образом,
dU= ν CVdT, (8)
где ν= m / M – число молей газа, СV =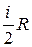 – молярная теплоёмкость при посто-янном объёме. И тогда первый закон ТД для элементарных процессов можно записать в виде:
– молярная теплоёмкость при посто-янном объёме. И тогда первый закон ТД для элементарных процессов можно записать в виде:
dQ=pdV+ ν CVdT. (9)
Замечание. Уравнение (8) легко интегрируется:
U= ν CVT+U 0,
где U 0 – константа интегрирования, которая представляет собою внутреннюю энергию газа при Т =0. Её можно положить равной нулю, так как при Т =0 хаотического движения молекул нет (υ=0). Таким образом, U 0=0, и внутренняя энергия идеального газа U= ν CVT (Дж).
Вариант 2: р =const (газ нагревают в цилиндре под тяжёлым поршнем (рис. 2)).
 Так как dQ=pdV+ ν CVdT,
Так как dQ=pdV+ ν CVdT,
то С р=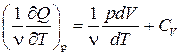 .
.
Но из уравнения состояния (3) при р =const следует, что
pdV= ν RdT,
и тогда С р= СV +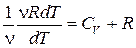 .
.
Таким образом, С р всегда больше СV. Это объясняется тем, что при V =const тепло Q идёт только на нагрев газа, а при р =const – ещё и на совершение газом работы А при увеличении его объёма.
Так как СV =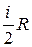 , то С р= СV+R =
, то С р= СV+R =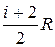 .
.
Поскольку pdV= ν RdT, то первый закон ТД теперь может быть записан не только в виде (9), но и в виде
dQ= ν CрdT.
 2014-02-12
2014-02-12 1423
1423
