Состояние термодинамической (ТД) системы
Понятие термодинамической системы
Далее мы будем рассматривать тепломеханические свойства термодинамических систем.
В общем смысле, с истема – это некоторое множество элементов, как-либо взаимодействующих друг с другом. Термодинамическая система – это любое твёрдое, жидкое или газообразное тело, свойства которого мы собираемся описывать; или же несколько тел, например, система «пар-жидкость» (гетерогенные системы).
Однако далее мы будем рассматривать только однородные (гомогенные) системы, состоящие к тому же из молекул одного химического вещества. При этом предполагается. что термодинамическая система содержит очень большое число молекул, порядка N А, так как при малом числе молекул будет меньшая точность термодинамических законов.
Число частиц в системе предполагается фиксированным.
(И. В. Савельев, Курс общей физики, 1982, т.1,§ 81)
1. ТД система может находиться в различных состояниях, характеризующихся её объёмом V, распределением температур Т и давлений р. Эти параметры р, V и Т называются параметрами состояния ТД системы.
|
|
|
2. ТД система среди всех возможных состояний имеет одно особое − состояние ТД равновесия: это состояние, которое устанавливается в системе, если внешние условия остаются неизменными достаточно долгое время. В состоянии ТД равновесия р и Т постоянны по всему объёму системы, а сам объём не меняется.
3. Если температура в различных частях системы различна, то со временем она будет меняться, выравниваясь. В этом случае состояние системы является неравновесным. Аналогично можно создать неравновесное состояние по давлению, если, например, газ быстро сжать в каком-либо месте: некоторое время давление будет выравниваться.
Определение. Характерное время установления равновесия в системе по всем параметрам называется временем релаксации. Так как дольше всех устанавливается температура, то она и определяет время релаксации.
4. В состоянии ТД равновесия частиц параметры состояния р, V и Т не являются независимыми, а связаны некоторым соотношением
f (p, V,Т)=0, (1)
которое называется уравнением состояния ТД системы. Его конкретный вид зависит от свойств вещества системы.
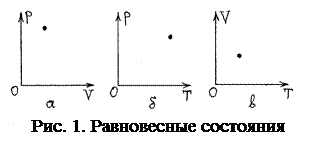 Каждый из трёх параметров в уравнении (1) можно выразить явной и однозначной функцией двух других, поэтому независимых параметров – два, т.е. состояние системы полностью определяется любыми двумя параметрами из трёх. А это означает, что на любой из трёх координатных четвертьплоскостей – (p, V), (p, Т) или (V,Т) – равновесное состояние ТД системы можно изобразить точкой (рис. 1,а,б,в).
Каждый из трёх параметров в уравнении (1) можно выразить явной и однозначной функцией двух других, поэтому независимых параметров – два, т.е. состояние системы полностью определяется любыми двумя параметрами из трёх. А это означает, что на любой из трёх координатных четвертьплоскостей – (p, V), (p, Т) или (V,Т) – равновесное состояние ТД системы можно изобразить точкой (рис. 1,а,б,в).
|
|
|
Для неравновесных состояний параметры p или Т не определены, поэтому неравновесное состояние никак нельзя изобразить на этих плоскостях.
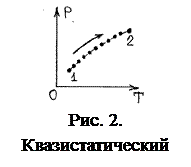 5. Переход системы их одного равновесного состояния 1 в другое 2 сопровождается нарушением равновесия. Однако, если переход 1→2 осуществлять достаточно медленно, намного дольше времени релаксации, в пределе – бесконечно медленно, квазистатически, например, медленно повышать температуру газа в баллоне, то можно считать, что переход 1→2 состоит из последовательности равновесных состояний, которая на соответствующей диаграмме изобразится непрерывной последовательностью точек, т.е. линией (рис. 2).
5. Переход системы их одного равновесного состояния 1 в другое 2 сопровождается нарушением равновесия. Однако, если переход 1→2 осуществлять достаточно медленно, намного дольше времени релаксации, в пределе – бесконечно медленно, квазистатически, например, медленно повышать температуру газа в баллоне, то можно считать, что переход 1→2 состоит из последовательности равновесных состояний, которая на соответствующей диаграмме изобразится непрерывной последовательностью точек, т.е. линией (рис. 2).
Определение. Процесс, состоящий из непрерывной последовательности равновесных состояний, называется квазистатическим, или равновесным.
6. Определение. Если процесс может быть проведён точно в обратном направлении, т.е. через те же промежуточные равновесные состояния, то он называется обратимым.
Всякий равновесный процесс является обратимым. Неравновесный процесс не является обратимым, т.е. вернуться в исходную точку хоть и можно, но уже не тем путём; и более того – неравновесный процесс вообще нельзя изобразить линией в координатах (p, V), (p, Т) или (V,Т), т.е. неопределено само понятие пути процесса.
 7. Определение. Процесс, при котором ТД система после ряда изменений квазистатически возвращается в исходное состояние каким-либо иным путём, называется циклическим.
7. Определение. Процесс, при котором ТД система после ряда изменений квазистатически возвращается в исходное состояние каким-либо иным путём, называется циклическим.
Графически циклический равновесный процесс изображается замкнутой линией (рис. 3).
2.3. Внутренняя энергия ТД системы (§ 82)
Определение. Внутренняя энергия ТД системы U – это суммарная кинетическая энергия хаотического движения всех её молекул плюс потенциальная энергия их взаимодействия.
Свойства внутренней энергии:
1. Внутренняя энергия является функцией состояния системы, т.е. её значение однозначно определяется параметрами данного состояния p, V и Т, независимо от процесса, который привёл к этому состоянияю: U = f (p, V, Т).
2. Внутренняя энергия – величина аддитивная. Это означает. что если система состоит из нескольких частей, то внутренняя энергия системы равна сумме внутренних энергий её частей.
2.4. Работа системы и работа над системой (§ 84)
 Пусть в цилиндрической банке под подвижный поршнем заключён газ. Газ давит на поршень с силой F = pS, где р – давление газа в цилиндре, S − площадь поршня (рис. 4). Если поршень сместился на малое расстояние dx, то система (т.е. газ), расширившись, совершила работу
Пусть в цилиндрической банке под подвижный поршнем заключён газ. Газ давит на поршень с силой F = pS, где р – давление газа в цилиндре, S − площадь поршня (рис. 4). Если поршень сместился на малое расстояние dx, то система (т.е. газ), расширившись, совершила работу
dA=Fdx=pSdx=pdV,
где dV – малое приращение объёма газа. При конечном расширении газа от V 1 до V 2 работа системы
А 1-2=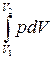 . (2)
. (2)
 Это выражение для работы справедливо и для объёма любой формы, а не только цилиндрического.
Это выражение для работы справедливо и для объёма любой формы, а не только цилиндрического.
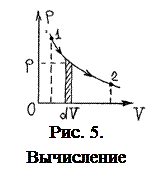
На диаграмме (р, V) процесс изменения объёма газа изобразится некоторой кривой. Так как элементарная работа pdV равна на этой диаграмме площади заштрихованной полоски (рис. 5), то вся работа (2) численно равна площади всей фигуры под кривой р (V) на участке от V 1 до V 2.
 Пусть объём газа в цилиндре уменьшается. Тогда смещение поршня dx противоположно направлению силы давления F, и, следовательно, работа cистемы dA=Fdx cos180° будет отри-цательной (рис. 6). Работа же внешних сил, сжимающих газ, т.е. работа над системой, которую будем обозначать А ′ − положительна, так как направление внешней силы F′ и смещения dx совпадают. Таким образом, А ′=− А.
Пусть объём газа в цилиндре уменьшается. Тогда смещение поршня dx противоположно направлению силы давления F, и, следовательно, работа cистемы dA=Fdx cos180° будет отри-цательной (рис. 6). Работа же внешних сил, сжимающих газ, т.е. работа над системой, которую будем обозначать А ′ − положительна, так как направление внешней силы F′ и смещения dx совпадают. Таким образом, А ′=− А.
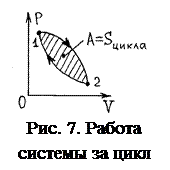
При циклическом процессе 1→2→1, показанном на рис. 7, работа системы А численно равна площади петли, так как площадь фигуры под участком 1→2 даёт А 1-2>0, а площадь фигуры под участком 2→1 даёт А 2-1<0. При обходе петли по часовой стрелке А >0, а при обратном обходе А <0.
2.5. Понятие температуры (§ 85)
Качественно понятие температуры тела вводится следующими процессами теплопередачи.
|
|
|
1. Если тело 1 при физическом контакте с телом 2 передаёт ему внутреннюю энергию путём теплопередачи, то говорят, что тело 1 имеет более высокую температуру, чем тело 2, т.е. Т 1> Т 2.
2. Если два тела (без внутренних тепловых источников) долгое время находятся в физическом контакте и уже не обмениваются энергией путём теплопередачи, то говорят, что эти тела имеют одинаковые температуры: Т 1= Т 2.
Температура тела Т является мерой средней кинетической энергии теплового (хаотического) движения всех его молекул. Из статистической теории известно, что эта средняя кинетическая энергия молекулы связана с температурой тела Т соотношением:
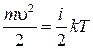 ,
,
где m – масса молекулы,
υ – её средняя тепловая скорость,
k =1,38·10−23 Дж/К – постоянная Больцмана,
i – число степеней свободы молекулы, т.е. число независимых координат, задающих положение и ориентацию молекулы в пространстве. Для 1-атомных молекул i =3, для двухатомных – i =5, для нелинейных трёх- и многоатомных молекул i =6.
Многие параметры тел, такие как объём, плотность, электропроводность и др., зависят от температуры и могут быть использованы для её измерения. В большинстве бытовых и лабораторных термометров для измерения температуры используется зависимость V (T), где V – объём жидкости или газа. В электронных термометрах используется зависимость электрического сопротивления тела от температуры (терморезисторы).
При градуировке термометров точке кипения воды приписывают значение 100°, точке замерзания – 0°; И весь этот температурный интервал делят на 100 равных частей. Это – шкала Цельсия, применяемая в быту.
В физике применяется шкала Кельвина, или абсолютная шкала. Она строится так: один кельвин равен одному градусу Цельсия (1 К=1°С), а температуры шкал Кельвина (Т К) и Цельсия (Т С) связаны соотношением
Т К= Т С+273,15.
Температура Т = 0 К =−273,15°С называется абсолютным температурным нулём.
Далее везде под температурой системы будем понимать именно абсолютную температуру.
Третий закон термодинамики утверждает невозможность достижения абсолютного нуля никакими способами. К абсолютному нулю можно подойти очень близко (и в настоящее время подходят – до 10−6 К), но достичь его точно – никогда. Да и само понятие «точно» в физике не имеет смысла.
|
|
|
2.6. Первый закон термодинамики (§ 83)
Первый закон термодинамики – это закон сохранения энергии в тепломеханических процессах.
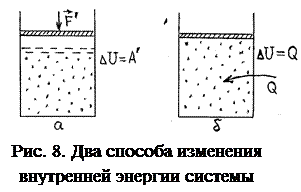 Рассмотрим ТД систему, например, газ, заключённый в некотором объёме V. И пусть U – внутренняя энергия газа. Эту энергию можно увеличить двумя способами:
Рассмотрим ТД систему, например, газ, заключённый в некотором объёме V. И пусть U – внутренняя энергия газа. Эту энергию можно увеличить двумя способами:
1) механическим, т.е. путём сжатия газа и совершения над ним работы А ′ (рис. 8,а);
2) немеханическим способом, который называется теплопередачей, т.е. путём нагревания газа его контактом с более горячим телом; в этом случае говорят, что газу передаётся некоторая теплота Q (рис. 8,б).
В процессе теплопередачи работу над системой совершают не макроскопические внешние тела (поршень), а быстрые молекулы горячего тела над более медленными молекулами нашей системы, увеличивая их кинетическую энергию.
Замечание. Теплопередача может происходить не только контактно, но и через излучение. Но в этом случае её механизм более сложен, и мы его рассматривать не будем.
В общем случае поступления энергии в систему по обоим каналам
Δ U = А ′+ Q, (3)
где А ′ − совершённая над системой механическая работа,
Q – сообщённая системе теплота.
Уравнение (3) выражает первый закон термодинамики: приращение внутренней энергии системы равно сумме совершённой над системой работы А ′ и некоторой добавки Q, называемой теплотой, сообщённой системе.
Замечание. Если работа над системой определяется как интеграл
А ′=−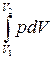 ,
,
то соотношение (3) формально можно рассматривать как определение теплоты Q.
Так как А ′=− А, где А – работа системы, то первый закон термодинамики можно представить в виде:
Q =Δ U + A. (4)
Практически это более удобная форма его записи, и тогда он будет читаться так: теплота, сообщённая системе, идёт на увеличение её внутренней энергии ΔU плюс на совершение системой работы А над внешней средой.
Для элементарных процессов энергообмена соотношение (4) примет вид: dQ = dU + dA,
или dQ = dU + рdV,
где dV – приращение объёма,
dU – приращение внутренней энергии системы (полный дифференциал).
dQ − элементарная теплота (не приращение!),
dA = рdV – элементарная работа (не приращение!).
Как и работа, теплота Q в системе СИ измеряется в джоулях. Но иногда пользуются и внесистемной единицей – калорией: 1 кал – это теплота, необходимая для нагревания 1 г воды на 1°С от 19,5 до 20,5°С. Опытным путём установлено, что
1 кал=4,18 Дж (Джоуль, Майер, 1842 г.).
~~~~~~~~~~~~~~~~~~~~~~~~~~
Итак, работа А и теплота Q – это две формы энергообмена между телами – механическая и немеханическая. Работа и теплота зависят от пути процесса, проводимого над системой, и поэтому А и Q не являются функциями её состояния. А и Q – это процессы, а не состояния. Нельзя говорить о «запасе работы» или о «запасе теплоты» в системе, ибо для данного состояния системы эти величины не определены. Внутренняя же энергия U является функцией состояния системы, так как она однозначно определяется параметрами её состояния р, V и Т: U = U (р, V, Т). Поэтому правильно говорить о запасе внутренней энергии U в системе.
Замечание. У твёрдых и жидких тел при изменении давления и температуры объём практически не меняется, значит, А ≈0 и, следовательно, Q =Δ U. В этом случае можно говорить о запасе теплоты в теле.
 2014-02-12
2014-02-12 3246
3246








