Полярные Неполярные
| ||||||
| ||||||
|
| |||||
Следует заметить, что полярные радикалы могут взаимодействовать с молекулами воды, поэтому они называются гидрофильными. Неполярные радикалы не взаимодействуют с молекулами воды, они называются гидрофобными.
Существует также биологическая классификация аминокислот, которая учитывает возможность их синтеза в организме. Все аминокислоты подразделяются на заменимые (могут синтезироваться в организме) и незаменимые или эссенциальные (в организме не синтезируются и должны поступать с пищей). Некоторые основные аминокислоты способны подвергаться дополнительной модификации уже в составе белковых молекул, в результате химических реакций, таких как гидроксилирование и метилирование. Например в коллагене содержится гидроксипролин.
Принято выделять четыре уровня структурной организации белковой молекулы: первичная, вторичная, третичная и четвертичная структуры. Рассмотрим особенности каждого из этих уровней.
Первичной структурой белка называют последовательность чередования аминокислот в полипептидной цепи. Первичная структура каждого белка уникальна и запрограммирована генетически.
Первичную структуру белка формируют пептидные связи, образующиеся при взаимодействии α-карбоксильной группы одной аминокислоты с α-аминогруппой другой аминокислоты. Полипептидная цепь состоит из регулярно повторяющихся участков, образующих основную цепь или пептидный остов, и вариабельной части, включающей в себя характерные боковые цепи - радикалы аминокислот.
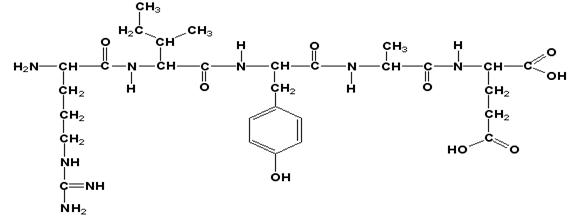
Аминокислотные звенья пептида (белка) называются аминокислотными остатками. Аминокислотный остаток, содержащий свободную α-аминогруппу, называют N-концевым, а остаток, имеющий свободную α--карбоксильную группу, - С-концевым. Структурные формулы пептидов записываются и читаются с N-конца. Все аминокислотные остатки, входящие в состав полипептида (кроме С-концевого), получают окончание -ил вместо -ин. Название данного пептида - аргинилизолейцилтирозил-глутамат.
Первичная структура белка, т.е. набор и порядок чередования аминокислот определяет его последующие физико-химические и биологические свойства.
Выяснение аминокислотной последовательности белков представляет интерес по ряду причин.
Во-первых, изменение последовательности аминокислот в результате мутации может привести к нарушению нормальной функции белка, а следовательно, к развитию заболевания. Такая тяжёлая болезнь, как серповидно-клеточная анемия возникает в результате замены одной-единственной аминокислоты в одном-единственном белке.
Во-вторых, знание аминокислотной последовательности важно для выяснения молекулярной основы биологической активности белка.
В-третьих, сравнительное изучение последовательностей аминокислот в белках позволяет проследить эволюцию на молекулярном уровне.
В-четвёртых, это необходимо для выяснения тех принципов, на основе которых из полипептидных цепей формируются высокоспецифичные пространственные структуры. Установлено, что последовательность аминокислотных остатков полипептидной цепи белка несёт в себе информацию, необходимую для формирования пространственной структуры белковой молекулы. Процесс сворачивания полипептидной цепи в правильную трёхмерную структуру получил название фолдинг.
До последнего времени считалось, что формирование пространственной структуры белка происходит самопроизвольно, в отсутствие каких-либо компонентов. Однако сравнительно недавно выяснилось, что это справедливо только для сравнительно небольших белков (порядка 100 аминокислотных остатков). Для фолдинга крупных белков необходимы специальные белки - шапероны, которые создают возможность быстрого формирования правильной пространственной структуры белка.
Вторичная структура белка представляет собой способ свёртывания полипептидной цепи в спиральную или иную конформацию. При этом образуются водородные связи между СО- и NH-группами пептидного остова одной цепи или смежных полипептидных цепей. Известно несколько типов вторичной структуры пептидных цепей, среди которых главными являются α--спираль и β-складчатый слой.
α-Спираль - жёсткая структура, имеет вид стержня. Внутреннюю часть этого стержня создаёт туго закрученный пептидный остов, радикалы аминокислот направлены наружу. При этом CO-группа каждого аминокислотного остатка взаимодействует с NH-группой четвёртого от него остатка. На один виток спирали приходится 3,6 аминокислотных остатка, а шаг спирали составляет 0,54 нм. Некоторые аминокислоты препятствуют свёртыванию цепи в α-спираль, и в месте их расположения непрерывность спирали нарушается. К этим аминокислотам относятся пролин (в нём атом азота входит в состав жёсткой кольцевой структуры и вращение вокруг связи N - Са становится невозможным), а также аминокислоты с заряженными или объёмными радикалами, которые электростатически или механически препятствуют формированию α-спирали.
Β-Складчатый слой отличается от α-спирали тем, что имеет плоскую, а не стержневидную форму. Образуется при помощи водородных связей в пределах одной или нескольких полипептидных цепей. Пептидные цепи могут быть расположены в одном направлении (параллельно) или в противоположных направлениях (антипараллельно), напоминая меха аккордеона. Боковые радикалы находятся выше и ниже плоскости слоя.
Третичная структура белка - это распределение в пространстве всех атомов белковой молекулы, или иначе говоря, пространственная упаковка спирализованной полипептидной цепи. Основную роль в образовании третичной структуры белка играют водородные, ионные, гидрофобные и дисульфидные связи, которые образуются в результате взаимодействия между радикалами аминокислот.
Водородные связи образуются между двумя полярными радикалами, один из которых может иметь заряд.
Ионные связи могут возникать между противоположно заряженными радикалами.
Гидрофобные взаимодействия характерны для неполярных радикалов.
Дисульфидные связи образуются между SH-группами двух радикалов цистеина, находящихся в разных участках полипептидной цепи.
По форме молекулы и особенностям формирования третичной структуры белки делят на фибриллярные и глобулярные.
Фибриллярные белки - имеют нитевидную форму (фибриллы), образуют волокна и пучки волокон. Между соседними полипептидными цепями имеется много поперечных ковалентных сшивок. Нерастворимы в воде. Переходу в раствор препятствуют неполярные радикалы аминокислот и сшивки между пептидными цепями. В организме выполняют главным образом структурную функцию, обеспечивают механическую прочность тканей.
Примеры фибриллярных белков:
Коллаген - белок соединительной ткани. В его составе преобладают аминокислоты глицин, пролин, гидроксипролин.
Эластин - более эластичен, чем коллаген, входит в состав стенок артерий, лёгочной ткани, в его составе преобладают аминокислоты глицин, аланин, валин.
Кератин - белок эпидермиса и производных кожи, в его структуре преобладает аминокислота цистеин.
Глобулярные белки - имеют сферическую или эллипсовидную форму молекулы (глобула). В процессе образования глобулы гидрофобные радикалы аминокислот погружаются во внутренние области, гидрофильные радикалы располагаются на поверхности молекулы. При взаимодействии с водной фазой полярные радикалы образуют многочисленные водородные связи. Белки удерживаются в растворённом состояния за счёт заряда и гидратной оболочки. В организме глобулярные белки выполняют динамические функции (транспортную, ферментативную, регуляторную, защитную).
Примеры глобулярных белков:
Альбумин - белок плазмы крови; содержит много остатков глутамата и аспартата; осаждается при 100%-ном насыщении раствора сульфатом аммония.
Глобулины - белки плазмы крови; по сравнению с альбумином обладают большей молекулярной массой и содержат меньше остатков глутамата и аспартата, осаждаются при 50%-ном насыщении раствора сульфатом аммония.
Гистоны - входят в состав ядер клеток, где образуют комплекс с ДНК. Содержат много остатков аргинина и лизина.
Молекулярные глобулы ряда белков, таких как иммуноглобулины, состоят из нескольких независимых, компактно свёрнутых фрагментов полипептидной цепи, которые называют доменами. Доменные белки являются как бы переходной формой к следующему уровню структурной организации белка.
Четвертичная структура белка - размещение в пространстве взаимодействующих между собой субъединиц, образованных отдельными полипептидными цепями белка. Четвертичная структура - высший уровень организации белковой молекулы, к тому же необязательный - более половины известных белков её не имеют. Белки, обладающие четвертичной структурой, называют также олигомерными, а полипептидные цепи, входящие в их состав, - субъединицами или протомерами. Протомеры могут быть идентичными или отличиться по своей первичной структуре.
Каждый из протомеров синтезируется в виде отдельной полипептидной цепи, которая сворачивается в глобулу и затем соединяется с другими протомерами. Объединение идёт путём самосборки. Каждый из протомеров содержит участки, комплементарные другим протомерам. Взаимодействие между контактными участками протомеров происходит при помощи гидрофобных, ионных и водородных связей.
Примерами олигомерных белков могут служить эритроцитарный белок гемоглобин, фермент лактатдегидрогеназа и многие другие. Эти белки могут существовать в виде нескольких устойчивых конформаций. Белки, обладающие четвертичной структурой, характеризуются аллостерическими свойствами, то есть способны переходить из одной конформаций в другую с изменением своей функциональной активности.
Более подробно структурная организация и функционирование олигомерных белков будут рассмотрены в дальнейшем на примере гемоглобина.
Известны некоторые белки, молекула которых состоит из двух или более полипептидных цепей, соединённых дисульфидными связями (например, гормон инсулин). Такие белки нельзя относить к олигомерным. Данные белки образуются из единой полипептидной цепи в результате частичного гидролиза – локального расщепления пептидных связей. Аллостерическими свойствами, характерными для олигомерных белков, такие белки не обладают.
 2014-02-13
2014-02-13 10116
10116