ДЛЯ ЛАБОРАТОРНО-ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ХИМИИ
Тема №11: d-Элементы. Элементы VIB группы. Хром. Свойства хрома и его соединений. Качественные реакции на d-Элементы
Количество часов: 1
Курс: 2
Специальность: Фармация
Составители:
доц. Игенбаева Б.Б.
преп. Каримова А.С.
Астана 2013 г.
Тема: d-элементы. Элементы VIВ группы. Хром. Свойства хрома и его соединений.
Цель: Сформировать знания об общих закономерностях изменения свойств и параметров d-элементов по ПСЭ. Систематизировать и обобщить знания об основных характеристиках d-элементов.
Задачи обучения: Студент должен знать общие закономерности изменения свойств и параметров d -элементов по ПСЭ. Студент должен уметь применить знания при прогнозировании продуктов реакции при выполнении экспериментов с участием хрома.
Основы вопросы темы:
2. Важнейшие соединения хрома Cr(III) и Сr(VI), изменение кислотно-основных и окислительно-восстановительных свойств соединений хрома с изменением степени его окисления.
3. Применение соединений хрома в фармации, биологическое значения хрома в биосистемах.
Методы обучения и преподавания: Практическое занятие №8 Лабораторное занятие №6. Семинар, составление уравнения реакции. Лабораторные опыты и анализ и лабораторных данных и выводы.
Задача 1. В каком растворе Сг(ОН)з способен растворятся:
А. NH4CI В. H2О С. Na2S D. КОН
Ответ: Сг(ОH) 3 - амфотерен, а это значит, что он может растворяться как в кислотах, так и в щелочах; Сг(ОН)3 +3NаОН→ Na[Cr(ОН)6].
Задача II. При взаимодействии растворов СгСIз и Na2S образуется соединение:
А.Сг2S3 В.СгОНСI2 С. Cr(OH)2 D. Сг(ОН)3
Ответ: Д). Смешали соли противоположного типа, а это
значит, что гидролиз той и другой соли пойдет до конца.
 2CrCI3 + 3Na2S + HOH 2Сг(ОН)3 + 3H2S + 6NaCI (I)
2CrCI3 + 3Na2S + HOH 2Сг(ОН)3 + 3H2S + 6NaCI (I)
Задача 3, Какая масса осадка и какой объем газа образуется в реакции, если взять 10 г чистой соли СгСI3 и 10г Na2S.
 Дано; Решение:
Дано; Решение:
m(СгС1 3 ) =10r Так как имеется информация
о двух реагирующих веществах.
m(Na2S) = 10г надо найти, какое из них было в недостатке,
т.к. от него зависит выход продукта.
 m (Сг(ОН)з -? М(Сг(ОH)з) = 52+17*3=103 r/моль
m (Сг(ОН)з -? М(Сг(ОH)з) = 52+17*3=103 r/моль
V(H3S) -? М(Na2S) = 23*2 + 32 = 78 г/моль
M(H2S) = 34 г/моль
М(СrСIз) = 52 + 35*3 = 167 г/моль
Пересчитаем в моли:
m 10
п(СгСIз) = ----- = ------- =0,06моль
М 167
m 1О
n(Na 2 S) = ---- = ---- = 0.12моль
M 78
Из уравнения (I) видно, что на 2 моль CrCl3 - 3 моль Na2S
на 0,06 моль ------- Х
m(Сг(ОН) 3 ) =М*n = 103*0,06 = 6,18 r осадка
из 2 моль СгСIз — 3 моль H2S
из 0,06 моль --------- Х
0,06*3 1,18
Х = ---------- = -------- = 0,09 моль Н 2 S
2 2
V(H2S) = n*Vm = 0.09 * 22,4 = 2,0 л
Ответ: mAl(OH) 3 = 6,18 rp; V (H2S) =2,0 л
Задача 4. Закончите уравнение реакции. Расставьте коэффициенты, используя метод полуреакций. Определите эквивалент окислителя и восстановителя:
CrCl3 + NaBiO3 + NаОН -> Bi2О3 +...
Решение:1) Из уравнения следует, что Bi из cостояния +5 переходит в состояние +3, принимает электроны, следовательно, является окислителем. Забирает электроны для своего восстановления он у Cr+3. Xpoм (III), отдавая электроны в щелочной среде, может перейти только в хромат, значит вторым продуктом будет Na2СгO4.
CrCI3 + NаВiO3 + NaOH Bi2O3+Na2CrO4+
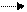 Составляем две полуреакции, учитывая, что используются в них все вещества, так как они могут существовать в растворе, а именно сильные электролита в виде ионов, слабые – в виде молекул.
Составляем две полуреакции, учитывая, что используются в них все вещества, так как они могут существовать в растворе, а именно сильные электролита в виде ионов, слабые – в виде молекул.
+4е
 ЗН20 + 2BiО3 - → Вi2O3 + 60H - 3
ЗН20 + 2BiО3 - → Вi2O3 + 60H - 3
-Зе
8OН - +Сr +3 → CrO42- +4H2O 4
Недостающее количество атомов кислорода в щелочной среде восполняются ОН - ионами.
9Н20+6ВiO3+14OH-+4Cr+3 → ЗBi2Oз+18ОH-+4CrО4-2+16H2О
Переходим от ионного уравнения к молекулярному:
6NаВiOз+4СгСI3+14NаОH → ЗВi2Оз+4Nа2СrO4+7H20+12NaСI
В первую часть равенства подставляем недостающий продукт NaСI.
2. Определяем эквивалент окислителя и восстановителя, учитывая, что в окислительно-восстановительных реакциях фактор эквивалентности равен единице, деленной на число принятых или отданных электронов:
М
Э ок-ля (NaBiO3) = -----, т.е f = 1/4
М
Э ок-ля (СгCI3) = -------, т.е. f = 1/3
Литература:
1. Глинка НЛ. "Общая химия", Л., 1987,стр. 654-660
2.Ахметов ИД. "Общая и неорганическая химия", М. ВШ, 1981,стр. 345-360
3. Угай Л.Л. "Общая химия" М. В.Ш., 1997,стр. 447-456
4.Глинка Н.Л. "Задачи и упражнения по общей химии". Л, 1987,стр.246-
5.Степин Б.Д., Цветков А.А, "Неорганическая химия" М. В.Ш, 1994,стр.
6.Оганесян Э.Т. "Неорганическая химия*', М., ВШ, 1984, стp. 337-349
7. Ахметов Н.С., Азизова М. И. "Лабораторные работы и семинарские занятия по общей и неорганической химии" М. В.Ш, 1999,стр. 184-192
8. Остапкевич Н.А. "Практикум по неорганической химии", М., В.Ш, 1987
9. Тапёрова А.А. "Лабораторные работы по общей химии" Л. Химия, 1986,
10. Лекционный материал.
Контроль:
1. Охарактеризуйте свойства d-элементов VIВ группы
2. Дайте полную характеристику внешнему слою атома хрома и oпределите характеристики его cтепени окисления.
3. Как изменяются свойства гидроксидов хрома в ряду. Сг(ОН) 2 → Сr(ОH) 3 → Сr(OH)6 . Приведите примеры, подтверждающие амфотерность хрома тригидроксида.
4. Охарактеризуйте окислительно - восстановительные свойства соединений хрома, приведите примеры pеакций перехода Сг +2 → Cr +3 → Сr +6 Покажите взаимопереход хроматов в бихроматы в зависимости от среды.
5. В какой среде свойства хрома (Vl) выражены Сделать вывод, используя значения стандартных окислительно- восстановительных потенциалов.
6. Где находят применение хром и его соединения в медицине и фармации?
7. При взаимодействии 200 мл раствора калия бихромата в сернокислой среде с сероводородом выделилось серы. Определить молярную консистенцию эквивалента раствора калий бихромата
8. Какой из оксидов Cr2O3 или CrO3 термодинамически более устойчив? Δ G0 298(Cr2O3)= -1050 кДж/моль; Δ G0 298(CrO3)= -513 кДж/моль
9. Составить уравнение гидролиза Cr2S3 . Почему в водном растворе это соединение неустойчиво?
10. Образуется ли осадок SrCrO4 , если смешать равные объёмы 0,01 растворов SrCI2 и К2CrO4?
 2015-01-21
2015-01-21 821
821








