Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так в и кристалле, называют комплексными. При образовании комплексных соединений наблюдается взаимная координация взаимодействующих частиц, так называемое комплексообразование. Образующиеся сложные по составу частицы называются комплексными.
Например: Fe(CN)3 + 3KCN = K3[Fe(CN)6]
Ni(OH)2 + 6NH3 = [Ni(NH3)6](OH)2
В структуре комплексного соединения различают внутреннюю (координационную) и внешнюю сферы. Центральное место во внутренней сфере занимает комплексообразователь (чаще всего это ион металла
d– лемента). Вокруг комплексообразователя на близком расстоянии расположены (координированы) отрицательно заряженные ионы или нейтральные молекулы – лиганды. Число лигандов, координированных около комплексообразователя, называют координационным числом. При записи комплексного соединения внутреннюю сферу заключают в квадратные скобки. На более далеком расстоянии от комплексообразователя располагаются ионы внешней сферы. Например, K3[Fe(СN)6]: комплексообразователь – Fe3+, лиганды – ионы CN-, координационное число – 6, [Fe(СN)6]3- - внутренняя сфера, 3К+ - внешняя сфера.
Заряд комплексного иона равен алгебраической сумме заряда комплексообразователя и зарядов лигандов.
В зависимости от заряда различают анионные комплексы, например, [Fe(СN)6]3-, [Al(OH)4]-; катионные комплексы, например, [Ni(NH3)6]2+, [Cr(H2O)4Cl2]1+; нейтральные комплексы, например, [Pt(NH3)2Cl2], [Cr(H2O)3F3]. Нейтральные комплексы не имеют внешней сферы.
В водных растворах комплексные соединения, проявляя свойства электролитов, диссоциируют на комплексный ион и ионы внешней сферы (первичная диссоциация):
K3[Fe(СN)6] ® 3К+ + [Fe(СN)6]3- (1)
Равновесие процесса первичной диссоциации (1) характеризуется константой диссоциации:
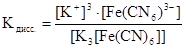
Образовавшийся комплексный ион в незначительной степени может подвергаться вторичной диссоциации, образуя составляющие его частицы (ионы, молекулы):
[Fe(СN)6]3- Û Fe3+ + 6CN- (2)
Равновесие процесса (2) характеризуется константой нестойкости:

Чем меньше константа нестойкости, тем более устойчив данный комплексный ион. Нейтральные комплексы электролитами не являются.
Существуют комплексные соединения с малоустойчивой внутренней сферой, которые распадаются в водном растворе на все составляющие ионы. Такие комплексные соединения называются двойными солями. Например,
KAl(SO4)2 ®K+ + Al3+ + 2SO42-
Пример 1. Определите заряд комплексного иона, координационное число (к.ч.) и степень окисления комплексообразователя в соединениях:
а) K4[Fe(CN)6]; б) [Cr(H2O)2(NH3)3Cl]Cl2.
Решение. Заряд комплексного иона можно рассчитать по заряду внешней сферы, так как он равен заряду внешней сферы, но противоположен ему по знаку. Координационное число комплексообразователя равно числу лигандов, координированных вокруг него.
Степень окисления комплексообразователя определяется, исходя из того, что алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю. Заряды кислотных остатков определяют из формул соответствующих кислот.
а) K4[Fe(CN)6]
Заряд внешней сферы (4К+): (+1)×4 = 4+. Следовательно, заряд комплексного иона равен (4-): [Fe(CN)6]4-. Координационное число – число лигандов – равно 6. Степень окисления комплексообразователя (Fe+х) равна:
(+1)×4 + х + (-1)×6 = 0. Отсюда х = +2, (Fe+2)
Степень окисления комплексообразователя можно рассчитать и по заряду комплексного иона [Fex(CN)6]4-: х+ (-1)×6 = -4; х = +2 (Fe+2)
б) [Cr(H2O)2(NH3)3Cl]Cl2
Заряд внешней сферы (2Cl-) равен (2-). Следовательно, заряд комплексного иона равен (2+): [Cr (H2O) 2(NH3) 3Cl]2+. Координационное число (число лигандов) равно (2 + 3 +1) = 6. Степень окисления комплексообразователя (Cr+х) равна:
х + 0×2 + 0×3 + (-1)×1 + (-1)×2 = 0 х – 1 -2 = 0; х = +3 (Cr+3)
или [Crх(H2O)02(NH3)03Cl-1]2+ х + 0×2 + 0×3 + (-1) = +2; х = +3 (Cr+3)
Пример 2. составьте координационную формулу комплексного соединения по следующим данным: а) Co(NO2)3×2KCl×NH3; комплексообразователь – кобальт; координационное число равно 6; б) CrCl3×H2O×3NH3; комплексообразователь – хром; координационное число равно 6.
Решение.
а) В набор данных соединений Co(NO2)3×2KCl×NH3 входят 2 молекулы KCl, где К – щелочной металл (s – элемент), а комплексообразователями в основном выступают атомы d – элементов (в данном примере - кобальт). Следовательно, катионы калия будут образовывать внешнюю сферу и таким образом комплексный ион будет анионом. Во внутреннюю сферу комплексного аниона будут входить одна молекула NH3, три иона NO2- и два иона Cl-. Координационное число (число лигандов) равно (1+3+2)=6. Координационная формула комплексного соединения имеет вид: K2[Co(NH3)(NO2)3Cl2].
б) В наборе данных соединений CrCl3×H2O×3NH3 комплексообразователем является ион Cr3+. Координационное число равно 6. Исходя из того, что нейтральные молекулы в большинстве случаев входят во внутреннюю сферу комплексного соединения, то в данном примере внутреннюю сферу составят три молекулы NH3, одна молекула H2O, два иона Cl-. Третий хлорид-ион (Cl-) образует внешнюю сферу. Следовательно, комплексный ион будет катионом. Координационная формула комплексного соединения имеет вид: [Cr(NH3)3H2OCl2]Cl.
ЗАДАНИЯ
301.Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Cu(NH3)4]SO4, K2[PtCl6], K[Ag(CN)2]. Напишите уравнения диссоциации в водном растворе комплексного соединения [Cu(NH3)4]SO4 и выражение для константы диссоциации и константы нестойкости.
302.Составьте координационные формулы следующих комплексных соединений по следующим данным:
а) исходные соединения PtCl4 ×2H2O; к.ч. = 6; б) исходные соединения Cr(NO3)3×2NH3×4H2O; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
303.Составьте координационные формулы следующих комплексных соединений по следующим данным: а) исходные соединения KCl×СrCl3×2H2O; к.ч. = 6
б) исходные соединения СоCl3×H2O×4NH3; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
304.Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях Na[Ag(NO2)2], [Zn(NH3)4]SO4, K[SbBr6]. Напишите уравнения диссоциации в водном растворе комплексного соединения Na[Ag(NO2)2] и выражения для константы диссоциации и константы нестойкости.
305. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K3[Au(CN)2Br2], [Ni(NH3)6](NO3)2, K2[PtCl(OH)5]. Напишите уравнения диссоциации в водном растворе комплексного соединения K3[Au(CN)2Br2] и выражения для константы диссоциации и константы нестойкости.
306. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения AgCl×2NH3; к.ч. = 2;
б) исходные соединения 2NaOH×Pt(NO2)2; к.ч. = 4. Для одного из полученных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
307. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях K4[Fe(CN)6], [Co(NH3)5Cl]SO4, K2[HgI4]. Напишите уравнения диссоциации в водном растворе комплексного соединения K2[HgI4] и выражения для константы диссоциации и константы нестойкости.
308. Определите, чему равен заряд следующих комплексных ионов [Cr(H2O)4Cl2]x, [HgBr4]x, [Fe(CN)6]x, если комплексообразователями являются Cr3+, Hg2+, Fe3+. Напишите координационные формулы соединений, содержащих эти комплексные ионы. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
309.Определите, чему равен заряд комплексных ионов [Cr(NH3)5NO2]x, [Pd(NH3)Cl3]x, [Ni(CN)4]x, если комплексообразователями являются Cr3+, Pd2+, Ni2+. Напишите координационные формулы соединений, содержащих эти комплексные соединения. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
310. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения 2KCN×Pd(CN)2; к.ч. = 4; б) исходные соединения Сr(NO2)3×5NH3; к.ч. = 6. Для одного из полученных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
311. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения 3NaCN×Fe(CN)2×NH3; к.ч. = 6; б) исходные соединения CoBr3×4NH3×2H2O; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации в водном растворе и выражения для константы диссоциации и константы нестойкости.
312.Напишите уравнения вторичной диссоциации и выражения для констант нестойкости комплексных ионов: [Ag(NH3)2]+, [Fe(CN)6]4-, [PtCl6]2-. Чему равны степень окисления и координационное число комплексообразователей в этих ионах?
313.Константы нестойкости комплексных ионов [Co(CN)4]2-, [Hg(CN)4]2-, [Cd(CN)4]2- соответственно равны 8×10-20, 4×10-41, 1,4×10-17. В каком растворе, содержащем эти ионы (при равной молярной концентрации), ионов CN- больше? Напишите выражения для констант нестойкости указанных комплексных ионов.
314. Напишите уравнения вторичной диссоциации и выражения для констант нестойкости комплексных ионов: [Ag(СN)2]-, [Ag(NH3)2]+, [Ag(SCN)2]-. Зная, что константы нестойкости соответственно равны
1,0×10-21, 6,8×10-8, 2,0×10-11, укажите, в каком растворе, содержащем эти ионы (при равной молярной концентрации), больше ионов Ag+.
315. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Ni(H2O)5Cl]Cl2, Na3[AlF6], [Co(NH3)6]Cl3. Напишите уравнения диссоциации в водном растворе комплексного соединения [Co(NH3)6]Cl3 и выражения для константы диссоциации и константы нестойкости.
316. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения 2KCN×Fe(CN)3×H2O; к.ч.=6; б) исходные соединения NiCl2×5 H2O; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации и выражения для константы диссоциации и константы нестойкости.
317. Составьте координационные формулы комплексных соединений по следующим данным: а) исходные соединения 2KSCN×Pt(NO2)2; к.ч. = 4; б) исходные соединения CrCl3×3H2O×3NH3; к.ч. = 6. Для одного из полученных комплексных соединений напишите уравнения диссоциации и выражения для константы диссоциации и константы нестойкости.
318. Определите, чему равны заряд комплексного иона, степень окисления и координационное число комплексообразователя в соединениях [Co(NH3)5Br]Cl2, K2[PtI4], Na3[Al(OH)6]. Напишите уравнения диссоциации в водном растворе комплексного соединения Na3[Al(OH)6] и выражения для константы диссоциации и константы нестойкости.
319.Какие комплексные соединения называются двойными солями? Напишите равнения диссоциации в водном растворе солей K4[Fe(CN)6] и NH4Fe(SO4)2. Для комплексного соединения определите заряд комплексного иона, степень окисления и координационное число комплексообразователя.
320. Константы нестойкости комплексных ионов [Co(NH3)6]3+, [Fe(CN)6]4-, [Fe(CN)6]3- соответственно равны 6,2×10-36, 1,0×10-37, 1,0×10-44. Какой из этих ионов является более прочным? Напишите выражения для констант нестойкости указанных комплексных ионов и формулы соединений, содержащих эти ионы.
S – элементы (… ns1-2)*
321. Какую степень окисления может проявлять водород в своих соединениях? Напишите электронные и молекулярные уравнения реакций, в которых газообразный водород играет роль окислителя, и в которых – роль восстановителя.
322. Составьте электронные и молекулярные уравнения реакций взаимодействия натрия с водородом, кислородом, азотом и серой. Назовите полученные соединения. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
323. Напишите уравнения реакций взаимодействия с водой следующих соединений: пероксида натрия, сульфида натрия, гидрида кальция и нитрида натрия. Для окислительно-восстановительной реакции составьте электронные уравнения.
324. Дайте краткую характеристику свойств пероксида натрия Na2O2. Напишите уравнения реакций: а) получения пероксида натрия; б) взаимодействия с водой; в) взаимодействия с серной кислотой; г) взаимодействия с оксидом углерода (IV). Для окислительно-восстановительной реакции составьте электронные уравнения.
325. Какие свойства может проявлять пероксид водорода H2O2 в окислительно-восстановительных реакциях? Почему? На основании электронных уравнений напишите уравнения реакций взаимодействия пероксида водорода: а) с оксидом серебра (I); б) с иодидом калия.
326. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
NaCl ® NaOH ® Na2CO3 ® NaNO3 ® NaNO2.
Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора NaCl. Для окислительно-восстановительной реакции составьте электронные уравнения.
327.Как можно получить гидрид и нитрид кальция? Напишите уравнения реакций взаимодействия этих соединений с водой. К окислительно-восстановительным реакциям составьте электронные уравнения.
328.Гидроксид какого из s-элементов проявляет амфотерные свойства? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия этого гидроксида а) с кислотой и б) со щелочью.
_______________________________________________________________
*Общая электронная формула, где n – главное квантовое число.
329.При пропускании оксида углерода (IV) через известковую воду (раствор Са(ОН)2) образуется осадок, который при дальнейшем пропускании СО2 растворяется. Дайте объяснение этому явлению. Составьте уравнения реакций.
330.Составьте электронные и молекулярные уравнения реакций взаимодействия: а) бериллия с раствором щелочи; б) магния с концентрированной серной кислотой, имея в виду максимальное восстановление последней.
331.При сплавлении оксид бериллия взаимодействует с оксидом кремния (IV) и с оксидом натрия. Напишите уравнения соответствующих реакций. О каких свойствах оксида бериллия говорят эти реакции?
332.Как можно получить карбид кальция? Что образуется при его взаимодействии с водой? Напишите уравнения соответствующих реакций. Для окислительно-восстановительной реакции составьте электронные уравнения.
333.Как можно получить гидроксиды щелочных металлов? Почему щелочи необходимо хранить в хорошо закрытой посуде? Составьте электронные и молекулярные уравнения реакций, протекающих при насыщении гидроксида натрия: а) хлором; б) оксидом серы (IV); в) сероводородом.
334.Чем можно объяснить большую восстановительную способность щелочных металлов? Составьте электронные и молекулярные уравнения реакций взаимодействия металлического натрия: а) с водородом; б) с водой; в) с кислородом; г) с азотом.
335. Какие из s – элементов II группы периодической системы относятся к щелочно-земельным металлам? Назовите природные соединения этих металлов. Составьте электронные и молекулярные уравнения реакций взаимодействия одного из этих металлов с водой, с разбавленной азотной кислотой, с разбавленной и концентрированной серной кислотой.
336. Составьте электронные и молекулярные уравнения реакций взаимодействия: а) кальция с водой; б) магния с азотной кислотой, учитывая максимальное восстановление последней.
337.Составьте молекулярные и ионно-молекулярные уравнения реакций, которые нужно провести для осуществления следующих превращений: CaCl2 ® Ca(NO3)2 ® CaCO3 ® CaO ® Ca(OH)2 ® Ca(HSO4)2
338.Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
NaCl ® Na ® Na2O2 ® Na2О ® Na2SO4.
Составьте электронные уравнения процессов, происходящих на электродах при электролизе расплава NaCl. Для окислительно-восстановительных реакций составьте электронные уравнения.
339.Какие соединения называют: каустической содой, кристаллической содой, кальцинированной содой и поташем? Как получают их в промышленности? Напишите уравнения соответствующих реакций.
340.Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений:
Сa ® СaH2 ® Сa(OН)2 ® СaСO3 ® Сa(НСO3)2.
Для окислительно-восстановительных реакций составьте электронные уравнения.
 2015-01-30
2015-01-30 3083
3083
