Основываясь на характеристиках кристаллической структуры типа алмаза, рассчитайте следующие параметры кремния:
а) число атомов, содержащихся в элементарной ячейке (единичном кубе);
б) атомный радиус структуры, полагая, что длина ребра элементарной ячейки кристалла кремния a ≈ 0,54 нм;
в) число атомов в 1 см3;
г) число атомов, приходящихся на единицу площади в кристаллических плоскостях (111), (100) и (110). Приведенные значения индексов Миллера характеризуют положение плоскостей в кристалле. Три указанные здесь плоскости существенны для технологии полупроводниковых приборов;
д) удельную плотность, положив, что атомная масса кремния равна 28.
Решение: 
а) Структура типа алмаза подобна кубической гранецентрированной структуре, каждой вершине которой принадлежит 1/8 атома, центру каждой грани – 1/2 атома. Однако здесь атом в центре тетраэдра чередуется с атомом, принадлежащим вершине (т.е. на каждую элементарную ячейку приходится дополнительно (1/2) 8 тетраэдров). Следовательно, число атомов в элементарной ячейке структуры типа алмаза составляет 8(1/8) + 6(1/2) + 4 = 8.
б) Атомный радиус представляет собой длину отрезка, соединяющего два ближайших узла. Решетку типа алмаза можно получить из двух кубических гранецентрированных решеток, если одну из них сместить по диагонали куба в соответствии с вектором трансляции (а /4, а /4, а /4). Тогда атомный радиус в решетке типа алмаза составит
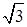 · а /4 =
· а /4 = 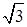 ·0,54/4 = 0,23 нм.
·0,54/4 = 0,23 нм.
Число атомов в 1 см3
N = 8/ а 3= 8·1021/(0,54)3 ≈ 5·1022 см–3.
в) Удельное число атомов в плоскости (111) можно подсчитать, обратившись к рис. 7. Сторона треугольника в плоскости (111) b = a 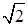 . Его площадь А = (1/2) а 2
. Его площадь А = (1/2) а 2 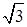 . Число атомов, относящихся к данному треугольнику, 3(1/6) + 3(1/2) = 2. Тогда число атомов на единицу площади 2/А = 4/(а 2
. Число атомов, относящихся к данному треугольнику, 3(1/6) + 3(1/2) = 2. Тогда число атомов на единицу площади 2/А = 4/(а 2 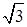 ) = 7,9·1014 см–2.
) = 7,9·1014 см–2.
а) б) в)
 |
Рис. 7. Плоскости (111), (100) и (110)
Аналогично, для плоскости (100) число атомов, приходящихся на квадрат со стороной а, составляет 4(1/4) + 1 = 2. Число атомов, приходящихся на единицу площади, составляет 2/ А = 2/ a 2= 6,8·1014 см–2.
Наконец, в плоскости (110) имеется 4(1/4) + 2(1/2) = 2 атома, относящихся к выделенному прямоугольнику площадью А = а 2 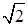 . Тогда поверхностная плотность размещения атомов составляет 2/ А = 2(а 2
. Тогда поверхностная плотность размещения атомов составляет 2/ А = 2(а 2 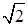 ) = 4,8·1014 см–2.
) = 4,8·1014 см–2.
г) Плотность кремния равна массе атомов, содержащихся в элементарной ячейке, деленной на объем этой ячейки. Масса атома кремния равна молярной массе этого элемента Ра (г/моль), деленной на число Авогадро N 0= 6,02·1023. Поэтому плотность кремния
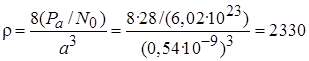 кг/м3.
кг/м3.
 2015-01-30
2015-01-30 4599
4599
