Подгру́ппа ме́ди — химические элементы 11-й группы периодической таблицы химических элементов. В группу входят переходные металлы, из которых традиционно изготавливают монеты: медь Cu, серебро Ag и золото Au. На основании строения электронной конфигурации, к этой же группе относится и рентгений Rg, но в «монетную группу» он не попадает (это недолго живущий трансактинид с периодом полураспада 26 сек). Название монетные металлы официально не применяется к 11 группе элементов, поскольку для изготовления монет используются и другие металлы
Все элементы подгруппы являются относительно химически инертными металлами. Характерны также высокие значения плотности, но относительно небольшие температуры плавления и кипения, высокая тепло- и электропроводность.
Свойства металлов подгруппы меди [2]
| Атомный номер | Название, символ | Электронная конфигурация | Степени окисления | p, г/см³ | tпл, °C | tкип, °C |
| Медь Cu | [Ar] 3d104s1 | 0, +1, +2 | 8,96 [3][4] | 1083 [3][4] | 2543 [3][4] | |
| Серебро Ag | [Kr] 4d105s1 | 0, +1, +3 | 10,5 [5] | 960,8 [5] | 2167 [5] | |
| Золото Au | [Xe] 4f145d106s1 | 0, +1, +3 | 19,3 [6] | 1063,4 [6] | 2880 [6] |
Особенностью элементов подгруппы является наличие заполненного предвнешнего 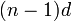 -подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[7]
-подуровня, достигаемое за счёт перескока электрона с ns-подуровня. Причина такого явления заключается в высокой устойчивости полностью заполненного d-подуровня. Эта особенность обусловливает химическую инертность простых веществ, их химическую неактивность, поэтому золото и серебро называют благородными металлами.[7]
Эти металлы, особенно серебро, имеют необычные свойства, которые придают им важное значение для промышленного применения, помимо их значения в качестве денежной и декоративной ценности. Они являются отличными проводниками электричества, самыми лучшими среди всех металлов. Серебро также является самым лучшим теплопроводящим элементом и самым лучшим отражателем света, а также имеет такое необычное свойство, как чернение, образование на его поверхности тёмного слоя, при этом электроводность его не ухудшается.
Медь легко вытягивается в проволоку и прокатывается в тонкие листы, но сравнительно мало активна. В сухом вохдухе и кислороде при нормальных условиях медь не окисляется. Но она достаточно легко вступает в реакции: уже при комнатной температуре с галогенами, например с влажным хлором образует хлорид CuCl2, при нагревании с серой образует сульфид Cu2S, с селеном. Но с водородом, углеродом и азотом медь не взаимодействует даже при высоких температурах. Кислоты, не обладающие окислительными свойствами, на медь не действуют, например, соляная и разбавленная серная кислоты. Но в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соотвествующих солей:
2Cu + 4HCl + O2 = 2CuCl2 + 2H2O.
 2015-01-30
2015-01-30 8380
8380