Радикальная сополимеризация. Относительная реакционная способность мономеров. Типы сополимеризации. Общие закономерности ионной полимеризации. Катионная полимеризация. Характеристика мономеров. Катализаторы и сокатализаторы катионной полимеризации. Кинетика катионной полимеризации. Влияние температуры и природы растворителя.
План лекции
1. Механизм сополимеризации
2. Особенности ионной полимеризации
3. Механизм катионной полимеризации
4. Кинетика катионной полимеризации
1. Процесс полимеризации 2-х и более мономеров называют сополимеризацией.
Сополимеризация включает: инициирование, рост и обрыв цепи. Но все стадии осложнены присутствием нескольких мономеров.
При сополимеризации 2-х мономеров М1 и М2 образуются не менее 4-х типов свободных радикалов:
|
~ ·M1 + M1 → ~ M1 – ·M1
|
~ ·M1 + M2 → ~ M1 – ·M2
|
|
~ ·M2 + M1 → ~ M2 – ·M1
2.Ионная полимеризация протекает по механизму цепных реакций. Растущая цепь имеет природу иона углерода + карбокатион – карбанион. Ионы образуются под влиянием катализаторов ионной полимеризации. Ионная полимеризация в отличие от радикальной характеризуется гетеролитическим разрывом связей в мономере.
В зависимости от знака заряда на конце растущей цепи различают анионную и катионную полимеризацию.
1. Растущей частицей является ион. Ионы более активные, чем радикалы.
2. Инициирующая система каталитические, то есть восстанавливают свою исходную структуру (при радикальной- инициаторы расходуются необратимо).
3. Катализаторы не только инициируют, но и координируют молекулы мономера около растущих частиц. Это позволяет получать регулярное пространственное расположение звеньев мономера.
4. Ионная полимеризация проводится при низких температурах.
5. Скорость ионной полимеризации высока.
6. Так как ионная полимеризация идет в среде растворителя, закономерности процесса зависит от его полярности.
7. Образующийся полимер имеет высокую ММ и узкое ММР. Цепи полимера имеют мало разветвлений основной цепи.
3. Катализаторы катионной полимеризации: сильные протонные кислоты: H2SO4, H3PO4, HCl, HClO4; апротонные кислоты (кислоты): AlCl3, BF3,SnCl4, TiCl4.
Протонные кислоты диссоциируют: 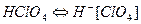
При использовании кислот кроме катализаторов в систему вводят сокатализаторы: вода, галогеноводородные кислоты, спирты. Образующиеся комплексные соединения имеют свойства сильной кислоты.
Мономеры: изобутилен, винилалкиловый эфир, стирол, 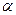 -метилстирол, имеющие электронно-донорные заместители.
-метилстирол, имеющие электронно-донорные заместители.
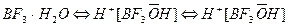
1. Протон присоединяется к молекуле мономера и образуется ионная пара:
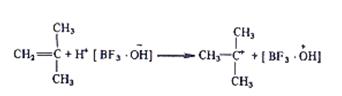
2. Рост цепи осуществляется присоединением мономера к образующимся катиону.
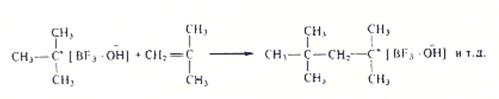
3.Обрыв цепи путем рекомбинации невозможен:
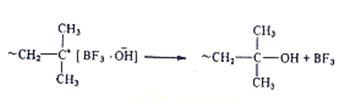
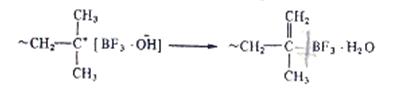
4.Скорость образования макромолекул является суммой скоростей 4 стадий:инициирования vин, роста цепи vр, обрыва цепи vои передачи цепи на мономер vп.
vин ==kин[кат][сокат][М];
vр =kр[M][M+]; vо=kо[M+]; vп =kп[M][M+]
В стационарный период:
vин == vо или kин[кат][сокат][М]= kо[M+];
Значит, концентрация активных макрорадикалов равна:
[M+]=(kин/kо) [кат][сокат][М].
Контрольные вопросы
1. Сополимеризация и сополимеры
2. Основные стадии сополимеризации
3. Ионная полимеризация
4. Катионная полимеризация
5. Катализаторы катионной полимеризации
Лекция 20.
Механизм и кинетические закономерности анионной полимеризации. Катализаторы анионной полимеризации. Стереорегулирование при ионной полимеризации. Ионно-координационная полимеризация. Стереоспецифические эффекты в реакциях ионно-координационной полимеризации. Катализаторы Циглера-Натта.
План лекции
1. Механизм анионной полимеризации
2. Механизм ионно-координационной полимеризации
3. Катализаторы Циглера-Натта
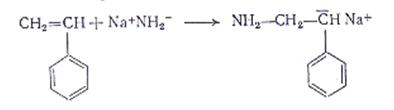
1.Катализаторы: вещества основного характера, NaNH2, щелочные металлы (Li, Na, K, Pb, Cs), их алкилы.
Мономеры: содержат электроакцепторные заместители: акрилонитрил, ММА, бутадиен. Катализатор-амид натрия:
1. Инициирование
Катализатор – щелочной металл
1. Инициирование – образуется анион-радикал мономера
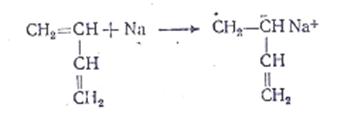
В результате взаимодействия двух анион-радикалов по свободнорадикальным концам образуется бианион, являющийся активным центром полимеризации
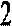
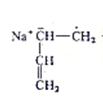
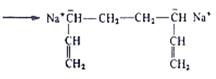
Процессы анионной полимеризации протекают без обрыва кинетической цепи с образованием «живущих» полимеров. Активность таких полимеров может сохраняться длительное время, что позволяет получать блок – сополимеры.
Катализатор – алкил щелочного металла.
Такие катализаторы могут координировать (располагать) молекулы мономера в определенном пространственном положении, которое сохраняется в структуре формирующейся макромолекулы.
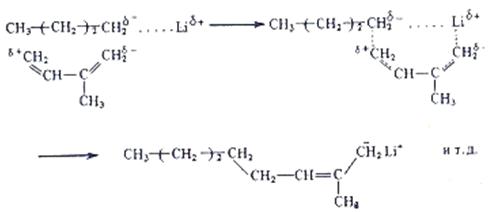
В процессе роста цепи молекулы изопрена внедряется между алкильным остатком, имеющим отрицательный заряд и положительно заряженный ион Li. При этом в шестичленном комплексе изопрена с бутиллитием молекула изопрена принимает конфигурацию цис (по расположению метиленовых групп, относительно плоскости двойной связи), которая сохраняется при последующих актах роста цепи. Получающийся полиизопрен с высоким содержанием цис – 1,4 звеньев, является синтетическим аналогом НК и обладает высокоэластическими свойствами.
2.Ионно-координационной полимеризацией называют каталитический процесс образования макромолекул, в котором в стадии разрыва связи в мономере предшествует возникновение координационного комплекса между ним и активным центром.
Для диеновых мономеров каталитическая система обеспечивает формирование пространственно регулярных полимеров. Наиболее важной является структура 1,4-цис, обеспечивающая проявление ВЭ свойств полибутадиена и полиизопрена в широком температурном интервале от - 1100 до +7000.
По ионно – координационному механизму получают полиэтилен низкого давления (ПЭНД), полипропилен (ПП), полибутадиен (ПБ), полиизопрен (ПИз).
ПЭНД имеет линейную структуру, в отличие от ПЭВД, полимеризующегося по радикальному механизму. ПЭВД имеет боковые ответвления от основной цепи и меньшую степень кристалличности.
Полимеризация диеновых мономеров (бутадиен, изопрен) по ионно-координационному механизму в присутствии катализаторов: Al (C2H5)*TiCl4 позволяет получить ПИз до 95% звеньев цис-1,4 и в ПБ до 92% звеньев в присутствии Al(C2H5) *TiI4.
Процессу полимеризации предшествует координация молекулы мономера у атома Ti и внедрение мономера в состав комплекса за счет разрыва связи Ti—С1. При этом мономер выступает в роли донора it-электронов, а переходный металл катализатора благодаря наличию вакантных орбиталей является акцептором. За счет координации с донором образуется л-комплекс, возникновение которого приводит к ослаблению связи Ti—С1 в катализаторе, и облегчается внедрение мономера по этой связи с образованием нового шестичленного комплекса с последующей его перестройкой в четырехчленный. Полимеризация производных этилена может быть представлена следующей схемой:
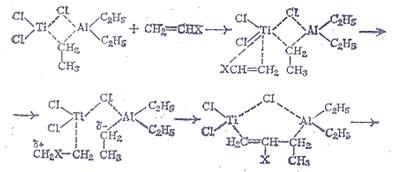
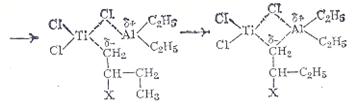
В регенерированном четырехчленном цикле содержится один из атомов углерода молекулы мономера, соединенный с атомами титана и алюминия, а исходная этильная группа удаляется из цикла вместе с другим атомом углерода винилового мономера. Дальнейшее присоединение мономера идет аналогичным образом и происходит постепенное вытеснение образующейся полимерной молекулы из структуры комплексного катализатора. Механизм полимеризации предполагает строго определенное пространственное расположение заместителей при атоме углерода относительно плоскости основной молекулярной цепи полимер (стереорегулярность).
Наиболее склонны к полимеризации под действием этих катализаторов мономеры с повышенной электронной плотностью на двойной связи. Кроме того, при оценке активности мономера следует учитывать роль стерических факторов в реакции внедрения мономеров. Так, несмотря на то, что электронная плотность на двойной связи этилена меньше, чем у пропилена, скорость его полимеризации значительно выше, так как отсутствуют стерические препятствия при внедрении мономера.
3. Комплексообразование мономер – катализатор обусловливает возможность синтеза стереорегулярных полимеров. Катализаторы, вызывающие стереорегулирование в процессе присоединения мономерных звеньев называют стереоспецифическим (Циглера-Натта). Эти катализаторы образуются при взаимодействии органических производных металлов I-III групп с солями (хлоридами) переходных металлов IV-VIII групп.
Варьируя состав катализатора можно регулировать их активность и стереоспецифичность действия, то есть способность «отбирать» при полимеризации мономерные звенья определенной конфигурации и ориентировать их. Наиболее часто используют комплексы на основе алюминийалкилов и производных титана и ванадия. Наибольшие значения эти катализаторы имеют при полимеризации этилена, пропилена, бутадиена, изопрена.
Наибольшее промышленное применение получил комплекс, образующийся при взаимодействии TiCl4 с триэтилалюминием Al(C2H5)3. При этом происходит восстановление приходного металла до TiCl3, образуется 4х – членный комплекс. Наибольшее влияние на процесс стереорегулирования оказывает строение соединений металлов переменной валентности, входящих в состав комплекса. Широко применяемый TiCl3 в зависимости от технологии его получения может иметь несколько кристаллических модификаций, из которых наибольшей стереоспецифичностыо характеризуется α-TiCl3. Эта модификация состоит из трехслойных кристаллических пластин: (вдоль основной кристаллической оси два слоя атомов хлора чередуются со слоем атомов титана). Рост полимеров происходит на боковых гранях кристаллов. Слоистую структуру имеют также γ- и ß-формы TiCl3.
Контрольные вопросы
1. Ионная полимеризация
2. Катализаторы ионной полимеризации
3. Основные полимеры получаемые при ионной полимеризации
4. Ионно-кординационная полимеризация
5. Катализаторы ионно-кординационной полимеризации
6. Основные стадии ионно-координационной полимеризации
Лекция 21
Ступенчатые процессы синтеза полимеров и их отличительные особенности. Реакционная способность мономеров и олигомеров. Принцип Флори. Типы и характер реакций поликонденсации. Уравнение Карозерса. Кинетика линейной поликонденсации. Трехмерная поликонденсация, коэффициент разветвления, точка гелеобразования. Поликонденсации: в расплаве, растворе, на границе раздела фаз. Ступенчатая (миграционная) полимеризация, отличительные особенности. Механизм миграционной полимеризации.
План лекции
1. Признаки ступенчатых процессов синтеза
2. Виды мономеров для поликонденсации
3. Виды поликонденсации
4. Механизм поликонденсации
1.К ступенчатым процессам синтеза полимеров относят поликонденсацию и ступенчатую полимеризацию.
Поликонденсацией называют ступенчатый процесс получения полимеров из би – или полифункциональных соединений, в которых рост макромолекул происходит путем химического взаимодействия функциональных групп молекул мономеров друг с другом и с n - мерами, накапливающимися в ходе реакции между собой. На концах макромолекул всегда присутствуют функциональные группы.
Признаки поликонденсации:
1. Ступенчатый процесс (полимеризация – цепной);
2. Механизм замещения (полимеризация - присоединение);
3. Возможна обратимость (полимеризация – необратима);
4. Выделяются низкомолекулярные соединения (при полимеризации – не выделяется);
5. Строение составного звена отличается от строения мономера, так как выделяются НМС (при полимеризации – не отличается и эквивалентно строению мономера);
6. Средняя ММ от степени конверсии зависит: чем больше степень превращения мономера в полимер, тем больше ММ (при полимеризации ММ от степени конверсии не зависит);
7. Молекулы мономера исчезают на ранних стадиях реакции (при полимеризации – в конце процесса).
2. В качестве мономеров при поликонденсации применяют соединения с 2 или более функциональными группами: 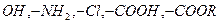 .
.
Бифункциональные мономеры делят на:
1. Мономеры, содержащие различные функциональные группы, способные взаимодействовать друг с другом: оксикислоты 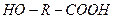 , аминокарбоновые кислоты
, аминокарбоновые кислоты 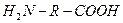 .
.
2. Мономеры, содержащие одинаковые функциональные группы, неспособные в условиях реакции взаимодействовать друг с другом: диамины 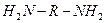 , дикарбоновые кислоты
, дикарбоновые кислоты 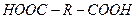 .
.
3. Мономеры, содержащие одинаковые функциональные группы, способные взаимодействовать друг с другом – гликоли, 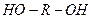 .
.
При поликонденсации в первом случае можно использовать один мономер: оксикислоты образуют сложные полиэфиры.
Во втором случае требуется два мономера, диамин и дикарбоновая кислота.
В третьем случае синтез проводят, используя один мономер с одинаковыми функциональными группами. Синтез простых эфиров из гликоля:
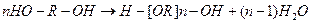 .
.
3. Различают гомо – и гетерополиконденсацию.
Гомополиконденсацией называют реакции, в которых участвуют только молекулы одного мономера, содержащего 2 типа функциональных групп:
Аминокислоты
nH2N-R-CO-OH ® H[-NH-R-CO-]nOH + (n-1)H2O
Гетерополиконденсацией называют реакции с участием молекул мономеров, содержащих различные функциональные группы, способные взаимодействовать друг с другом.
Диамины и дикарбоновые кислоты:
nH2N-R-NH2 + nHO-CO-R/-CO-OH ®
® H[-NH-R-NH-CO-R/-CO-]nOH + (2n-1)H2O
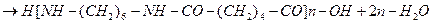
Полиамид (найлон -6,6).
Реакцию, в которой помимо мономеров необходимых для ее протекания, участвуют другие мономеры, называют сополиконденсацией.
Различают линейную и трехмерную поликонденсацию. При линейной поликонденсации из бифункциональных мономеров получают линейные, а при трехмерной – из мономеров с 3 и большим числом функциональных групп образуются разветвленные или трехмерные (сетчатые, сшитые) структуры.
Поликонденсация бывает обратимой (равновесной) и необратимой (неравновесной). Отличием обратимых от необратимых является возможность протекания в обратимых процессах обратных реакций, то есть взаимодействия полимера с низкомолекулярным продуктом (НМ), приводящего к распаду полимерных цепей.
В обратимых реакциях для сдвига равновесия в сторону образования полимеров, большое значение имеет вывод из реакционной среды, воды или другого НМ продукта реакции.
Для обратной поликонденсации степень поликонденсации n:
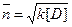
к – константа поликонденсационного равновесия.
D – содержание выделяющегося НМ продукта. Следовательно, для подавления обратных реакций необходимо удалять из реакционной среды НМ продукты.
Формирование макромолекулы происходит в результате реакций функциональных групп мономеров друг с другом.
Поэтому, если такие группы содержатся в исходной смеси в эквимолярных соотношениях, то реакции их друг с другом будут продолжаться до полного их исчерпания. При этом на концах образующихся макромолекул всегда присутствуют функциональные группы. Если в системе имеется избыток функциональных групп одной природы, то функциональные группы противоположенной природы быстро израсходуются. Избыточные концевые функциональные группы одной природы не могут реагировать друг с другом, рост макромолекул прекратится.
Избыток функциональных групп одного из мономеров играют роль стопора реакции образования полимера и прерывает эту реакцию на стадии низкомолекулярных продуктов.
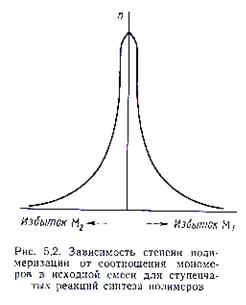
Для достижения высокой ММ требуется эквимольное соотношение мономеров.
Поликонденсацией получают феноло-формальдегидные, мочевино-формальдегидные, полиэфирные полимеры.
Ступенчатая (миграционная) полимеризация по своим закономерностям и структуре образующегося полимера сходна с поликонденсацией. Присоединение каждого последующего мономера к растущей цепи, которая тоже является устойчивой частицей, осуществляется путем перемещения (миграции) водорода. Такой процесс имеет место при синтезе полиуретанов из изоцианатов и гликолей.
Контрольные вопросы
1. Ступенчатые процессы синтеза полимеров
2. Реакционная способность мономеров и олигомеров
3. Поликонденсация в расплаве
4. Поликонденсация на границе раздела фаз
5. Миграционная полимеризация
Лекция 22
Особенности химических реакций полимеров. Химические превращения, не вызывающие изменения степени полимеризации. Внутримолекулярные превращения. Полимераналогичные превращения и их значение для химической модификации полимеров. Полимераналогичные превращения диеновых эластомеров.
План лекции
1. Виды химических превращений полимеров
2. Внутримолекулярные превращения полимеров
3. Полимераналогичные превращения полимеров
1. Химические реакции полимеров не отличаются от реакций низкомолекулярных соединений, но большие размеры макромолекул приводят к некоторым особенностям.
Химические реакции полимеров делят на два вида:
1) Химические превращения, не вызывающие изменение степени полимеризации.
2) Химические превращения, вызывающие изменение степени полимеризации.
К химическим превращениям, не вызывающим изменения степени полимеризации относят: внутримолекулярные и полимераналогичные превращения.
Внутримолекулярными называют процессы, в результате которых изменяется строение, а иногда и химический состав макромолекул, но не сопровождающиеся присоединением реагентов. Полимераналогичными называют процессы взаимодействия функциональных групп макромолекул с низкомолекулярными реагентами, не влияющие на степень полимеризации и строение основной цепи и приводящие к получению полимераналогов.
К химическим превращениям, вызывающим изменение степени полимеризации относят: реакции сшивания (вулканизация каучуков, отверждение олигомеров, получе6ие блок и привитых сополимеров); реакции деструкции.
2. Внутримолекулярные превращения происходят под действием света, излучений высокой энергии, тепла (внутримолекулярные перегруппировки боковых групп, внутримолекулярные перегруппировки боковых групп, изомерные превращения, циклизация, изомеризация, миграция двойных связей, образование ненасыщенных связей). Например, миграция двойных связей в ненасыщенных полимерах; изомерные превращения каучуков; образование сопряженных ненасыщенных связей в цепи главных валентностей. Например, при дегидрохлорировании поливинилхлорида алкоголятами щелочных металлов получают блок-сополимер, состоящий из блоков исходного поливинилхлорида и блоков поливинилена.
~CH2 - CHCl - CH2 - CHCl - CH2 - CHCl ~ 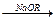
® ~CH = CH - CH = CH - CH = CH ~ + HCl
поливинилен
При взаимодействии ненасыщенных полимеров с катализаторами ионного типа, например, полибутадиена с комплексами солей кобальта или никеля и алюминийорганических соединений, применяемыми при ионно-координационной полимеризации происходит миграция двойных связей вдоль полимерной цепи.
~СH2CH=CHCH2CH2CH=CHCH2CH2CH=CHCH2~ ®
® ~СH2CH=CHCH2CH2CH=CHCH2CH=CHCH2CH2~ ®
® ~СH2CH=CHCH2CH2CH2CH=CHCH=CHCH2CH2~
3. Полимераналогичные превращения приводят к изменению строения боковых функциональных групп макромолекул. Большое практическое значение эти превращения имеют для химической модификации полимеров.
При этом могут образовываться новые функциональные группы.
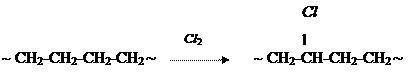 Хлорирование полиэтилена (ПЭ):
Хлорирование полиэтилена (ПЭ):
Введение хлора снижает степень кристалличности полимера, повышает плотность.
Сульфохлорирование ПЭ:
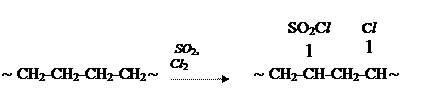
Образующийся сульфохлорированный ПЭ приобретает способность к
вулканизации.
Частичное хлорирование ПВХ улучшает его растворимость, что используется для получения волокна «Хлорин».
Хлорирование каучуков позволяет повысить химическую стойкость и адгезию к металлическим поверхностям.
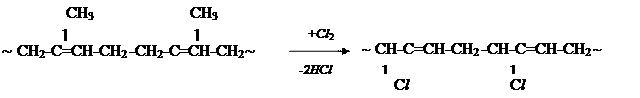
Контрольные вопросы
1. Виды химических превращений
2. Химические реакции, приводящие к изменению молекулярной массы
3. Внутримолекулярные и полианалогичные превращения полимеры
4. Хлорирование каучуков
 2015-02-27
2015-02-27 6079
6079








