6. Какое количество аминокислотных остатков содержит один виток a-спирали белка
3,6-3,7
7. Назовите факторы, способствующие денатурации белков
- высокая температура (более 50 °С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей;
- интенсивное встряхивание раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул;
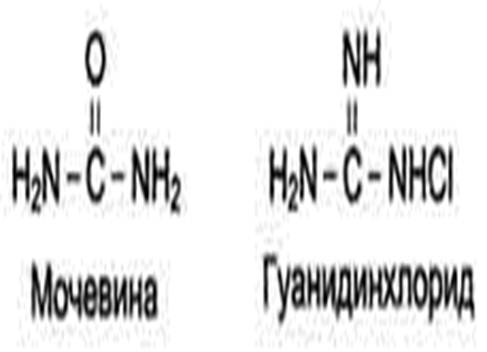
- органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конформа-ционным изменениям. Для денатурации белков в биохимических исследованиях часто используют мочевину или гуанидинхлорид, которые образуют водородные связи с амино- и карбонильными группами пептидного остова и некоторыми функциональными группами радикалов аминокислот. Происходит разрыв связей, участвующих в формировании вторичной и третичной структуры нативных белков, и образование новых связей с химическими реагентами;
- кислоты и щелочи, изменяя рН среды, вызывают перераспределение связей в молекуле белка;
- соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков (чаще всего с -SH), изменяя их конформацию и активность;
- детергенты - вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу (такие вещества называют амфифильными). Гидрофобные радикалы белков взаимодействуют с гидрофобными частями детергентов, что изменяет конформацию белков. Денатурированный под действием детергентов белок обычно остаётся в растворённом виде, так как гидрофильные части денатурирующего вещества удерживают его в растворе. К наиболее известным детергентам относят различные мыла (рис. 1-15).
8.Какое количество и какие полипептидные цепи образуют молекулу иммуноглобулина G
состоит из целой L-цепи и N-концевой половины H-цепи, соединённых между собой дисульфидной связью, тогда как FC-фрагмент (48 кДа) образован C-концевыми половинами H-цепей. Всего в молекуле IgG 12 доменов (участки, сформированные из β-структуры и α-спиралей полипептидных цепей Ig в виде неупорядоченных образований, связанных между собой дисульфидными мостиками аминокислотных остатков внутри каждой цепи): по 4 на тяжёлых и по 2 на лёгких цепях.
9. Назовите основные характеристики вторичной структуры ДНК.
Наиболее распространённой формой вторичной структуры ДНК является двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль[5]. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. Впервые эту структуру описали Джеймс Уотсон и Френсис Крик в 1953 году[6].
В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
§ водородные связи между комплементарными основаниями (две между аденином и тимином, три — между гуанином и цитозином);
§ стэкинг-взаимодействия;
§ электростатические взаимодействия;
§ Ван-дер-Ваальсовы взаимодействия.
10.Дайте определение термину «фолдинг»
Фолдинг (folding) - Процесс сворачивания полипептидной цепи в правильную пространственную структуру. В результате на внешней поверхности белковой глобулы формируются полости активных центров, а также места контактов субъединиц мультимерных белков друг с другом и сбиологическими мембранами. В биохимии и молекулярной биологии фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура).
 2015-03-20
2015-03-20 1382
1382








