1. На экране мышкой выбрать программу «ФА» и нажать два раза.
2. Поместить мокрую пленку в правый верхний угол сканера, альбуминовые пятна справа, маркировка слева внизу.
3. В раскрытом окне программы выбрать кнопку «СКАНИРОВАНИЕ». На экране появится панель сканера.
4. На ней входим в опцию "Сканировать". Затем выбираем в меню "Профиль сканирования" и далее "Загрузить". В появившемся окне выбираем в сохраненном списке имя вашей настройки ("Альбумин") и нажимаем кнопку "Загрузить". На панели сканера нажимаем клавишу "Принять".
5. В верхнем окне программы появится картинка с разгонкой белков. При необходимости данный образец можно поместить в БАНК, нажав клавишу «ПОМЕСТИТЬ В БАНК».
6. Убрать пленку со сканера. Стекло и поверхность крышки протереть спиртом и не закрывать до полного высыхания.
7. Нажать клавишу «ОБРАБОТКА ОБРАЗЦА».
8. Выбрать одну из восьми линий образца и нажать на левую кнопу мышки, при этом в левом нижнем окне появится график пяти или более фракций, а линия разгонки выделится красным цветом.
9. Проверить деление на фракции, при необходимости добавить, удалить или переместить линии, нажимая на одноименные клавиши.
10. Ввести фамилию пациента, дополнительные данные.
11. Ввести значение общего белка и нажать «Enter».
12. Распечатать протокол, нажимая клавишу «ПЕЧАТАТЬ ПРОТОКОЛ».
13. При необходимости поместить анализ в АРХИВ, нажимая клавишу «ПОМЕСТИТЬ В АРХИВ».
14. Повторить все действия с пункта 8 по пункт 13 для следующих пациентов.
15. Нажать клавишу «ВЫХОД ИЗ ПРОГРАММЫ».
16. Подтвердить действие нажатием клавиши «Да».
17. Нажать «Пуск» в нижнем левом углу экрана.
18. Выбрать опцию «Завершение работы».
19. Выбрать опцию «Выключить компьютер».
20. Нажать кнопку «ОК».
Клинико-диагностическое значение исследования протеинограмм.
1-й тип протеинограмм характеризуется значительным уменьшением содержания альбумина и возрастанием уровня альфа-l и альфа-2-глобулинов; такая диспротеинемия обусловливается усилением биосинтеза белков острой фазы (альфа-1- и альфа-2-глобулинов, составляющих группу гликопротеинов) и подавлением (вследствие интоксикации, отчасти компенсаторно) продукции альбумина гепатоцитами. Наблюдается чаще всего при острых воспалительных процессах, а также при сепсисе, обширном свежем инфаркте миокарда, начальной стадии пневмоний, экссудативном туберкулезе легких, остром полиартрите. Аналогичные изменения обнаруживаются, если по какой-либо причине происходит обострение хронического воспалительного процесса. Содержание общего белка в крови не изменяется.
Интегральным показателем сдвигов в спектре белков при острых воспалительных процeccax является снижение показателей коэффициентов А/(альф-1- + альфа-2-глобулины) и А/альфа-2-глобулины. Характерная для этого типа протеинограмм денситограмма приведена на рисунке.
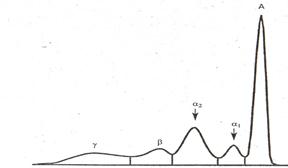 Рис. 2.
Рис. 2.
2-й тип содружественных сдвигов в протеинограмме отличается умеренным снижением выраженности фракции альбумина и значительным увеличением уровня альфа-2- (нередко альфа-l-) и гамма-глобулинов; последняя фракция белков усиленно синтезируется клеточными элементами системы фагоцитирующих мононуклеаров; содержание бета-глобулинов и общего белка не изменяется. Характерный признак - уменьшение показателя А/(альфа-2- + гамма-глобулины) ниже 2,2. Наблюдается при синдроме хронического воспаления (холецистит, цистит, пиелит, поздняя стадия пневмоний, хронические формы туберкулеза легких).
3-й тип протеинограмм характеризуется значительным уменьшением содержания альбумина, повышением концентрации альфа-2- и бета-глобулинов (за счет альфа-2-микроглобулинемии или увеличения уровня липопротеинов очень низкой плотности - ЛПОНП) при умеренном снижении уровня гамма-глобулинов (иммуноглобулинов G и А). Этот тип изменений свойствен синдрому нарушения функции почечного фильтра, выраженному токсикозу (токсикозу беременных), кахексии, нефротическому симптомокомплексу (обусловленному липоидозом или амилоидозом почек, рис. 3), нефриту, терминальной стадии туберкулеза легких и ряду других заболеваний. В этих случаях диспротеинемия происходит из-за преимущественной потери (вследствие повышенной проницаемости почечного фильтра) тех белков, которые отличаются сравнительно большой молекулярной массой (альбумин и гамма-глобулины).
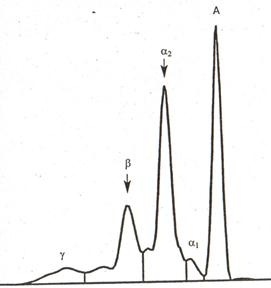 Рис. 3
Рис. 3
4-и тип протеинограмм характеризуется резким снижением содержания альбумина и значительным увеличением уровня всех глобулиновых фракций (вследствие их гиперпродукции в ответ на вызванное синдромом интоксикации угнетение биосинтеза альбумина в печени). Именуется типом злокачественных новообразований, наблюдается при метастатических новообразованиях с различной локализацией первичной опухоли.
5-и тип изменении протеинограммы - умеренное уменьшение содержания альбумина (из-за снижения протеосинтетической функции гепатоцитов), увеличение уровня гамма-глобулинов (в силу «раздражения» системы фагоцитирующих мононуклеаров и усиления продукции IgG, IgA, IgM) и менее выраженное - бета-глобулинов. Наблюдается при гепатитах, последствиях токсического повреждения печени. Такой тип протеинограмм свойствен также гемолитическим процессам, лейкемиям, злокачественным новообразованиям кроветворного и лимфатического аппарата, некоторым формам полиартрита дерматозам. У многих больных снижается уровень альфа-l-, альфа-2- и бета- глобулинов. Содержание общего белка не изменяется или уменьшается.
6-й тип протеинограмм отличается значительным снижением содержания альбумина, альфа-2-глобулинов (из-за глубоких дистрофических изменений гепатоцитов, приводящих к нарушению биосинтеза белков этой фракции) при сильном увеличении (отчасти компенсаторном) уровня гамма-глобулиновой фракции (за счет IgA и IgG), пятно которой на материале носителя - хроматаграфической бумаге и др. - нередко сливается с полоской бета-глобулинов, особенно при атрофическом циррозе; уровень альфа-l-глобулинов обычно не изменяется. Обнаруживается при циррозе печени (наблюдается также при тяжелых формах индуративного туберкулеза легких, хронического полиартрита, коллагенозов).
7-й тип изменений: уменьшение уровня альбумина и умеренное увеличение содержания альфа-2-, бета- и гамма-глобулинов - свойствен обтурационной желтухе, вызванной наличием камня в общем желчном протоке, закупоркой его раковой опухолью, злокачественным новообразованием в головке поджелудочной железы (что создает механическое препятствие оттоку желчи при синдроме холестаза).
8-й тип протеинограммы проявляется уменьшением уровня альбумина и большинства глобулиновых фракций за исключением фракции бета-глобулинов, содержание которых претерпевает резкое избирательное увеличение; свойствен бета-глобулиновым плазмоцитомам (бета-l-плазмоцитоме, бета-1-плазмоклеточной лейкемии и макроглобулинемии Вальденстрема).
9-й тип сдвигов в протеинограмме отличается значительным уменьшением уровня альбумина, альфа-2- и бета-глобулинов при увеличении концентрации гамма-глобулинов; характерен для гамма-глобулиновых плазмоцитом, макроглобулинемии.
10-й тип протеинограммы характеризуется избирательным увеличением содержания альфа-2-глобулинов на фоне снижения уровня остальных белковых фракций. Свойствен альфа-2-глобулиновым плазмоцитомам.
Уменьшение содержания белковых фракций при плазмоцитомах носит компенсаторный характер вследствие избирательного увеличения одной из них.
Так, при гипопротеинемии, вызванной недостаточным поступлением в организм белковых продуктов, а также выходам белка за пределы сосудов (через почки, желудочно-кишечный тракт - гастроэнтериты, в полость плевры при экссудативных заболеваниях легких, эссенциальной гипопротеинемии, гипоальбуминемии, потери крови, плазмафорезе), отмечается снижение содержания общего белка, альбумина, бета-глобулинов. Уровень остальных фракций в крови не изменяется или увеличивается.
При железодефицитной анемии возрастает содержание бета-глобулинов, при внyтpисосудистом гемолизе снижается концентрация альфа-2-глобулинов. Уровень всех остальных фракций белка, как и общее его содержание, не изменяется. Характерно, что при исследовании гемолизированной сыворотки фракция альфа-2-глобулинов как бы раздваивается (рис. 4).
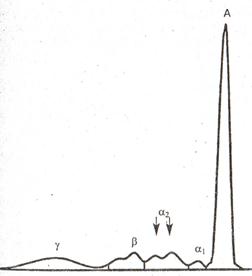 рис. 4
рис. 4
У пациентов с гиперлипидемическим синдромом отмечается увеличение содержания альфа-l- и альфа-2-глобулинов.
При гипоальфа-l-антитрипсинемии возникает гипоальфа-l-глобулинемия, при которой снижено содержание альфа-l-глобулинов (рис. 5), при aтpaнсферринемии - бета-глобулинов, при анальфа-2-бета-липопротеинемии – снижение уровня альфа-2-глобулинов, при агаптоглобулинемии - уменьшение содержания альфа-2-глобулинов, при акомплементемии - уменьшение содержания бета-глобулинов, при гипогаммаглобулинемии - уменьшение уровня гамма-глобулинов. Содержание всех остальных фракций и общего белка во всех приведенных ситуациях не отличается от нормы.
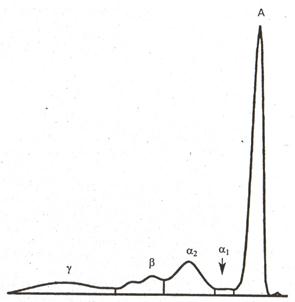 рис. 5
рис. 5
При беременности обнаруживается снижениеуровня общего белка, альбумина, увеличение содержания бета-глобулинов при отсутствии изменений в уровне альфа-1- и альфа-2-глобулинов. Содержание гамма-глобулинов в пределах нормы либо увеличено.
Для интегральной оценки протеинограмм используются коэффициенты отношений: альбумин/глобулины (А/Г), А/суммарная фракция альфа-1- и альфа-2-глобулинов: А/(альфа-1 + альфа-2), а также А/альфа-2, А/(альфа-2- + гамма-глобулины).
Альбумино-глобулиновое соотношение (А/Г - коэффициент, составляющий в норме 1,2-1,8) снижается при хронических диффузных поражениях печени (гепатите и циррозе), инфекционных заболеваниях, пневмонии, плеврите, эндокардите, туберкулезе, воспалительных процессах различной локализации, а также при злокачественных новообразованиях, плазмоцитоме, амилоидозе.
Коэффициент А/(альфа-1 + альфа-2), составляющий в норме 6,1-3,9, является весьма информативным и адекватным тестом оценки активности воспалительного процесса. При умеренных, выраженных и резких изменениях воспалительного характера в бронхологичной системе величина этого соотношения уменьшается соответственно до значений: 3,8-2,8; 2,7-2,0; ниже 2,0.
Фракция альфа-глобулинов образована гликопротеинами (гаптоглобином, церулоплазмином, альфа-1-антитрипсином, орозомукоидом и др.), уровень которых повышается при острых воспалительных, некробиотических процессах, аллергических и стрессовых состояниях (в особенности, если у обследуемого отсутствуют грубые патологические изменения со стороны печени). В силу этого альфа-глобулины относят к белкам «реактантам») острой фазы.
В пробах сыворотки с длительным сроком хранения выявлено увеличение уровня альфа-1-глобулинов, что может дать ложноположительный результат лабораторного исследования.
Уменьшение уровня альфа-глобулинов наблюдается при миеломе, лимфолейкозе, сахарном диабете (альфа-2), иногда панкреатите (альфа-2), острой дистрофии печени (в силу гепатоцеллюлярной недостаточности), а также наследственно обусловленном дефиците альфа-1-антитрипсина (альфа-1-глобулина).
Уровень альфа-2-глобулинов может быть снижен при гепатоцеллюлярной недостаточности, внутрисосудистом гемолизе.
Фракция бета-глобулинов при использовании электрофореза на ацетатцеллюлозной пленке нередко подразделяется на две подфракции: бета-l и бета-2. Бета-l-фракция в основном образована липопротеинами. Бета-глобулины – самая богатая липидами группа белков. В ней сосредоточено около 3/4 всех липидов плазмы крови и лишь около 5% белка. В связи с этим уровень бета-глобулинов всегда увеличен при первичных и вторичных гиперлипопротеинемиях (особенно II типа). Он повышен также при нефротическом синдроме, Тяжелой форме туберкулеза, инфекционном гепатите, токсических поражениях паренхимы печени, обтурационной желтухе, злокачественных новообразованиях, бета-плазмоцитоме, макроглобулиновой анемии, а также при кахексии, голодании и беременности. Уровень бета-1-глобулинов возрастает при анемии вследствие гипертрансферринемии (компенсаторной), увеличения уровня бета-липопротеинов, содержания бета-2-гликопротеинов; уровень бета-2-глобулинов повышается при С3-гиперкомплементемии. Снижение уровня бета-глобулинов сопровождается гипобета-липопрогеинемией.
Основную массу гамма-глобулинов составляют белки, обладающие свойствами антител (иммуноглобулины G, А, М, D и Е). Вырабатываются они плазматическими клетками, в которые трансформируются стимулированные антигенами В-лимфоциты. Попадают в ткани паренхиматозных органов, а также в различные секреты - слюну, слизь бронхов, молоко.
Иммуноглобулины всех перечисленных видов различаются по молекулярной массе, электрофоретической подвижности, содержанию углеводов и иммунологической активности. Взаимодействуя с соответствующими антителами, иммуноглобулины образуют иммунокомплексы.
Иммуноглобулины G - наиболее важный класс иммуноглобулинов - являются основными иммуноглобулинами сыворотки. С ними связан процесс гуморальной защиты организма против многих бактерий и вирусов, а также их токсинов. Активно транспортируются через плаценту и играют важную роль в защите организма от инфекции. IgG наиболее эффективно связывает растворимые антигены, особенно экзотоксины, а также вирусы.
Усиленная продукция IgG плазматическими клетками начинается лишь после повторного взаимодействия с антигенами. Нормальная концентрация достигается только к полутора-двум годам жизни.
Иммуноглобулины А синтезируются в плазматических клетках, находящихся преимущественно в подслизистых тканях, на слизистой поверхности дыхательных путей и кишечного тракта, почти во всех экскреторных железах (основная часть его, таким образом, синтезируется локально). Достаточно большое количество иммуноглобулина А присутствует в женском молозиве, слюне, слезах, а также в носовом и бронхиальном секретах и в слизистой оболочке кишечника.
Локальный синтез IgA обусловливает местный иммунитет (этим объясняется большая эффективность аэрозольных и пероральных иммунизаций).
IgA играет важную роль в преодолении эпителиального барьера, проникает в интерстициальную жидкость и встает преградой перед микробами, проникшими во внутреннюю среду организма. Он инактивирует бактерии, вирусы, блокируя их связывающие центры, и тем самым препятствует их фиксации на слизистых оболочках. IgA приписывается и прямое бактерицидное действие, и непосредственная противовирусная защита на уровне слизистых поверхностей.
Уровень ceкpeтopнoгo IgA в организме новорожденного уже через три недели приближается к уровню его у взрослого человека. Содержание же сывороточного IgA достигает концентрации взрослого человека к 10-15-летнему возрасту.
Иммуноглобулины М (IgM) представлены в организме двумя изомерами: IgM-1 и IgM-2. IgM - мощный активатор системы комплемента. Иммуноглобулинами этого класса являются антитела Вассермана, ревматоидный фактор, холодовые агглютинины и изогемагглютинины.
Иммуноглобулины М первыми появляются в процессе формирования иммунного ответа. Они имеют свойства бактерицидных антител против гpaммотрицательных микроорганизмов, изогемагглютининов, холодовых агглютининов. Напряженность иммунитета за счет IgM нестойкая. Содержание IgM в сыворотке крови увеличивается вскоре после родов, достигает значительного уровня к 9 мес, но через 2-3 мес падает, а затем вновь начинает медленно возрастать, достигая максимума к 20-30 годам.
Иммуноглобулины D (IgD) в низких концентрациях обнаружены в «нормальных» сыворотках крови. Сведения о специфической функции этих иммуноглобулинов отсутствуют. Предполагается, что появление этих антител блокирует активность иммуноглобулинов других классов по конкурентному механизму.
Иммуноглобулин E (IgE) содержится в «нормальных» сыворотках человека в следовых количествах. Плазматическими клетками вырабатывается IgE с определенной специфичностью.
Интерес к IgE связан с тем, что в состав этой фракции входят реагины, участвующие в аллергических реакциях. Продолжительность пребывания в организме сывороточного IgE - 3 сут, мембраносвязанных IgE - 14 сут.
Защитная функция иммуноглобулинов обусловлена содержащимися в этой фракции разнообразными антителами, способными специфически связывать чужеродные антигены.
У практически здоровых людей содержание иммуноглобулинов в сыворотке крови составляет: G - 59-75 мкмоль/л, А - 19-25 мкмоль/л, М – 0,8-1,2 мкмоль/л, О - около 0,26 мкмоль/л,
 2015-04-08
2015-04-08 1351
1351








