Хронический прием алкоголя повышает токсичность четыреххлористого углерода, трихлорэтилена, метиленхлорида, винилхлоида, ксилола, стирола, сероуглерода, магния, ртути, ряда других веществ как у человека, так и у экспериментальных животных. Однако одновременное назначение этанола в высоких дозах и трихлорэтилена или метиленхлорида сопровождается снижением их токсичности. Это обусловлено тем, что ферментные системы, метаболизируя метанол, выключаются из процесса биотрансформации токсикантов, в ходе которой происходит образование их токсичных метаболитов. Одновременное назначение этанола с ксилолом, стиролом, толуолом повышает содержание последних в крови. Некоторые вещества, аналогично дисульфираму, угнетают скорость метаболизма этанола (ингибиторы альдегиддегидрогеназы). В результате в организме накапливается ацетальдегид, вызывающий сильную головную боль, тахикардию, покраснение кожных покровов, иногда коллапс. Алкогольдегидрогеназа угнетается амидами жирных кислот, дитиокарбаматами, карбаматами, цианамидом, нитрогликолями, оксимами, сероуглеродом, диметилформамидом. Технические жидкости вмешиваются в метаболизм, существенно изменяя токсикокинетические и токсикодинамические характеристики друг друга. Поскольку результаты взаимодействия в значительной мере определяются условиями (соотношением доз, временным фактором), последствия интоксикации смесями веществ в каждом конкретном случае будут различными.
Краткая токсикологическая характеристика отдельных гепатотоксикантов
Дихлорэтан (хлористый этилен, ClCH2-CH2Cl) применяется в качестве растворителя лаков, красок и т.д. Это бесцветная, практически не растворяющаяся в воде, достаточно летучая жидкость (температура кипения 83,70) со своеобразным запахом. Пары дихлорэтана (ДХЭ) примерно в 3,5 раза тяжелее воздуха.
Отравление может наступить при поступлении ДХЭ через дыхательные пути, желудочно-кишечный тракт и кожные покровы. Картина тяжелой интоксикации развивается при приеме per os 20 мл и более вещества, либо при 30-минутной ингаляции паров дихлорэтана в концентрации 200 г/м3. Предельно допустимое содержание ДХЭ в воздухе – 1 10-2 г/м3.
Попав во внутренние среды организма, ДХЭ достаточно быстро исчезает из крови, накапливаясь в печени и тканях, богатых липидами. Однако вещество здесь не депонируется и в течение нескольких дней полностью исчезает из организма. В печени, почках, легких и некоторых других органах дихлорэтан подвергается метаболическим превращениям при участии, в основном, цитохром-Р-450-зависимых оксидаз, и глутатион-S-трансфераз. Промежуточные продукты метаболизма вещества обладают высокой реакционной способностью. С их действием на молекулы-мишени и активацией свободно-радикальных процессов связывают механизм действия ДХЭ на паренхиматозные органы. Основными конечными метаболитами токсиканта являются тиодиуксусная кислота, тионилдиуксусная кислота, соединение хлоруксусной кислоты с цистеином.
Продолжительность скрытого периода при ингаляционных поражениях составляет 1 – 12 часов. При приеме вещества внутрь отравление развивается бурно. Быстро появляются боли в животе и неукротимая рвота с примесью крови, признаки наркотического (неэликтролитного) действия вещества (вплоть до комы).
Через 2 – 3 дня появляются симптомы, указывающие на повреждение печени и почек: желтуха, в крови повышенное содержание билирубина, увеличение активности аминотрансфераз, в моче – белок, эритроциты, цилиндры.
При исследовании в пораженных гепатоцитах отмечается повреждение клеточных органелл: шероховатого эндоплазматического ретикулума (нарушение синтеза белка), гладкого эндоплазматического ретикулума (нарушение детоксицирующей функции печени), митохондрий (нарушение клеточного дыхания), лизосом (активация процессов аутолиза).
Специфических противоядий ДХЭ нет. Помимо общетерапевтических мероприятий, применяемых при острых интоксикациях вообще, и токсических гепатопатиях в частности, рекомендуют использовать антиоксиданты (ретинилпальмитат – 400000ЕД ежедневно в течение 4 суток; левамизол – 10 – 50 мг/кг; токоферол) и вещества, связывающие промежуточные продукты метаболизма ДХЭ (унитиол – 5 мл 5% раствора 2 – 4 раза в сутки, внутримышечно; ацетилцистеин – 5% раствор, до 400 мл в сутки).
Определение активности энзимов в плазме крови
Повышение активности в плазме крови таких энзимов, как аланиниаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), трансферазы гамма-глутаминовой кислоты (ТГГК), лактатдегидрогеназы (ЛДГ) свидетельствует о нарушении целостности гепатоцитов и является надежным индикатором острых поражений печени. Активность АЛТ и АСТ в большей степени отражают состояние проницаемости мембран гепатоцитов, чем функциональное состояние органа. Повышение уровня энзимов в крови, как правило, свидетельствует о некрозе печеночной ткани. Кроме того, уровень активности этих ферментов определяется целым рядом дополнительных условий, в частности, характером питания, наличием инфекционного процесса. Активность обоих ферментов может повышаться при патологии сердца, мышечной ткани, легких. Более надежным свидетелем печеночной патологии является изменение отношения АЛТ/АСТ. Увеличение коэффициента выше 1,6 обнаруживается, в частности при центролобулярном жировом перерождении печени, наблюдаемом при интоксикациях многими веществами (толуолом, дихлорэтаном, алкоголем и т.д.)
ТГГК – специфичный для печени энзим и чувствительный индикатор ее состояния. Повышение активности ТГГК также отмечается при отравлении самыми разными токсикантами. Однако на практике выявляется высокий процент ложноположительных реакций.
Уровень ЛДГ, хотя и отражает состояние печени, однако не является специфическим признаком ее поражения, так как подъем активности отмечается при заболеваниях сердца, мышц, легких и др.
При подострых и хронических интоксикациях активность энзимов может повышаться лишь транзиторно. Кроме того, постепенно развивающееся уменьшение объема печеночной паренхимы может не сопровождаться изменением активности ферментов. Так, в терминальном периоде заболевания печени массовая гибель гепатоцитов, сопровождающаяся ухудшением состояния экспериментального животного, может протекать на фоне снижения активности энзимов в плазме крови. Указанные обстоятельства заставляют с осторожностью относиться к трактовке получаемых результатов.
К числу наиболее распространенных тестов, позволяющих выявит холестатическое действие веществ, можно отнести определение активности щелочной фосфатазы и билирубина в плазме крови (прямого и непрямого). Однако оба теста не являются специфичными индикаторами токсического поражения органа. Так, активность щелочной фосфатазы повышается и при патологии костной системы. Повышение билирубина чаще сопутствует острому инфекционному поражению печени. Специфичным индикатором повреждения желчных путей является активность 5-нуклеотидазы. Однако и этот тест не специфичен для химической патологии.
Острые гепатопатии химической этиологии
При остром поражении некоторыми хорошо известными гепатотоксикантами (четыреххлорисиый углерод, желтый фосфор, токсины бледной поганки, ацетаминофен) отчетливо прослеживаются три периода течения интоксикации: острых гастро-интестинальных и неврологических проявлений; мнимого благополучия; выраженного поражения печени, часто сопровождающегося поражением почек. Однако в большинстве случаев четко очерченные стадии в течении процесса не выявляются.
Основой диагностики гепатопатий химической этиологии является тщательно собранный анамнез. В ходе беседы уясняются особенности профессиональной деятельности обследуемого, какими лекарственными средствами он пользуется, с какими химическими веществами контактирует в быту, не злоупотребляет ли алкоголем. Следует выяснить, не было ли ранее заболеваний печени, не страдает ли больной или его родственники аллергиями, нет ли гиперчувствительности к каким либо факторам окружающей среды. При решении экспертных вопросов следует иметь в виду, что чаще причинами поражения печени являются факторы нехимической природы (вирусной, бактериальной, грибковой, рикетсиозной, паразитарной), а также заболевания желчных путей, новообразования и др. В этой связи сбор анамнеза и выявление химического фактора, как причины патологии, требует особого внимания, поскольку профиль выявляемых биохимических изменений, как правило, отражает лишь картину морфологических процессов, проходящих в органе. Гепатоцеллюлярные нарушения, сопровождающиеся некрозом ткани, напоминают вирусный гепатит, как в клиническом, так и лабораторно-диагностическом отношении. Этот тип поражения органа проявляется недомоганием, тошнотой, рвотой, желтухой. Биохимическими методами выявляются повышение активности в плазме крови аминотрансфераз (АСТ, АЛТ), понижение в крови уровня плазменных факторов свертывания крови. Важными диагностическими тестами являются определение содержания билирубина в плазме крови и протромбинового времени.
Диффузная паренхиматозная дегенерация органа с минимальным некрозом гепатоцитов, наблюдаемая, например, при интоксикации саллицилатами, сопровождается синдромом, напоминающим безжелтушные формы гепатита.
Холестатические поражения печени клинически манифестируются желтухой, кожным зудом. В крови определяется умеренное повышение активности аминотрансфераз, щелочной фосфатазы, холестерина. Гепатоканаликулярная и каналикулярная формы холестатической желтухи различаются морфологией патологического процесса и биохимическими проявлениями. При гепатоканаликулярной форме (вызывается, например, аминазином) уровень щелочной фосфатазы в плазме крове может повышаться более чем в три раза, существенно увеличивается содержание холестерина в крови. Каналикулярная желтуха не сопровождается выраженными изменениями биохимических показателей крови.
Лихорадка, сыпь, эозинофиллия обычно ассоциируются с поражениями печени, развивающимися вследствие гиперчувствительности к токсиканту (идиосинкразия). Типичная реакция гиперчувствительности к ксенобиотикам (фенитоин, сульфониламиды, аминосаллициловая кислота и т.д.) сопровождается проявлениями, напоминающими сывороточную болезнь: лихорадкой, сыпью, лимфоаденопатией, лимфоцитозом с появлением в крови «атипичных» форм лимфоцитов.
ТОКСИКАНТЫ НАРУШАЮЩИЕ ФУНКЦИЮ ПОЧЕК (НЕФРОТОКСИКАНТЫ)
Общая токсикологическая характеристика
Нефротоксичность – это свойство химических веществ, действуя на организм немеханическим путем вызывать структурно-функциональные нарушения почек. Нефротоксичность может проявляться, как вследствие прямого взаимодействия химических веществ (или их метаболитов) с паренхимой почек, так и опосредованного действия, главным образом через изменения гемодинамики, кислотно-основного равновесия внутренней среды, массивное образование в организме продуктов токсического разрушения клеточных элементов, подлежащих выведению через почки (гемолиз, рабдомиолиз).
В строгом смысле нефротоксикантами могут быть названы лишь те, непосредственно действующие на почки вещества, к которым порог чувствительности органа существенно ниже, чем у других органов и систем. Однако на практике часто нефротоксикантами называют любое вещество, обладающее нефротоксичностью.
В таблице 32 представлен перечень токсикантов с относительно высокой прямой нефротоксической активностью. Перечень известных веществ, оказывающих опосредованное токсическое действие на почки значительно шире и включает более 300 наименований.
Таблица 32
Вещества, вызывающие повреждения почек
| Металлы | Технические жидкости | Разные |
| Мышьяк Висмут Кадмий Медь Золото Свинец Литий Ртуть Платина Серебро Талий Хром | Четыреххлористый углерод Дихлорэтан Трихлорэтилен Хлороформ Толуол Стирол Метанол Этиленгликоль Эпихлоргидрин Эфиры этиленгликоля Дихлорацетилен Сероуглерод | Паракват Микотоксины Силикон Кантаридин Рицин Пенициллин Производные ацетилсалициловой кислоты Цефалоридин Пуромицин Аминонуклеозид |
По некоторым данным в мире более 10 миллионов человек имеют постоянный контакт с веществами, обладающими выраженной нефротоксичностью. Частота регистрируемых случаев острой почечной недостаточности около 2 на 1000. По мнению некоторых исследователей примерно 20% – следствие химических воздействий, главным образом, лекарственных средств. Лекарства являются и основной, среди прочих химических факторов, причиной хронических нефропатий. По некоторым данным только злоупотребление ненаркотическими аналгетиками лежит в основе трети случаев хронической почечной недостаточности.
Анатомо-физиологические особенности органа
Почки чрезвычайно сложный орган, как в плане морфологии, так и физиологии, основные функции которого – экскреция продуктов метаболизма из организма (см. раздел «Выделение ксенобиотиков из организма (экскреция)»), регуляция водного и электролитного баланса. Среди других функций: синтез ферментов метаболизма витамина D, ренина, принимающего участие в образовании ангиотензина, альдостерона, синтез некоторых простогландинов и т.д.
Парный орган, весящий всего около 300 граммов (менее 1% от массы тела человека), получает около 25% минутного объема сердечного выброса крови. Кровь доставляется к нефронам – функционально-морфологическим единицам почек (около 106 нефронов на почку). Каждый нефрон состоит из сосудистой части – приносящей артериолы, капиллярного клубочка, выносящей артериолы; боуменовой капсулы, окружающей сосудистый клубочек, в которую осуществляется фильтрация первичной мочи; системы извитых и прямых канальцев (U-образная структура прямого отрезка почечного канальца называется петлей Генле), связывающих боуменову капсулу с соединительной и собирательной трубкой, по которым моча выделяется из органа.
Капиллярный клубочек, окруженный капсулой Боумена, это сложно организованный молекулярный фильтр, задерживающий вещества с молекулярной массой более 40000 дальтон (большинство белков крови), но проницаемый для большинства ксенобиотиков и продуктов метаболизма эндогенных веществ («шлаки»). Примерно 20% объема плазмы крови, протекающей через почки, переходит (отфильтровывается) из капилляров в капсулу клубочка (180 литров в сутки). Из образующегося фильтрата, в канальцах, обратно резорбируется в кровь большая часть воды, хлорид натрия, другие соли. Благодаря происходящим процессам, выделяющиеся с мочой токсиканты значительно концентрируются в определенных отделах нефрона (главным образом проксимальных отделах почечных канальцев) и интерстициальной ткани почек.
В области сосудистого полюса почечного клубочка в месте впадения в него приносящей артериолы располагается околоклубочковый (юкстагломерулярный) комплекс. Он формируется из собственно юкстагломерулярных эпителиоидных клеток, образующих манжету вокруг приносящей артериолы, специализированных клеток «плотного пятна» дистального отдела почечного канальца (залегает в области его анатомического контакта с полюсом клубочка) и мезангиальных клеток, заполняющих пространство между капиллярами. Функцией комплекса является контроль артериального давления и водно-солевого обмена в организме, путем регуляции секреции ренина (регуляция АД) и скорости кровотока по приносящей почечной артериоле (регуляция объема поступающей крови в почку). Показано участие комплекса в патогенезе токсических поражений почек (см. ниже).
Поскольку основные транспортные и концентрационные процессы происходят в проксимальном отделе канальцев, именно этот отдел нефрона наиболее часто повреждается токсикантами. Кроме того, процессы, проходящие в проксимальных отделах почечных канальцев (реабсорбция воды, секреторные процессы), чрезвычайно энергоемки, что делает их весьма чувствительными к ишемии.
В петле Генле осуществляется дальнейшая концентрация мочи благодаря механизму контротока. Некоторые вещества, например аналгетики, мочевина, не реабсорбируются в проксимальных канальцах, но интенсивно концентрируются в петле Генле. Наивысшая концентрация таких веществ отмечается в мозговом слое почек.
Далее концентрация мочи, вследствие реабсорбции воды и солей, происходит в дистальном отделе канальцев и собирательной трубке. Этот процесс находится под контролем антидиуретического гормона. В этом же отделе нефрона, благодаря секреции из крови избытка либо водородных, либо амонийных ионов, формируется рН мочи.
Еще одной важной функцией почек, сказывающейся на нефротоксичности ряда веществ, является их способность метаболизировать ксенобиотики. Хотя интенсивность метаболизма значительно ниже, чем в печени, здесь определяются те же ферментативные системы, и напряженность биотрансформации достаточно высока. Уровень активности цитохром-Р450-зависимых оксидаз наивысший в прямом отрезке (pars recta) проксимального отдела почечных канальцев, области особенно чувствительной к токсикантам. Хотя многие ксенобиотики одновременно метаболизируют с образованием активных радикалов и в печени и в почках, повреждение органа, по всей видимости, обусловлено действием той части общего количества вещества, которая метаболизирует именно в почках.
Близость метаболических процессов, протекающих в печени и почках, обусловливает практически одинаковую чувствительность этих органов ко многим ксенобиотикам (хлорированные углеводороды, токсины бледной поганки, паракват и др.). Преимущественное поражение того или иного органа при интоксикации во многом обусловлено тем, каким путем вещество поступило в организм (ингалационно, парентерально, через желудочно-кишечный тракт), то есть, какой из органов окажется первым на пути распределяющегося с током крови соединения. Например, при ингаляционном поражении четыреххлористым углеродом в большей степени страдают почки, при приеме вещества per os – печень.
Таким образом, высокая чувствительность почек к действию токсикантов определяется:
Ø высокой интенсивностью почечного кровотока и чувствительностью органа к гипоксии;
Ø способностью концентрировать ксенобиотики в процессе образования мочи;
Ø обратной резорбцией части экскретируемых ксенобиотиков в клетки эпителия почечных канальцев;
Ø биотрансформацией ксенобиотиков, сопровождающейся в ряде случаев образованием высокотоксичных промежуточных продуктов.
Характеристика нефротоксического действия
Механизмы действия
Механизмы нефротоксичности имеют биохимическую, иммунологическую и гемодинамическую природу. Поражение органа многими токсикантами носит смешанный характер.
Причины острой почечной недостаточности могут быть отнесены к одной из следующих групп:
Ø преренальные;
Ø ренальные;
Ø постренальные.
К числу преренальных причин относятся патологические состояния, приводящие к нарушению гемодинамики, сопровождающейся снижением гемоперфузии почек (гиповолемия, шок и т.д.).
Ренальные причины патологии обусловлены повреждением ткани почек.
Постренальные причины связаны с закупоркой дистальных канальцев нефрона и/или собирательных трубок патологическим секретом либо агломератами токсических веществ и их метаболитов.
Биохимические механизмы
Механизмы нефротоксического действия ксенобиотиков многообразны и вместе с тем развиваются по достаточно общему сценарию. Прошедший через фильтрационный барьер в клубочках токсикант концентрируется (примерно в 100 раз) внутри канальцев в силу реабсорбции большей части воды, содержащейся в первичной моче. Под влиянием складывающегося при этом градиента концентрации или в силу процессов активной реабсорбции, ксенобиотики поступает в клетки канальцевого эпителия и там накапливается. Нефротоксическое действие развивается при достижении критической концентрации токсиканта в клетках.
В зависимости от физико-химических свойств веществ, происходит их взаимодействие с молекулами-рецепторами (мембранные структуры, энзимы, структурные протеины, нуклеиновые кислоты), входящими в структуру одного из клеточных компартментов: лизосом (аминогликозиды и др.), цитоплазмы (тяжелые металлы – кадмий), рибосом, гладкого эндоплазматического ретикулума и т.д., что и инициирует развитие токсического процесса.
Для многих органических соединений, этапу их нефротоксического действия предшествует этап их биоактивации проходящий при участии энзиматических, метаболизирующих систем. В механизме нефротоксического действия многих ксенобиотиков (цефалоридин, пуромицин, аминонуклеозид, паракват, четыреххлористый углерод) важную роль играет их способность инициировать процесс образования в клетках свободных радикалов.
Иммунологические механизмы
Нефротоксические процессы иммунного типа, как правило, являются следствием двух основных процессов:
1) отложение в гломерулярных структурах почек комплекса антиген-антитело;
2) образование комплексных антигенов in situ, при взаимодействии почечных белков с токсикантом, с последующей атакой на них антител циркулирующих в крови. Поскольку антитела и иммунные комплексы – высокомолекулярные образования, они, как правило, не выявляются за пределами гломерулярного аппарата. В этой связи иммунные механизмы могут приводить к формированию гломерулонефрита (например, мембранозный гломерулонефрит индуцированный солями золота, ртути, d-пенициламином) или острого интерстициального нефрита (производные пенициллина), но не поражения эпителия почечных канальцев.
Точный механизм, с помощью которого токсикант инициирует реакцию гипериммунной реакции, приводящей к поражению почек в большинстве случаев неизвестен. Иногда ксенобиотики проявляют свойства гаптенов (метициллин), формируя некий собственный антиген, либо способствуют выходу в кровь в норме скрытых антигенов. В некоторых случаях гипериммунная реакция может быть следствием поликлональной активации иммунокомпетентных клеток, как это имеет место при нефропатиях, вызываемых золотом, ртутью, пенициламином.
Повреждение почечной ткани происходит путем реализации определенной цепи событий, характерной для развития аллергических или аутоиммунных процессов.
Гемодинамические механизмы
Нарушения гемодинамики являются частой причиной развития токсических нефропатий.
При остром поражении токсикантом почечных канальцев функции органа могут нарушаться вследствие закупорки просвета канальцев продуктами распада клеток эпителия, ретроградного тока гломерулярного фильтрата, повышения давления в капсуле Боумена, а вследствие этого и крови в капиллярной сети почечного клубочка. Повышение давления крови в почечных клубочках активирует юкстагломерулярный аппарат почек, вызывая гиперсекрецию ренина. Местный эффект системы ренин-ангиотензин детерминирует артериолярный предгломерулярный спазм, который влечет за собой, с одной стороны, прекращение (или резкое ослабление) поступления крови в клубочек, приостановку гломерулярной фильтрации, а с другой – ишемизацию почечных канальцев и их вторичный некроз. Повреждение ткани усугубляется выходом в сосудистое русло таких биологически активных веществ как тромбоксаны, эндотелин.
В тех случаях, когда объем гломерулярной фильтрации снижается более чем на 70%, эволюция процесса в сторону почечной недостаточности становится необратимой, вероятно вследствие того, что первично неповрежденные нефроны прогрессивно вовлекаются в патологический процесс.
Проявления токсического действия
Основными проявлениями поражения почек токсикантами являются:
Ø появление крови в моче (гематурия) вследствие повреждения стенки капилляров клубочков;
Ø появление белка в моче более 0,5 г в суточной пробе (протеинурия). Протеинурия может быть гломерулярного происхождения, при этом в моче обнаруживаются преимущественно высокомолекулярные белки (более 40000), и канальцевого – в моче обнаруживаются преимущественно низкомолекулярные белки (менее 40000). Гломерулярная протеинурия указывает на разрушение клубочкового барьера кровь-моча; канальцевая – на повреждение проксимальных отделов почечных канальцев;
Ø уменьшение количества отделяемой мочи – менее 600 мл в сутки (олигурия);
Ø повышение в плазме крови содержания азотсодержащих низкомолекулярных веществ, таких как мочевина, креатинин, 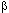 2-микроглобулины и т.д. (азотемия);
2-микроглобулины и т.д. (азотемия);
Ø общий отек, что в отсутствии сердечной недостаточности или цирроза печени указывает на резкое снижение содержания белка в крови (гипоальбуминемия);
Ø гипертензия, развивающаяся вследствие гломерулосклероза.
Эти проявления комбинируются в определенные синдромы. Основными синдромами, развивающимися в результате острых или хронических интоксикаций являются:
Ø острая почечная недостаточность, характеризующаяся острым угнетением функций почек с азотемией и, часто, олигурией;
Ø хроническая почечная недостаточность – перманентное нарушение функций почек с азотемией, ацидозом, анемией, гипертензией и рядом других нарушений;
Ø тубулоинтерстициальный нефрит (острый или хронический) с различными признаками канальцевых дисфункций (протеинурия канальцевого типа, ацидоз мочи, потеря солей, снижение удельного веса мочи и т.д.);
Ø нефротический синдром, характеризующийся тяжелой протеинурией (более 3,5 г белка в суточной моче), гипопротеинемией, отеками, гиперлипидемией, гиперлипидурией. Нефротический синдром может быть следствием гломерулонефритов различных типов;
Ø быстропрогрессирующий гломерулонефрит, проявляющийся гематурией и олигурией, приводящий к почечной недостаточности в течение нескольких недель.
Вещества, вызывающие формирование отдельных видов нефропатии представлены в таблице 33.
Таблица 33
Отравления, сопровождающиеся токсической нефропатией
| Варианты токсической нефропатии | Токсиканты |
| Острая почечная недостаточность: 1. Преренальные причины 2. Постренальные причины 3. Ренальные причины А. Острый тубулярный некроз Б. Острый интерстициальный нефрит | - антигипертензивные препараты, мочегонные, слабительные, эрготамин - бутадион, фторхинолоны, бромкриптин и т.д. -аманитин, фалоидин; тяжелые металлы (ртуть, хром, мышьяк); галогенированные углеводороды; гликоли (этиленгликоль); гемолитики (стибин, арсин и т.д.); антибиотики (цефалоспорин, аминогликозиды); противоопухолевые средства (цисплатин и т.д.). - аллопуринол, цефалоспорины, индометацин. рифампицин и т.д. |
Краткая характеристика отдельных нефротоксикантов
Нефротоксиканты чрезвычайно широко используются в быту и на производстве. Так, органические растворители являются компонентами многочисленных лаков, красок, клеев, чистящих средств, пестицидов и т.д. Широкое применение в повседневной деятельности находят тяжелые металлы и их соединения. Пути поступления веществ в организм также различны: ингаляционный, чрезкожный, алиментарный. В условиях производства наиболее частыми являются ингаляционные интоксикации. Растворители нередко действуют и через кожу. Для остальной части населения наиболее характерным путем поступления нефротоксикантов в организм является алиментарный, с зараженным продовольствием, напитками.
Многие тяжелые металлы являются выраженными нефротоксикантами, поражение которыми даже в малых дозах приводит к появлению глюкозурии, аминоацидурии, полиурии. При тяжелых отравлениях металлами формируются некротические изменения в почках, развиваются анурия, протеинурия, возможен смертельный исход. В эксперименте, при введении в организм животных малых доз металлов, не вызывающих клинику поражения, их высокая концентрация определяется в лизосомах почечных клеток. Это связывание металлов лизосомами может быть следствием лизосомального эндоцитоза метал-протеидных комплексов, аутофагии поврежденных металлами органелл (например, митохондрий), связывания металлов липопротеидами мембран лизосом. При введении высоких доз токсикантов металлы определяются и в других органеллах клеток.
Свинец. В недалеком прошлом свинец являлся частой причиной острых и хронических нефропатий. В литературе описаны многочисленные случаи некроза канальцевого эпителия вследствие случайного или преднамеренного приема больших доз солей свинца. Случаи хронической почечной недостаточности регистрировались у лиц, принимавших алкоголь, хранившийся в сосудах, содержавших свинец, у рабочих, постоянно контактирующих со свинец-содержащими веществами, у взрослых, в детстве перенесших острую интоксикацию свинцовыми красителями и т.д. В настоящее время случаи поражения свинцом регистрируются значительно реже.
Хроническая свинцовая нефропатия проявляется прогрессивным тубулоинтерстициальным нефритом, который характеризуется отсутствием протеинурии и альбуминурии на начальном этапе формирования патологии и обнаруживающим себя при исследовании скорости гломерулярной фильтрации. Накопление свинца в ткани почек, особенно в клетках эпителия проксимального отдела канальцев, сопровождается на ранних стадиях заболевания повреждением митохондрий клеток и нарушением абсорбционных функций клеток. Позже в ядрах этих клеток появляются включения, образованные комплексами свинца с кислыми протеинами. Эти внутриядерные тельца, как правило, исчезают по мере прогрессирования патологии. Патологии почек при свинцовой интоксикации часто сопутствуют гипохромная анемия, гипертензия, нейропатии.
С помощью хелатирующих агентов (ЭДТА или димеркаптосукцината) удается мобилизовать кумулируемый в тканях свинец и ускорить тем самым его выведение из организма. Содержание свинца в моче пациента более 800 мкг в суточной пробе после внутривенного введения ЭДТА в дозе 0,5 грамм указывает на высокое содержание металла в тканях организма.
 2015-04-08
2015-04-08 771
771








