Пиридин — шестичленный ароматический гетероцикл с одним атомом азота, который является слабым основанием и дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения.
Химическая формула: C5H5N.
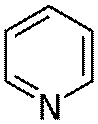

Пиридин – бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями.
Молярная масса = 79,101 г/моль.
Плотность = 0,9819 г/см³.
Температура плавления = −41,6 °C.
Температура кипения = 115.2 °C.
Получение.
Основным источником для получения пиридина является каменноугольная смола, в которой содержится до 0 08 % пиридина. При перегонке смолы пиридин концентрируется во фракции, называемые легким маслом. Из легкого масла смесь пиридинов (пиридиновые основания) извлекается разбавленной серной кислотой, выделяется щелочами и перегоняется.
Пиридин проявляет свойства, характерные для третичных аминов: образует N-оксиды, соли N-алкилпиридиния, способен выступать в качестве сигма-донорного лиганда.
В то же время пиридин обладает явными ароматическими свойствами. Однако наличие в кольце сопряжения атома азота приводит к серьёзному перераспределению электронной плотности, что приводит к сильному снижению активности пиридина в реакциях электрофильного ароматического замещения по сравнению с бензолом. В таких реакциях реагируют преимущественно мета-положения кольца.
Для пиридина характерны реакции ароматического нуклеофильного замещения, протекающие преимущественно по мета- положениям кольца. Такая реакционная способность свидетельствует о электроннодефицитной природе пиридинового кольца, что может быть обобщено в следующем эмпирическом правиле: реакционная способность пиридина как ароматического соединения примерно соответствует реакционной способности нитробензола.
1. Основные свойства.
Пиридин – слабое основание.
Его водный раствор окрашивает лакмус в синий цвет:
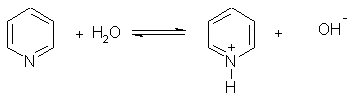
При взаимодействии пиридина с сильными кислотами образуются соли пиридиния:
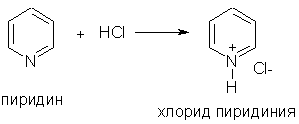
2. Ароматические свойства.
Подобно бензолу, пиридин вступает в реакции электрофильного замещения, однако его активность в этих реакциях ниже, чем бензола, из-за большой электроотрицательности атома азота.
Пиридин нитруется при 300 °С с низким выходом:
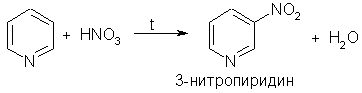
Атом азота в реакциях электрофильного замещения ведет себя как заместитель 2-го рода, поэтому электрофильное замещение происходит в мета-положение.
В отличие от бензола, пиридин способен вступать в реакции нуклеофильного замещения, поскольку атом азота оттягивает на себя электронную плотность из ароматической системы, и орто-пара-положения по отношению к атому азота обеднены электронами.
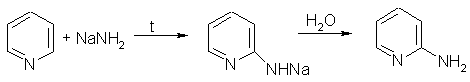
Так, пиридин может реагировать с амидом натрия, образуя смесь орто- и пара-аминопиридинов (реакция Чичибабина):
3. При гидрировании пиридина образуется пиперидин, который представляет собой циклический вторичный амин и является гораздо более сильным основанием, чем пиридин:
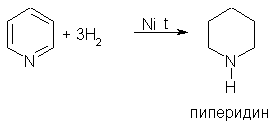
4. Гомологи пиридина по свойствам похожи на гомологи бензола.
Так, при окислении боковых цепей образуются соответствующие карбоновые кислоты:
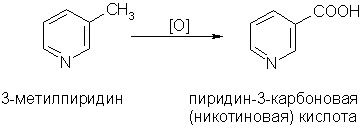
Пиридин не применяется в медицине в силу своей высокой токсичности, хотя и обладает сильным бактерицидным действием. Однако введением в его молекулу различных функциональных групп можно снизить его токсичсность. Это послужило основой для синтеза его многочисленных производных, являющихся ценными лекарственными средствами различного терапевтического действия.
Никотиновая кислота и никотинамид — важные лекарственные препараты.
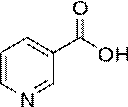
Никотиновая кислота (Acidum nicotinicum)
Никотиновая кислота является производным пиридина.
Никотиновая кислота (ниацин, витамин PP, витамин B3) — витамин, участвующий во многих окислительных реакциях живых клеток, лекарственное средство.
Химическая формула: С6H5NO2.
Физические свойства.
Никотиновая кислота – белый кристаллический порошок без запаха, слабокислого вкуса. Трудно растворим в холодной воде (1:70), лучше в горячей (1:15), мало растворим в этаноле, очень мало — в эфире.
Молярная масса = 123,11 г/моль.
Получение.
Современные как лабораторные, так и промышленные методы синтеза никотиновой кислоты основаны на окислении производных пиридина. Так, никотиновая кислота может быть синтезирована окислением β-пиколина (3-метилпиридина):
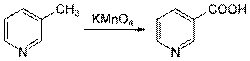
либо окислением хинолина до пиридин-2,3-дикарбоновой кислоты с последующим ее декарбоксилированием:
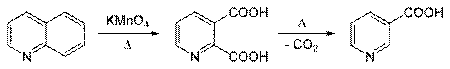
Аналогично никотиновая кислота синтезируется декарбоксилированием пиридин-2,5-дикарбоновой кислоты, получаемой окислением 2-метил-5-этилпиридина.
Никотиновая кислота имеет амфотерный характер ввиду наличия атома азота в пиридиновом цикле (основные свойства) и подвижного атома водорода в карбоксильной группе (кислотные свойства).
Никотиновая кислота образует соли с кислотами и основаниями, никотинаты серебра и меди (II) нерастворимы в воде, на осаждении никотината меди из раствора основан гравиметрический метод определения никотиновой кислоты.
Никотиновая кислота легко алкилируется по пиридиновому атому азота, при этом образуются внутренние четверичные соли — бетаины, некоторые из которых встречаются в растениях. Так, тригонеллин — бетаин N-метилникотиновой кислоты — содержится в семенах пажитника, гороха, кофе и ряда других растений.
Реакции никотиновой кислоты по карбоксильной группе типичны для карбоновых кислот: она образует галогенангидриды, сложные эфиры, амиды и т.д. Амид никотиновой кислоты входит в состав кофактора кодегидрогеназ, ряд амидов никотиновой кислоты нашел применение в качестве лекарственных средств (никетамид, никодин).
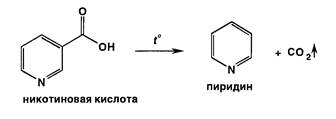
Для испытания подлинности кислоты никотиновой рекомендуют реакции, основанные на пиролизе, щелочном гидролизе, обнаружении ядра пиридина и третичного атома азота в молекуле, на соле- и комплексообразовании, кислотно-основных свойствах растворов. Реакции разложения кислоты никотиновой происходят при нагревании с кристаллическим карбонатом натрия.
Образуется пиридин, который легко обнаружить по характерному запаху:
Кислота никотиновая ввиду кислотных свойств ее растворов образует окрашенные нерастворимые соли, например с ионами меди (II) — осадок синего цвета (никотинат меди).
В качестве реактива рекомендуется ацетат меди:
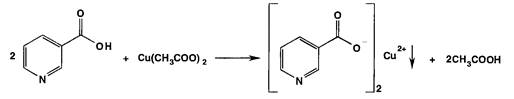
Согласно ГФ РБ:
ПОДЛИННОСТЬ (ИДЕНТИФИКАЦИЯ)
Первая идентификация: А, В.
Вторая идентификация: А, С.
А. Температура плавления (2.2.14): от 234°С до 240°С.
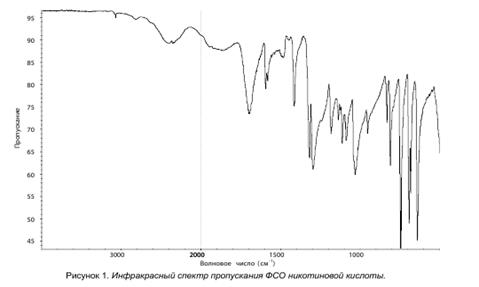
В. Абсорбционная спектрофотометрия в инфракрасной области.
Сравнение: ФСО никотиновой кислоты # или спектр, представленный на рисунке.
С. 10 мг испытуемого образца растворяют в 10 мл воды Р. К 2 мл полученного раствор прибавляют 2 мл раствора цианобромида Р, 3 мл раствора 25 г/л анилина Р и встряхивают. Появляется желтое окрашивание.
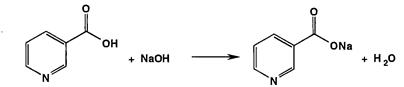
Для количественного определения кислоты никотиновой используют кислотные свойства ее водных растворов (метод кислотно-основного титрования в водной среде). Навеску кислоты никотиновой растворяют в горячей воде (так как в холодной воде она умеренно растворима) и после охлаждения титруют 0,1 М раствором гидроксида натрия до образования натриевой соли (индикатор фенолфталеин):
Кислоту никотиновую можно определить йодометрически после осаждения никотината меди:
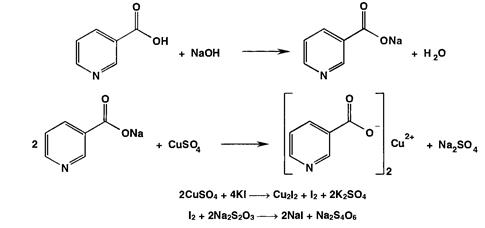
Согласно ГФ РБ:
0,250 г испытуемого образца растворяют в 50 мл воды Р и титруют 0,1 М раствором натрия гидроксида до появления розового окрашивания, используя в качестве индикатора 0,25 мл раствора фенолфталеина Р.
Параллельно проводят контрольный опыт: 1 мл 0,1 М раствора натрия гидроксида соответствует 12,31 мг С6Н5NО2.
Хранение.
Список Б. Порошок – в хорошо укупоренной таре, предохраняющей от действия света; таблетки и ампулы – в защищённом от света месте.
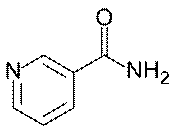
Никотинамид (Nicotinamidum)
Никотинамид является производным пиридина.
Химическая формула: C6H6N2O.
Физические свойства.
Никотинамид – белый или почти белый кристаллический порошок либо бесцветные кристаллы с очень слабым запахом, горьковатого вкуса. Легкорастворим в воде и в этаноле.
Молярная масса = 122,13 г/моль.
Получение.
Способ получения никотинамида гидролизом никотинонитрила в присутствии едкого натрая. Выход никотинамида 58%
Известен способ получения никотинамида из никотинонитрила нагреванием с разбавленным водным раствором аммиака под давлением. При этом, кроме никотинамида образуются соли никотиновой кислоты, что приводит к потерям продуктов реакции и необходимости их разделения (выход 75%).
Предложен способ получения никотинамида из никотинонитрила с помощью нерастворимого в воде катализатора – синтетической смолы AB-17. Пои кипячении никотинонитрила в водном растворе он превращается в никотинамид с высоким выходом (97%).
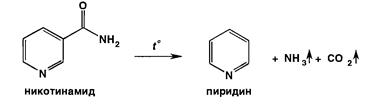
Реакции разложения никотинамида происходят при нагревании с кристаллическим карбонатом натрия. Образуется пиридин, который легко обнаружить по характерному запаху:
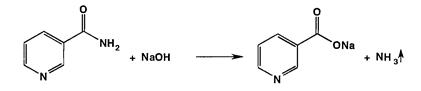
К этой же группе относятся реакции разложения никотинамида, происходящие при их нагревании в растворах гидроксидов щелочных металлов. Никотинамид разлагается с образованием аммиака, который можно обнаружить по запаху или по посинению влажной красной лакмусовой бумаги:
Согласно ГФ РБ:
ПОДЛИННОСТЬ (ИДЕНТИФИКАЦИЯ)
Первая идентификация: А, В.
Вторая идентификация: А, С, D.
А. Температура плавления (2.2.14): от 128°С до 131°С.
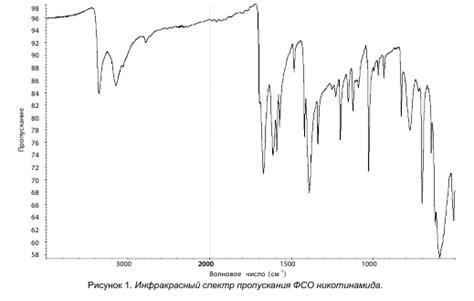
В. Абсорбционная спектрофотометрия в инфракрасной области (2.2.24).
Сравнение: ФСО никотинамида # или спектр, представленный на рисунке.
С. 0,1 г испытуемого образца кипятят с 1 мл раствора натрия гидроксида разведенного Р. Выделяются пары аммиака.
D. 2 мл раствора S (2,5 г испытуемого образца растворяют в воде, свободной от углерода диоксида Р и доводят до объема 50 мл этим же растворителем) доводят водой Р до объема 100 мл. К 2 мл полученного раствора прибавляют 2 мл раствора цианобромида Р, 3 мл раствора 25 г/л анилина Р и встряхивают. Появляется желтое окрашивание.
Никотинамид количественно определяют методом неводного титрования. Основные свойства усиливают, растворяя его в уксусном ангидриде, а затем титруют 0,1 М раствором хлорной кислоты (индикатор кристаллический фиолетовый):
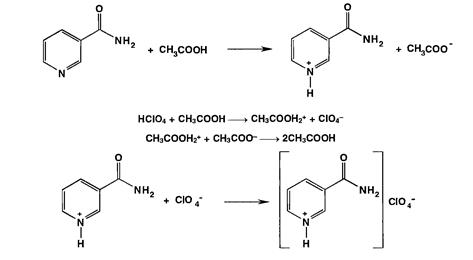
Реакция взаимодействия никотинамида с щёлочью может быть использована для количественного определения никотинамида в препарате. Выделяющийся аммиак отгоняют в приемник, содержащий определённый объём титрованного раствора кислоты.
Избыток кислоты оттитровывают щёлочью:
NH3 + H2SO4 → (NH4)2SO4
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Согласно ГФ РБ:
0,250 г испытуемого образца растворяют 20 мл кислоты уксусной безводной Р, при необходимости подогревают, прибавляют 5 мл уксусного ангидрида Р и титруют 0,1 М раствором кислоты хлорной до изменения окраски на зеленовато-синюю, используя в качестве индикатора раствор кристаллического фиолетового Р.
1 мл 0,1 М раствора кислоты хлорной соответствует 12,21 мг С6H6N2O.
Хранение.
Список Б. В плотно укупоренной таре, предохраняющей от действия света; ампулы – в защищённом от света месте.
 2015-04-30
2015-04-30 20439
20439








