| 1. Понятие фазового равновесия. Правило фаз Гиббса – основной закон фазового равновесия 2.. Фазовые переходы. Уравнение Клапейрона- Клаузиса, его анализ. |
Вещества, входящие в гетерогенную термодинамическую систему, могут находиться в различных агрегатных состояниях, образуя одну или несколько разных фаз.
Фазой называется совокупность гомогенных частей системы, одинаковых по составу, химическим и физическим свойствам и отграниченная от других частей системы поверхностью раздела.
Жидкие и твердые фазы называются конденсированными.
Равновесие в гетерогенной системе называется фазовым равновесием. Оно характеризуется определенными условиями: равенством температур во всех фазах, равенством давлений и равенством химических потенциалов каждого компонента во всех фазах:
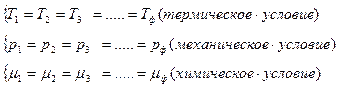
По числу фаз системы делят на однофазные, двухфазные, трехфазные и многофазные. Система может состоять из одного или нескольких компонентов.
Компонентом называется индивидуальное химическое вещество, которое является составной частью системы, может быть выделено из нее и существовать самостоятельно.
Число независимых компонентов - это наименьшее число индивидуальных химических веществ, необходимых для образования всех фаз термодинамической системы.
Из этого следует, что не все составные части системы могут учитываться при расчете числа независимых компонентов. Например, в водном растворе поваренной соли есть несколько видов частиц: (Н2О, NaCl, H+, Cl, OH_), но компонента только 2: вода и соль.
Если вещества, образующие систему, не взаимодействуют друг с другом, то число компонентов К равно числу R веществ в системе. При химических взаимодействиях К меньше R на число химических связей g/. Величина g равно числу химических уравнений в системе.
Например, в системе
СаСО3 = СаО + СО2
g =1, а число компонентов К = 3-1=2.
По числу компонентов различают однокомпонентные, двухкомпонентные, трехкомпонентные и многокомпонентные системы.
Состояние системы характеризуют числом степеней свободы, или вариантностью:
Число степеней свободы С – это число термодинамических параметров, определяющих состояние системы, которые можно произвольно изменить независимо один от другого, без изменения числа фаз в системе.
К таким параметрам относят внешние факторы (давление, температура) и внутренние ( концентрации компонентов). По числу степеней свободы системы подразделяют на инвариантные (С=0),моновариантные (С=1), бивариантные (С=2), и т.д.
Например, при постоянном давлении насыщенный раствор соли имеет одну степень свободы. Каждой произвольно выбранной температуре соответствует строго определенная концентрация компонентов.
Правило фаз Гиббса
При изменении внешних параметров равновесие в системе нарушается, при этом изменяются концентрации компонентов или исчезают старые и возникают новые фазы. Изменение в системе происходит до установления нового состояния равновесия.
Этот процесс описывается основным законом состояния равновесия, который носит название правила фаз Гиббса. Правило фаз позволяет рассчитывать число степеней свободы:
В равновесной термодинамической системе, на которую оказывает влияние только давление и температура, число степеней свободы равно числу независимых компонентов минус число фаз плюс два:
С=К-Ф+2
Из этого правила следует, что при числе степеней свободы С=0 система имеет наибольшее число равновесных фаз.
Если на систему, находящуюся в равновесии, кроме давления и температуры оказывают влияние еще и другие внешние факторы, например, магнитное или гравитационное поле, электрические воздействия, то в уравнении число внешних факторов будет больше 2.
Тогда правило фаз запишется так:
С=К-Ф+n
при С=0 Ф=К+n, т.е число фаз не может быть больше, чем К+n: Ф<= К+n
Если равновесие установилось в конденсированной системе, то оно практически не смещается при небольшом изменении давления. В таком случае правило фаз Гиббса для конденсированных систем можно записать:
С=К-Ф+1
Пример. Имеем в равновесии жидкую воду, пар и лед. Рассчитаем число степеней свободы такой системы при условии влияния на систему только двух внешних параметров – давления и температуры:
С= 1-3+2= 0
Это значит, что система нонвариантна, т.е. любое изменение одного из параметров выведет систему из состояния равновесия. Значит, чтобы в системе одновременно сосуществовали все три фазы, необходимо систему держать при определенном значении давления и температуры.
Применение правила фаз Гиббса. Диаграмма состояния. Общий принцип построения диаграмм.
Из правила фаз понятно, что однокомпонентная система обладает максимальным числом степеней свободы при минимальном числе фаз:
С=К-Ф+2
Ф=min т.е. Ф=1, тогда, С=1-1+2=2
Это значит, что максимальное число независимых параметров в системе из одного компонента, находящейся в равновесии, равно 2-м, как правило, это давление и температура.
Графическое изображение зависимости давления от температуры или давления от состава и температуры от состава системы называется диаграммой состояния системы.
Диаграммы состояния нужны для определения границ существования той или иной фазы, определения характера взаимодействия компонентов при изменении состава смеси, для определения возможности получения новых соединений. Анализ при помощи диаграмм состояния впервые был предложен Н.С. Курнаковым (1912-1914).
В основе анализа диаграмм состояния лежат два принципа: принцип непрерывности и принцип соответствия.
Согласно принципу непрерывности при непрерывном изменении параметров состояния системы свойства отдельных фаз и всей системы в целом также меняются непрерывно, но до тех пор, пока не произойдет изменение числа фаз. После этого свойства системы меняются скачкообразно.
Согласно принципу соответствия на диаграмме состояния каждой фазе соответствует свое поле фазы, которое изображает область существования фазы в определенном состоянии (т, ж, г).
Линии пересечения полей фаз характеризуют состояние равновесия между пограничными фазами: т-ж, ж-т, г(пар)-ж, г(пар)-т.
Точка на диаграмме состояния называется фигуративной точкой и показывает значение параметров, характеризующие данное состояние системы.
Фазовые переходы. Уравнение Клапейрона-Клаузиса.
Фазовый переход или превращение вещества происходит при переходе его из одного агрегатного состояния в другое.
Большой практический интерес представляют однокомпонентные двухфазные системы. Такие системы образуются при фазовом переходе веществ Т-Ж (плавление), Ж-пар (испарение), Т-пар (возгонка).
Эти фазовые переходы характеризуются зависимостью температуры фазового перехода от внешнего давления или давления насыщенного пара от температуры системы.
Уравнение, характеризующее такие зависимости, предложено Клапейроном (1834) и позже модифицировано Р.Клаузисом (1836).
Рассмотрим равновесие в системе вода-пар, т.е. процесс перехода воды в пар и обратно:
Н2О (ж) =Н2О (пар)
Изменение энергии Гиббса при изменении параметров описывается уравнением полного дифференциала энергии Гиббса 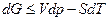 и для воды в каждой фазе с изменением температуры и давления выражается уравнениями:
и для воды в каждой фазе с изменением температуры и давления выражается уравнениями:
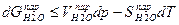
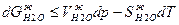
где V –молярные объемы вещества в паре и жидкости,
S – молярные энтропии вещества в обеих фазах.
При равновесии 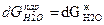
и поэтому
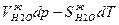 =
=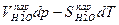
или
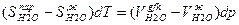 откуда
откуда 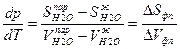
Изменение энтропии при фазовых превращениях обозначают как ΔS tr(transformation) и выражают через молярную теплоту фазового перехода ΔНtr, и температуру фазового перехода Ttr:
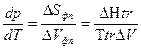 или
или 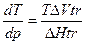
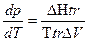 или
или 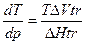
Это уравнение называют уравнением Клапейрона- Клаузиса. Оно приложимо для всех однокомпонентных двухфазных систем, находящихся в состоянии равновесия.
Анализ уравнения Клапейрона-Клаузиуса 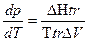 или
или 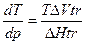
Производная 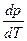 для процессов испарения и возгонки показывает, как изменяется давление насыщенного пара при изменении температуры на единицу, те. уравнение Клапейрона в виде
для процессов испарения и возгонки показывает, как изменяется давление насыщенного пара при изменении температуры на единицу, те. уравнение Клапейрона в виде 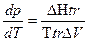 применяется для вычисления теплоты испарения и сублимации (возгонки.)
применяется для вычисления теплоты испарения и сублимации (возгонки.)
Производная 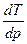 для процессов плавления, кристаллизации, полиморфных превращений показывает, на сколько градусов изменяется температура при изменении давления на единицу.
для процессов плавления, кристаллизации, полиморфных превращений показывает, на сколько градусов изменяется температура при изменении давления на единицу.
При этом так как в процессе плавления теплота плавления конденсированных фаз >0, так же, как и температура, то знак производной 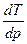 зависит от знака ΔV.
зависит от знака ΔV.
И если объем при фазовом переходе как правило, увеличивается, то температура плавления с ростом давления поднимается.
Но существует и аномалия от общего принципа поведения веществ при плавлении. Так, например, вода, висмут, галлий, чугун при плавлении уменьшают свой объем, поэтому и температура их плавления уменьшается с ростом давления.
По этим уравнениям чаще всего приходится находить температуру фазовых превращений при различных значениях давления, что имеет важное практическое применение.
Для расчета производной 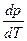 нужно знать молярные объемы веществ, а они часто неизвестны.
нужно знать молярные объемы веществ, а они часто неизвестны.
В связи с этим Клаузис модифицировал уравнение Клапейрона для процессов испарения, сублимации (возгонки) следующим образом.
Он предположил, что пар подчиняется закону идеальных газов Менделеева-Клапейрона и пренебрег разницей молярных объемов пара и жидкости в уравнении Клапейрона. Подставив значение давления из pV=RT он получил уравнение которое описывает процессы фазовых превращений в которых одной из равновесных фаз является пар:
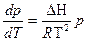 или
или 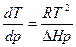
Величина ΔН является соответственно молярной теплотой испарения, возгонки или сублимации.
Это уравнение известно как уравнение Клапейрона-Клаузиса и применяется для расчета ΔН или зависимости ΔН=f(T).
Для этого экспериментально находят зависимость Р=f(T) и по ней dp/dT
Приближенное интегрирование уравнения Клапейрона-Клаузиуса
Если мы проинтегрируем уравнение К-К при переходе системы из одного состояния в другое, (отТ1 доТ2), то получим уравнение, позволяющее количественно определить теплоту испарения для узкого интервала теператур:
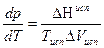
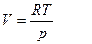 при испарении ΔV>>0 т.е объемом жидкости по сравнению с объемом пара пренебрегаем, поэтому:
при испарении ΔV>>0 т.е объемом жидкости по сравнению с объемом пара пренебрегаем, поэтому:
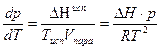 или
или 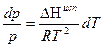 после интегрирования:
после интегрирования:
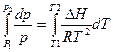 или
или 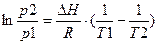 откуда
откуда
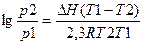
уравнение К-К которое позволяет найти теплоту испарения жидкости аналитическим способом.
Графически можно определить из уравнения прямой вида y=ax+b, если принять, что в узком интервале температур ΔН постоянная, то:
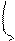










Пример 1. Вычислить теплоту испарения диэтилового эфира, если при нормальной температуре кипения (Т=307,9К), dP|dT=3,53*103 Па/К
Решение
ΔН=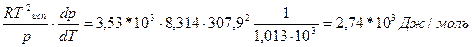
Пример 2 Вычислите теплоту испарения лекарственного вещества в интервале температур 88-112К,если давления при этих температурах8*10 3 Па и 101*10 3 Па.
Решение.
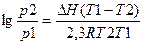 ,
, 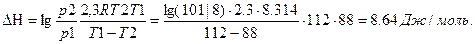
***
 2014-02-09
2014-02-09 4130
4130
