По фенотипическим проявлениям мутации вируса можно разделить на четыре группы.
• Мутации, не имеющие фенотического проявления, не изменяют свойств вирусов и их выявляют лишь при специальном анализе.
• Мутации, имеющие фенотипическое проявление (например, изменение размеров бляшек, образуемых вирусами в культуре клеток или термостабильность вирусов). Мутации, повышающие или снижающие патогенность, можно разделить на точковые (локализующиеся в индивидуальных генах) и генные (затрагивающие более обширные участки генома).
МУТИРОВАВШИХ ГЕНОВ:
Генные – затрагивают один ген, чаще всего – точковые
Точковые – замену или вставку пары нуклеотида в ДНК → изменение 1 кодона Þ вместо одной АК кодируется другая или нонсенскодон (нонсенсмутация) – это ПРЯМАЯ Мт. Впоследствии может возникнуть вторичная (ОБРАТНАЯ) мутация в этом же гене → восстановление дикого генотипа и фенотипа. Множественные (геномные).
По ФЕНОТИПИЧЕСКИМ ПОСЛЕДСТВИЯМ: Нейтральные – фенотипически не проявляются. Проявл. фенотипически.
Виды мутантов:
· по морфологии бляшек (напр., аденовирусы с большими бляшками быстрее высвобождаются из клеток по сравнению с диким типом).
· Мутанты по типу хозяев
· Термочувствительные мутанты – могут размножаться только при пониженной температуре.
· Холодочувствительные мутанты.
· Делеционные мутанты – теряют важные участки генома и требуют для своего размножения присутствия вируса-помощника.
· Прочие: устойчивые к ингибиторам, устойчивые к антибиотикам, потерявшие ферменты.
62. 3.1Лаборатории, работающие с материалами, инфицированными или потенциально инфицированными диким полиовирусом (далее - лаборатории), располагают в отдельно стоящем здании или изолированной части здания.
3.2. Размещение лаборатории в жилых зданиях не допускается.
3.3. Производственные лаборатории располагают в отдельно стоящих зданиях, не связанных с производственными помещениями, или изолированном блоке здания, имеющем отдельный вход.
3.4. Лаборатории должны иметь 2 входа: один - для сотрудников, другой - для доставки материала на исследование. Допускается получение материала через передаточное окно. Доступ в помещения лаборатории должен быть ограничен.
3.5. Лаборатории оборудуют водопроводом, канализацией, электричеством, отоплением и вентиляцией.
Все помещения лаборатории должны иметь естественное и искусственное освещение в зависимости от вида работ в соответствии с требованиями нормативных документов.
3.6. Помещения лаборатории разделяют на "заразную" зону, где проводят работы или хранят материалы, инфицированные или потенциально инфицированные диким полиовирусом, и "чистую" зону, где данные работы и хранение указанных материалов не проводят. Планировочные решения и размещение оборудования должны обеспечивать поточность продвижения исследуемого материала и выполнение требований настоящих санитарных правил.
3.7. Лаборатории должны иметь набор рабочих комнат и других помещений в соответствии с производственной мощностью и номенклатурой выполняемых исследований.
3.8. В "чистой" зоне лаборатории располагают:
- комнату (гардероб) для верхней одежды;
- помещения для проведения подготовительных работ (препараторскую, моечную и другие);
- стерилизационную;
- помещение с холодильной камерой или холодильниками для хранения питательных сред и диагностических препаратов;
- комнату отдыха и приема пищи;
- комнату для работы с документами и литературой;
- кабинет заведующего;
- комнату для надевания рабочей одежды;
- подсобное помещение;
- туалет.
3.9. В "заразной" зоне лаборатории располагают:
- помещение для приема и регистрации материала;
- комнату для микроскопии;
- комнату для ведения культуры ткани;
- комнату вирусологических исследований;
- термостатную комнату;
- автоклавную для обеззараживания.
3.10. Лабораторию обеспечивают защитными укрытиями II класса для выполнения работ, при которых высока возможность образования аэрозоля:
- измельчение, гомогенизация, интенсивное встряхивание материалов;
- вскрытие контейнеров с материалом, давление в которых может оказаться отличным от атмосферного;
- обращение с материалами высоких концентраций инфекционного агента или больших объемов.
3.11. Для центрифугирования больших объемов материалов или материалов с высокой концентрацией инфекционного агента используют специальные центрифуги с герметизирующимися емкостями.
3.12. Во вновь строящихся и реконструируемых лабораториях предусматривают:
- оборудование душевой;
- устройство автономной приточно-вытяжной вентиляции с установкой фильтров тонкой очистки воздуха, выбрасываемого из "заразной" зоны, или оборудование помещений этой зоны боксами биологической безопасности II класса.
3.13. Внутреннюю отделку помещений выполняют в соответствии с их функциональным назначением. Поверхности пола, стен, потолков в лабораторных помещениях "заразной" зоны должны быть гладкими, без щелей, легко обрабатываемыми, устойчивыми к действию моющих и дезинфицирующих средств, полы не должны быть скользкими.
3.14. Окна и двери помещений "заразной" зоны лаборатории должны быть герметичными.
3.15. Имеющаяся вытяжная вентиляция из "заразной" зоны лаборатории должна быть изолирована от других вентиляционных систем и оборудована фильтрами тонкой очистки воздуха. При использовании боксов биологической безопасности II класса допускается оборудование системы вытяжной вентиляции без установки фильтров.
3.16. Эксплуатацию вентиляционных устройств проводят в соответствии с документами на них.
3.17. Лабораторная мебель в "заразной" зоне должна иметь покрытие, устойчивое к действию моющих и дезинфицирующих средств. Поверхность столов не должна иметь швов и трещин.
3.18. Ширина проходов к рабочим местам или между двумя рядами выступающего оборудования должна быть не менее 1,5 метров (с учетом выступающих конструкций).
3.19. Помещения, где проводят работы с материалами, инфицированными или потенциально инфицированными диким полиовирусом, оборудуют бактерицидными лампами, которые используют для обеззараживания воздуха и поверхностей по режимам в соответствии с нормативными документами.
3.20. При ориентации окон на юг предусматривают защиту рабочих столов от попадания прямого солнечного света путем использования светозащитных пленок, жалюзи из материала, устойчивого к дезинфектантам.
3.21. На окна цокольного и первого этажей следует устанавливать металлические решетки, не нарушающие правил пожарной безопасности.
3.22. Помещения лабораторий должны быть непроницаемы для грызунов и насекомых.
3.23. Лаборатории обеспечивают средствами тушения пожара.
63 Виропексис - способ проникновения вируса в клетку по типу пиноцитоза, когда вирион захватывается клеточной мембраной, которая впячивается внутрь клетки с образованием вакуоли.
64
65. Взятие крови у лабораторных животных и ее обработка
Небольшое количество крови получают у кроликов и морских свинок из вен уха, у мышей и крыс—из вен хвоста, а большие количества — из сердца. В особых случаях прибегают к полному, или тотальному, обескровливанию, после которого животное погибает.
Для пункции сердца животных фиксируют к доске брюшком кверху. Шерсть в области груди тщательно выстригают, кожу обрабатывают спиртовым раствором йода и после этого приступают к проколу, который в зависимости от вида животного имеет некоторые различия.
Пункция сердца кроликов. Определяют II пальцем, обработанным спиртом и смазанным спиртовым раствором йода, сердечный толчок, т. е. точку наиболее сильно выраженной пульсации сердца. Обычно она прощупывается в третьем межреберье. Прокол грудной клетки делают в области сер дечного толчка на расстоянии 2—4 мм от левого края грудины; иглу ведут в направлении к средней линии на глубину 2—2,5 см. При попадании иглы в полость сердца рука, в которой находится шприц, начинает ощущать ритмичные толчки, связанные с пульсацией сердца и приподнимающие иглу. Поршень шприца легко выдвигается наружу и в цилиндре его тотчас появляется кровь. Взятие крови должно производиться по возможности быстрее во избежание ее свертывания. По этой же причине шприц и иглу рекомендуется промывать перед опытом стерильным раствором цитрата или оксалата натрия. Взяв необходимое количество крови, быстрым движением, без рывка, вынимают иглу и на месте укола накладывают ватный тампон, пропитанный спиртовым раствором йода. Животному подкожно вводят подогретый до тем пературы тела стерильный изотонический раствор хлорида натрия или глюкозу в количестве, равном двойному объему взятой крови. Пункцией сердца можно получить у кролика 25—30 мл крови.
Пункция сердца у морских свинок. Кончиками III—IV пальцев левой руки нащупывают сердечный толчок, в направлении которого вертикально на глубину 1,5—2 см вка тывают иглу, отступя на 1—2 мм от левого края грудины. У морских свинок можно получить таким образом 10—12 мл крови.
Пункция сердца у крыс. Как и в предыдущих случаях, пальпаторно определяют место сердечного толчка. На 1 см выше от установленной точки и на 1—2 мм левее от края гру дины делают прокол на глубину 1,5—2 см, держа иглу вер тикально. Одномоментно у крыс можно получить 6—8 мл крови.
Тотальное обескровливание кролика. Вскрывают одну из сонных артерий, расположенных по обеим сторонам трахеи. Для получения стерильной крови руки оперируемого должны быть тщательно вымыты и обработаны спиртом или спиртовым раствором йода, все инструменты предварительно необходимо простерилизовать.
Подготовленного для кровопускания кролика привязывают станку брюшком кверху, фиксируя голову кольцом к штативу. Шерсть на шее тщательно выстригают, кожу дезинфицируют. К носу животного прикладывают кусочек ваты, смо ченной эфиром. После того как наступит состояние наркоза, скальпелем делают разрез по средней линии шеи и разводят края раны пинцетом. Сонные артерии проходят по бокам трахеи в яремном желобке между веной и нервом. Сверху артерия прикрыта грудино-подъязычной и грудино-щитовидной мышцами. Поэтому для обнаружения нервно-сосудистого пучка эти мышцы разделяют тупым концом скальпеля или браншами пинцета. Артерию освобождают от окружающей соединительной ткани и подводят под нее две лигатуры. Ближай шую к головке лигатуру завязывают двойным узлом, позади второй лигатуры на расстоянии 0,3—0,5 см накладывают пеан. Между лигатурой и пеаном маленькими остроконечными ножницами делают продольный разрез сосуда длиной не бо лее 1,5—2 мм, вставляя в него канюлю (стеклянную трубочку с оттянутым капилляром, кончик которой скошен и хорошо оплавлен). Кончик вставленной канюли укрепляют второй лигатурой. После этого под резиновую трубку, надетую на расширенную часть канюли, подставляют пробирку или фла кон и снимают пеан с артерии, чтобы кровь могла вытекать свободно. Обескровливание морских свинок про изводят так же, как и кроликов.
66. Л. Lwoff и соавт. (1962) предложили проект универсальной классификации вирусов с иерархическим строением и сформулировали четыре основных критерия классификации;
1) тип нуклеиновой кислоты (РНК пли ДНК);
2) симметрия нуклеокапсида (спиральная, кубическая или комплексная);
3) наличие или отсутствие липопротеиновой оболочки, покрывающей вирус;
4) диаметр нуклеокапсида для спиральных вирусов и число капсомеров для кубических вирусов.
Современная классификация вирусов является универсальной для вирусов позвоночных, беспозвоночных, растений и простейших. Она опирается на фундаментальные свойства вирионов, из которых ведущими являются признаки, характеризующие нуклеиновую кислоту, морфологию и антигенные свойства.
Критерии современной классификации распределены на следующие основные труппы:
а) характеристика вирионов и их субструктур по физическим, химическим свойствам и морфологии;
б) репликация;
в) феномены генетических взаимодействий;
г) круг восприимчивых хозяев;
д) патогенность;
е) географическое распространение;
ж) способ передачи;
Каждая группа признаков детализируется в зависимости от уровня знаний и степени изученности конкретного вируса.
Значение перечисленных признаков в формировании таксонов разной иерархии неодинаково. Так, для определения вида и формирования рода важным признаком является общность антигенной структуры. Вирусы, близкие по антигенным свойствам, всегда одинаковы по типу нуклеиновой кислоты, основным чертам структуры и морфологии. Члены семейств обязательно должны иметь один и тот же тип нуклеиновой кислоты и морфологию, но сходство антигенной структуры не обязательно.
Предполагается, что иерархическая система таксонов для вирусов будет иметь следующие таксоны: вид (подвиды), род (подроды), семейства (подсемейства и надсемейства), классы, отряды, типы.
Вид рассматривается как совокупность вирусов, имеющих совпадающие характеристики. Родам является группа вирусов с определенными общими свойствами. Семейство - группа родов, имеющих общие определяющие свойства.
67. Вирогения - феномен интеграции вирусного генома с геномом клетки; при делении такой клетки происходит репродукция обоих геномов.
68. В основу их классификации положен тип нуклеиново кислоты, образующей геном. Соответственно выделяют рибовирусы (РНК-вирусы) и дезоксирибовирусы (ДНК-вирусы). При систематизировании вирусов выделяют следующие основные критерии: сходство нуклеиновых кислот, размеры, наличие или отсутствие суперкапсида, тип симметрии нуклеокапсида, характеристика нуклеиновых кислот (молекулярная масса, тип кислоты (ДНК или РНК), полярность [плюс или минус], количество нитей в молекуле либо наличие сегментов, наличие ферментов), чувствительность к химическим агентам (особенно к эфиру), антигенная структура и иммуногенность, тропизм к тканям и клеткам, способность образовывать тельца включений. Дополнительный критерий — симптоматология поражений: способность вызывать генерализованные поражения либо инфекции с первичным поражением определённых органов (нейроинфекции, респираторные инфекции и др.).
69. Принцип действия люминесцентных микроскопов заключается в получении изображения посредством светового потока свечения самого объекта исследования. Свет, прошедший сквозь возбуждающий светофильтр в устройстве микроскопа, вызывает свечение объекта, данный световой поток затем проходит через запирающий светофильтр, где отсекается возбуждающее излучение, и остается только люминесцентный, то есть световой поток свечения объекта. В отличае от обычного микроскопа используется ртутная лампа,дихричное зеркало и светофильтры.
70.?
71. Названия семейств принимают окончание viridae, родов – virus.
72. Получают из различных свежих тканей или органов. Этапы:
· Измельчение
· Отмывание р-ром Хенкса
· Трипсинизация на магнитной мешалке
· Центрифугрование
· Ресуспензирование в теплой питательной среде
· Подсчет клеток в камере Гряева
· Высаживание на питательные среды
· Культивирование
73. КЭ 6-8 дневного возраста, оплодотворенные, здоровые. Заражение на ХАО, в аллантоисную и желточный мешок, амниотическую оболочку, тело эмбриона. Редултата патологического действия вируса – скрученность шеи эмбриона. Карликовость, кровоизлияния на аллантоисной оболочке, теле эмбриона, в желточном мешке
74. Микроносители применяют при культивировании вируса ящура, полиомиелита и т.д. на культуре клеток.
75. Нуклеоид вирусный. Сердцевина вириона, состоящая из нуклеиновой кислоты, ассоциированной с вирусными белками.
76.?
77. РТГА применяют для идентификации вирусов, способных агглютинировать различные эритроциты. Для этого смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке. Реакцию торможения цитопатического эффекта за счёт интерференции вирусов применяют для идентификации возбудителя, интерферирующего с известным цитопатогенным вирусом в культуре чувствительных клеток. Для этого в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1-2 дня в неё вносят известный цитопатогенный вирус (например, любой ЕСНО-вирус). При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим применённым AT. Среди прочих тестов наибольшее распространение нашла реакция прямой иммунофлюоресценции (наиболее быстрая, чувствительная и воспроизводимая). Например, идентификация ЦМВ по цитопатогенному эффекту требует не менее 2-3 нед, а при использовании меченых моноклона л ьных AT идентификация возможна уже через 24 ч. Имея набор подобных реагентов, их можно вносить в культуры, заражённые вирусом, инкубировать, отмывать несвязавшийся реагент и исследовать с помощью люминесцентной микроскопии (позволяет выявить наличие флюоресценции заражённых клеток). Иммуноэлектронная микроскопия (аналог предыдущего метода) позволяет идентифицировать различные виды вирусов, выявленные электронной микроскопией (например, различные виды герпесвирусов), что невозможно сделать, основываясь на морфологических особенностях. Вместо антисывороток для идентификации используют помеченные разными способами AT, но сложность и дороговизна метода ограничивают его применение.
78.?
79. Эклипс – фаза сбрасывания оболочки вирусом внутри клетки. Не обнаруживается в этой фазе.
80. Рекомбинации и перераспределение генов между геномами приводят к перераспределении генетического материала в дочерних популяциях. Они отмечены во всех группах ДНК-содержащих вирусов, у всех РНК-содержащих вирусов с сегментированным геномом и лишь у немногих РНК-содержащих вирусов с несегментированным геномом (например, у полиовируса и вируса ящура).
• У ДНК-содержащих вирусов с дефектными геномами можно наблюдать рекомбинации, приводящие к образованию нормального дочернего генома (рис. 5-5, А).
• У РНК-содержащих вирусов при копировании плюс-цепи в минус-цепь полимераза может переключаться с одной плюс-цепи на другую, образуя гибридную минус-матрицу РНК (рис. 5-5, Б). Подобный механизм вызывает появление генетического непостоянства у ВИЧ. Геном ВИЧ образован +РНК, поэтому при транскрипции ДНК из РНК риск «переключения» обратной транскриптазы с одной цепочки на другую достаточно велик. Если обе молекулы идентичны, то подобное явление не приводит к последствиям, но при наличии двух вирусов-мутантов в клетке возможно появление рекомбинантов с иными геномами.
Обмен фрагментами генома наблюдают у РНК-содержащих вирусов с сегментированным геномом. Б отличие от рекомбинации суть процесса состоит в обмене крупных блоков наследственного материала. Например, при множественном заражении клетки мутантами вируса гриппа с изменениями, закреплёнными в различных сегментах генома, возможно появление нормального штамма вируса; в образовании популяции последнего принимают участие геномы обоих вирусов (рис. 5-6). В частности, передача двух фрагментов генома вирулентного для цыплят штамма вируса гриппа авирулентному влечёт за собой приобретение последним вирулентных свойств. В результате обмена вирус гриппа типа А может получить новые и селективно ценные типы поверхностных Аг гемагглютинина и нейраминидазы, что обеспечивает антигенный шифт [от англ. shift, перемещение] в динамике инфекционного процесса.
81. Электронный микроскоп перевернут «вверх дном» по сравнению со световым микроскопом. Излучение подается на образец сверху, а изображение формируется внизу. Принцип действия электронного микроскопа в сущности тот же, что и светового микроскопа. Электронный пучок направляется конденсорными линзами на образец, а полученное изображение затем увеличивается с помощью других линз. Разрешающей способностью называют способность прибора отобразить раздельно два мелких максимально близко расположенных объекта. Ниже предела разрешения эти объекты будут восприниматься как один объект. Предел разрешения в электронном микроскопе составляет на практике около 0,5 нм.
82. …
83. Р-р Хенкса/сыворотка крови животных
84. Гетерозиготность состояние вирионов, содержащих геном двух родительских вирусов
85. Парагрипп КРС. Возбудитель парагриппа-3 крупного рогатого скота — РНК-геномный вирус, относится к семейству Paramyxoviridae, роду Paramyxovius. В естественных условиях к вирусу парагриппа-3 восприимчивы различные возрастные группы к.р.с. Однако наиболее часто встречаются сообщения о заболевании молодняка крупного рогатого скота в возрасте до года. Инкубационный период при парагриппе-3 продолжается от 24-30 часов до 3-5 дней. Различают острое, подострое и хроническое течение.
При остром течении наблюдают повышение температуры тела до 41-42°С, снижение аппетита, поверхностное, учащенное дыхание, кашель, серозные истечения из носа, слезотечение. Выявляют также повышенную чувствительность гортани и трахеи, гиперемию слизистой оболочки носовой полости, бронхопневмонию. Большинство животных выздоравливают в течение 1-2 недель.
В тяжелых случаях на 3-4-й день болезни истечения становятся гнойными, слюноотделение более интенсивным, иногда в ротовой полости появляются язвы и эрозии. Животные лежат или стоят с вытянутой вперед шеей, широко расставленными передними конечностями, часто находятся в состоянии прострации, очень угнетены, аппетит у них отсутствует. Прогноз неблагоприятный. Тяжелобольные телята, как правило, погибают.
При подостром течении парагриппа-3 отмечают повышение температуры тела до 40-40,5 °С, учащение пульса и дыхания, депрессию, понижение аппетита. Наблюдаются слизисто-гнойные выделения из носа и глаз. Одышка сопровождается сильным, болезненным кашлем, хрипами. Животные часто дышат через рот. Аускультацией и перкуссией устанавливают пневмонию.
При хроническом течении болезни, которая, как правило, является результатом осложнения парагриппа-3 секундарной (условно-патогенной) микрофлорой, регистрируются признаки пневмонии и высокая летальность. Для лечения используют гипериммунные сыворотки и сыворотки реконвалесцентов, в которых имеются антитела к вирусу ПГ-3 одновременно с антибактериальными и иммуностимулирующими препаратами. Применяют также симптоматические методы лечения.
Профилактика и меры борьбы. Для специфической профилактики используют живые и инактивированные моно- и ассоциированные вакцины, гипериммунные сыворотки. Для ликвидации заболевания используют общие противоэпизоотические мероприятия – ограничение движения скота, дезинфекция, карантинирование больных животных
86. Вначале вирусы считали ядовитыми веществами, затем - одной из форм жизни, потом - биохимическими соединениями. Сегодня предполагают, что они существуют между живым и неживым мирами и являются основными участниками эволюции. Признаки живого и неживого:
· Для жизнедеятельности нужны клетки хозяина
· Тропизм
· Во внешней среде – неживое тело
· Наследственность
87. Физические: УФ-излучение, термическая обработка, солнечный свет, кипячение, пастеризация, тиндализация, радиоактивное излучение. Химические: применении химических средств, губительно действующих на возбудителей инфекционных заболеваний. К сегодняшнему дню человек использует в качестве дезинфектантов огромное множество химических соединений, но не останавливается на достигнутом.
88. Резистентностью клеток или тканей к заражению другим, суперинфицирующим вирусом. Чтобы создать интерференцию, первый вирус не обязательно должен размножаться, а способность к размножению второго, суперинфицирующего вируса может быть подавлена частично или полностью.
89. Вакцины (лат. vaccinusкоровий) - препараты, получаемые из микроорганизмов или продуктов их жизнедеятельности; применяются для активной иммунизации людей и животных с профилактической и лечебной целями.
Различают следующие виды вакцин:
Вакцина адсорбированная (v. adsorptum) - В., антигены которой сорбированы на веществах, усиливающих и пролонгирующих антигенное раздражение.
Вакцина антирабическая (v. antirabicum; анти- + лат. rabies бешенство) - В., изготовленная из штамма фиксированного вируса бешенства в суспензии тканей головного мозга животных или в культуре клеток и предназначенная для предупреждения заболевания у лиц, укушенных (ослюненных) животными, больными бешенством (подозреваемыми на заболевание).
Вакцина ассоциированная (v. associatum; син.: В. комбинированная, В. комплексная, поливакцина) - препарат, состоящий из нескольких В. различного типа, предназначенный для одновременной иммунизации против нескольких инфекционных болезней.
Вакцина живая (v. vivum) - B., содержащая жизнеспособные штаммы патогенного микроорганизма, ослабленные до степени, исключающей возникновение заболевания, но полностью сохранившие антигенные свойства, обусловливающие формирование специфического иммунитета у привитого.
Вакцина поливалентная (v. polyvalens; греч. poly - много + лат. valens, valentisсильный) - В., изготовленная на основе нескольких серологических вариантов возбудителя одной инфекционной болезни.
Вакцина убитая (v. inactivatum) - В., изготовленная из микроорганизмов инактивированных (убитых) воздействием физических или химических факторов.
Вакцина фенолизированная (v. phenolatum) - убитая В., изготовленная из микроорганизмов, инактивированных фенолом.
Вакцина формалинизированная (v. formalinatum; син. формолвакцина) - убитая В., изготовленная из микроорганизмов, инактивированных формалином.
Вакцина химическая (v. chemicum) - В., состоящая из специфических антигенов, извлеченных из микроорганизмов, и очищенная от балластных веществ.
Вакцина эмбриональная (v. embryonale) - В., изготовленная из вирусов или риккетсий, выращенных на эмбрионах птиц (кур, перепелок).
Вакцина этеризованная (v. aetherisatum) - убитая В., изготовленная из микроорганизмов, инактивированных эфиром.
90. Лабораторная диагностика бешенства включает:
- выделение возбудителя из биологических жидкостей (слюны, изредка - СМЖ) и тканей (головной мозг);
- серологические исследования;
- определение вирусных антигенов в тканях (мазках-отпечатках роговицы, биоптатах кожи, головном мозге);
- выявление вирусной РНК с помощью ПЦР.
Образцы ткани головного мозга, полученные при патологоанатомическом исследовании либо с помощью биопсии, используют для:
- заражения мышей с целью выделения вируса;
- иммунофлюоресцентного окрашивания на вирусные антигены;
- гистологического или электронно-микроскопического исследования для поискателецНегри;
- выявления вирусной РНК методом ПЦР с обратной транскрипцией.
Выделение вируса и иммунофлюоресцентное окрашивание -достаточно надежные и чувствительные методы диагностики, однако при затяжном течении болезни они могут дать ложноотрицательные результаты из-за высокого титра нейтрализующих антител в крови и СМЖ. Поставить прижизненный диагноз бешенства помогает иммунофлюоресцентное окрашивание биоптатов кожи, мазков-отпечатков роговицы и мазков слюны. Результаты этого исследования должны быть подтверждены серологическими методами либо обнаружением самого вируса, его антигенов или РНК в ткани головного мозга.
91. Предупреждение попадания микроорганизмов в организм животного и исследуемый материал – мероприятия по асептике.
92. Локальная популяция — это совокупность особей одного вида, имеющих общее место обитания и длительно существующих в определенной части, ареала. Локальная вирусная популяция формируется в естественных условиях в организме зараженных хозяев.
93. ЦПД, бляшки, вирусные включения, цветная проба, гемадсорбция, интерференция
94. Реакция торможения гемагглютинации (РТГА). Несмотря на своё название, принцип реакции во многом аналогичен РН вирусов, так как основан на способности AT связывать различные вирусы и нейтрализовать их, лишая возможности агглютинировать эритроциты. Визуально этот эффект и проявляется в «торможении» гемагглютинации. РТГА применяют при диагностике вирусных инфекций для выявления специфических антигемагглютининов и идентификации различных вирусов по их гемагглютининам, проявляющим свойства Аг. Используют РТГА в серологической диагностике вирусных болезней, в частности гриппа и аденовирусных инфекций. Ставить ее лучше так же, как и РН, с парными сыворотками. Четырехкратное нарастание титра антител во второй сыворотке подтверждает предполагаемый диагноз
95. –virus
96. Лизоцим - это фермент, который содержится в слюне человека и оказывает антибактериальное действие (вызывает лизис бактериальной клетки).
97. В основе патогенеза вирусных инфекций лежит взаимодействие генома вируса с генетическим аппаратом чувствительной клетки. Исключая поражения, вызываемые вирусами, распространяющимися по нервной ткани, патогенез вирусных инфекций сопровождает вирусемия (виремия)— циркуляция возбудителя в крови. В кровоток возбудитель проникает прямым путем или из лимфатической системы. Многие вирусы (например, ВИЧ, вирусы гриппа, кори, герпеса) поражают иммунокомпетентные клетки, что чаще проявляется в нарушении функций и уменьшении числа Т-хелперов, увеличении содержания и активации Т-супрессоров или В-клеток. Некоторые возбудители образуют внутриядерные или цитоплазматические тельца включений (например, тельца Бабеша~Нёгри). имеющие диагностическое значение. Проникновение вируса в организм. Основные входные ворота для возбудителей вирусных инфекции человека — дыхательные пути и ЖКТ, реже — кожные покровы. В некоторых случаях развиваются локальные поражения, но чаще в месте проникновения не возникает каких-либо проявлений или они носят стёртый характер, а возбудитель мигрирует в чувствительные ткани. Распространение возбудителя в организме может носить локальный или системный характер.
Локальные поражения вирусами типичны для возбудителей респираторных и кишечных инфекций, а также для некоторых кожных заболеваний. Продолжительность инкубационного периода большинства подобных инфекций составляет 2-3 сут. Первичную репликацию часто сопровождает вирусемия. Она обычно протекает бессимптомно или по типу продромальных явлений, но может возникать и на фоне выраженной клинической картины, не вызывая развития дополнительной симптоматики. Для подобных заболеваний характерно повторное заражение, так как циркулирующие AT не проявляют протективный эффект, а секреторный иммуноглобулин А (IgA) оказывает лишь кратковременное нейтрализующее действие на слизистой оболочке. Системные поражения. Из места проникновения возбудители попадают в кровоток, вызывая вирусемию, и постепенно фиксируются в чувствительных тканях. Первичное распространение обычно вызывает продромальные явления. Поскольку вирусемия предшествует поражению чувствительных тканей, то продолжительность инкубационного и продромального периодов подобных инфекций могут увеличиваться до 2-3 нед. Вирусемия при системных инфекциях обычно носит двухэтапный характер. Первый этап заканчивается поглощением циркулирующих вирусов клетками ретикулоэндотелиальной системы.
В дальнейшем возможно несколько вариантов:
• полная элиминация возбудителя (абортивная инфекция);
• размножение вирусов в фагоцитах с последующим выходом и развитием выраженной вторичной вирусемии, сопровождающейся появлением характерных клинических признаков заболевания (например, энцефалитов);
• некоторые вирусы (например, вирус гепатита В, пикорна- и тогавирусы) слабо поглощаются фагоцитами и могут циркулировать в крови в свободном состоянии, а возбудители колорадской клещевой лихорадки и лихорадки долины Рифт внедряются в эритроциты.
98. Наличие и биологическую активность вирусов определяют по эффектам, наблюдаемым на животных моделях (повышение температуры тела, появление характерных клинических признаков, гибель и т.д.), куриных эмбрионах и на клетках (в культурах). Под воздействием конкретных вирусов возможно изменение морфологии, роста, репродукции клеток либо их разрушение. Факт размножения вирусов в чувствительных клетках invitro определяют по цитопатическим эффектам (в том числе бляшкообразованию, тельцам включений), феномену гемадсорбции, «цветной реакции».
99. Вирус болезни Ауэски
Болезнь Ауески (псевдобешенство, инфекционный бульбарный паралич, зудящая чума, бешеная чесотка) - остро протекающая, в виде эпизоотии и спорадических случаев вирусная болезнь сельскохозяйственных животных всех видов, пушных зверей и грызунов. Характеризуется признаками поражения головного и спинного мозга, легких сильным зудом и расчесами (у всех видов животных, кроме свиней), а также септицемией.
Возбудитель — фильтрующийся ДНК-содержащий пантропный вирус, относящийся к семейству герпесвирусов, подсемейству Porcinis (alpha) Herpes virus (Alphaherpesvirinae), роду poikilovirus, вид - suid herpes virus (herpes virus suid / pseudo rabies virus / pseudo rabies alphaherpesvirus).
Вирусы данной группы могут длительное время сохраняться в организме хозяина, не вызывая признаков болезни. Он имеет сферическую форму, диаметр вирионов — 180—200 нм. Плюрализм вируса не установлен. Обнаружена иммунобиологическая идентичность различных штаммов вируса.
Особенностью возбудителя болезни Ауески является способность вызывать латентную инфекцию. Вирус может длительно персистировать в организме переболевших свиней. Персистенция возбудителя болезни Ауески отмечается на четырех уровнях: генома клетки, клетки, свиньи или популяции свиней. У переболевших свиней болезнь Ауески переходит в латентную форму, при которой вирус может пожизненно персистировать в клетках ЦНС, миндалин и лимфоузлов. Вирусный геном интегрируется в геноме клетки хозяина и при определенных обстоятельствах способен реактивироваться, и инициировать новый цикл размножения вируса, провоцируя возникновение заболевания, выделение вируса во внешнюю среду, инфицируя при этом чувствительных животных.
К болезни восприимчивы различные виды животных, в том числе сельскохозяйственные (свиньи, крупно и мелко рогатый скот, лошади), домашние (собаки, кошки, утки), лабораторные (кролики, морские свинки, белые крысы, пушные звери (песцы, норки, соболи и др.), грызуны. К вирусу болезни Ауески восприимчивы все возрастные группы свиней, особенно новорожденные поросята, у которых болезнь протекает остро или сверхостро, а гибель может достигать 100%.
Источник возбудителя болезни — больные животные, в том числе находящиеся в инкубационном периоде заболевания, а также вирусоносители. Вирус болезни Ауески у зараженных свиней может находиться в организме до 1 года, поэтому главным источником распространения болезни являются свиньи-вирусоносители. Через 9-16 дней после заражения или вакцинации в сыворотке крови свиней появляются нейтрализующие антитела, которые сохраняются в организме до полугода. Такие животные выделяют вирус с носовой слизью, мочой, другими секретами и экскретами, но, в отличие от бешенства, в слюне его нет. Особую опасность представляют латентно инфицированные вирусоносители. Грызуны и другие восприимчивые животные могут служить биологическими переносчиками вируса.
100. Наряду с распространенными изменениями центральной нервной системы в форме энцефаломиели; наблюдаются пат.-анат. изменения различной степени интенсивности в разных отделах периферической, церебро-спинальной и вегетативной нервной системы с преобладанием то дегенеративных, то воспалительных явлений. Часто особенно пораженными оказываются межпозвоночные и черепно-мозговые чувствительные ганглии (Гассеров узел, gangl. nodosum n. vagi), а также симпатические узлы и интрамуральные сдле- тения, в к-рых может наблюдаться ганглионеврит. Так. обр. создалось понятие о «септиневрите» (Nicolau) как о генерализации путем периферических нервов невидимого вируса по всей нервной системе, центральной, периферической и вегетативной, при наличии явных гистопатологических изменений в различных отделах периферической нервной системы—соматической и вегетативной. Обусловленный ультравизибельным вирусом «септиневрит» может быть поставлен в параллель с септицемией, вызываемой видимыми микробами в крови.
Основные методы культивирования вирусов:
1) биологический – заражение лабораторных животных. При заражении вирусом животное заболевает. Если болезнь не развивается, то патологические изменения можно обнаружить при вскрытии. У животных наблюдаются иммунологические сдвиги. Однако далеко не все вирусы можно культивировать в организме животных;
2) культивирование вирусов в развивающихся куриных эмбрионах. Куриные эмбрионы выращивают в инкубаторе 7—10 дней, а затем используют для культивирования. В этой модели все типы зачатков тканей подвержены заражению. Но не все вирусы могут размножаться и развиваться в куриных эмбрионах.
В результате заражения могут происходить и появляться:
1) гибель эмбриона;
2) дефекты развития: на поверхности оболочек появляются образования – бляшки, представляющие собой скопления погибших клеток, содержащих вирионы;
3) накопление вирусов в аллантоисной жидкости (обнаруживают путем титрования);
4) размножение в культуре ткани (это основной метод культивирования вирусов).
Различают следующие типы культур тканей:
1) перевиваемые – культуры опухолевых клеток; обладают большой митотической активностью;
2) первично трипсинизированные – подвергшиеся первичной обработке трипсином; эта обработка нарушает межклеточные связи, в результате чего выделяются отдельные клетки. Источником являются любые органы и ткани, чаще всего – эмбриональные (обладают высокой митотической активностью).
Для поддержания клеток культуры ткани используют специальные среды. Это жидкие питательные среды сложного состава, содержащие аминокислоты, углеводы, факторы роста, источники белка, антибиотики и индикаторы для оценки развития клеток культуры ткани.
О репродукции вирусов в культуре ткани судят по их цитопатическому действию, которое носит разный характер в зависимости от вида вируса.
Основные проявления цитопатического действия вирусов:
1) размножение вируса может сопровождаться гибелью клеток или морфологическими изменениями в них;
2) некоторые вирусы вызывают слияние клеток и образование многоядерного синцития;
3) клетки могут расти, но делиться, в результате чего образуются гигантские клетки;
4) в клетках появляются включения (ядерные, цитоплазматические, смешанные). Включения могут окрашиваться в розовый цвет (эозинофильные включения) или в голубой (базофильные включения);
5) если в культуре ткани размножаются вирусы, имеющие гемагглютинины, то в процессе размножения клетка приобретает способность адсорбировать эритроциты (гемадсорбция).
102. АДЕНОВИРУСНАЯ ИНФЕКЦИЯ КРУПНОГО РОГАТОГО СКОТА, острая вирусная болезнь, характеризующаяся поражением слизистых оболочек дыхательных путей, глаз, кишок, а также лимфоидной ткани. Распространена во многих странах Европы, в Японии и США, зарегистрирована в СССР.
Этиология. Возбудитель болезни — ДНК-содержащий вирус сем. Adenoviridae. Изучены его 9 серотипов.
Эпизоотология. Особенно часто болеют телята 2—3-мес. возраста. Новорождённые телята болеют реже и менее чувствительны к аденовирусу. У взрослых животных болезнь часто протекает без клинич. признаков. Осн. пути заражения: аэрогенный и алиментарный. Болезнь проявляется в виде спорадич. случаев и иногда как эпизоотия.
Иммунитет. После переболевания в организме образуются комплементсвязывающие и вируснейтрализующие антитела, оказывающие защитное влияние против повторного действия возбудителей инфекции.
Симптомы и течение. Инкубационный, период 3—4 сут. Течение болезни острое, редко хроническое. А. и. к. р. с. характеризуется повышением темп-ры до 41,0 °С, респираторными явлениями (выделения из носовой полости, кашель), конъюнктивитом (слезотечение) и поражением кишечного тракта (понос), т. е. картиной пневмоэнтерита. При хронич. течении характерно исхудание животного. В большинстве случаев через 2 нед наступает выздоровление. Нередко через 2—3 нед после этого отмечается рецидив; возможно заболевание, вызванное вирусом др. серотипа.
Патологоанатомические изменения. При вскрытии павших животных обнаруживают поражения в лёгких (эмфизема, ограниченные ателектазы, бронхопневмония), а также катаральный энтерит. После длительного переболевания — в лёгких изменения, вызванные вторичной инфекцией.
Диагноз базируется на клиникоэпизоотологич. данных и результатах лабораторных исследований (выделение вируса и серологич. реакции). Вирус выделяют из истечений из глаз и носовой полости, из содержимого кишечника. Выделенным материалом заражают культуру клеток почек и семенников теленка и почки эмбриона коровы. Из серологич. реакций применяют РСК, используя сыворотки морских свинок для идентификации аденовируса, а для установления типа аденовируса — реакцию нейтрализации, используя сыворотки телят или кроликов. Большое значение для постановки окончательного диагноза имеет исследование парных сывороток, взятых в первые 2—3 сут болезни и через 2—3 нед после начала заболевания. Выделение вируса без серологич. исследования не может служить доказательством его роли в возникновении болезни. А. и. к. р. с. дифференцируют от парагриппа, вирусной диареи, инфекц. ринотрахеита.
Лечение симптоматическое.
Профилактика и меры борьбы. Методы специфич. профилактики не разработаны. Проводят общие вет.-сан. мероприятия.
103. Характер дыхания и источники кислорода у зародыша КЭ в разное время различны. Хорион служит для обмена между зародышем и окружающей средой. У яйцекладущих видов основная его функция — дыхательный газообмен. До снесения яйца и в первые дни инкубации источником кислорода служит желток. Под действием ферментов из его молекул освобождается связанный кислород, который вначале непосредственно поступает в клетки. С развитием кровеносной системы переносчиком кислорода становится гемоглобин крови. Позднее, с развитием аллантоиса, дыхание происходит уже за счет кислорода наружного воздуха, проникающего сквозь скорлупу. В конце инкубации, когда аллантоис атрофируется, цыпленок дышит легкими.
104. Тропизм выражается в свойстве избирать в качестве среды обитания определённые организмы (видовой тропизм) или органы (органный, или тканевой, тропизм). Видовой тропизм обусловливает круг резервуаров и источников возбудителей, органный — место локализации возбудителя и специфического патологического процесса в организме хозяина. Органный тропизм высоко выражен у вирусов. Рецепторы клеток для вирусов - белки поверхности клеток, на к-рых происходит специфическое связывание вирионного белка (вирусного рецептора, антирецептора), за которым следует проникновение вируса в клетку. Они определяют тканевый тропизм вирусов. У части клеток они отсутствуют, у другой части они не доступны для вируса, что делает их невосприимчивыми к вирусу.
105. реакция иммунофлюоресценции; основана на том, что антитела иммунной сыворотки метят флюорохромами. Комплекс АГ – АТ обнаруживают при флюоресцентной микроскопии;
Иммунофлюоресценция — это метод, основанный на использовании специфичности иммунологической реакции и чувствительности флюоресцентной микроскопии. В отличие от других методов маркировки постановка пробы и точная локализация иммунной реакции на поверхности клетки или ткани происходят довольно быстро. Один из компонентов иммунной реакции, как правило антитело, метится флюоресцирующим красителем (маркировка, конъюгирование). После возбуждения флюоресцирующего агента положение антигена становится доступным непосредственному наблюдению вследствие развития флюоресценции.
Предложенный в 1941 г. Кунсом, этот метод после многочисленных усовершенствований прочно вошел в лабораторную практику. Метод включает следующие важные этапы:
— получение, характеристика и маркировка антисывороток;
— получение антигенного субстрата;
— проведение анализа, т. е. обработка флюоресцирующими антителами;
— микроскопический анализ флюоресценции препаратов.
106. Титр вируса – количество вируса в единице исследуемого материала
Находят по:
a) Единично оцениваемому результату
Инфекционное действие с прямо оцениавемым результатом – это любое изменение чувствительности тест-системы под влиянием размножения в ней вирусов.
На ХАО КЭ – оценивают количество оспин (узелков) – доза, способная вызвать образование 1 оспину наз. 1й оспинообразующей дозой.
На КК – оценивают по образованию бляшек – образование сплошного наслоя среди живых клеток островков мертвых клеток (бляшек) наз. 1й бляшкообразующей дозой.
Эти дозы будут выражать титр вируса в данных тест-системах.
Т=n/V*a, T -титр вируса, n- среднее количество бляшек V- объем заражающей дозы a- разведение вирусного материала
b) инфекционному действию со статически оцениваемым результатом
За единицу кол-ва вируса принимается такая доза, которая способна вызвать инфекционный эффект у 50% зараженных живых тест-систем.
ЭД50 – эффективная 50% доза - число таких доз вируса в ед. объема исслед-го материала будет выражать титр вируса.
ЛД50 – летальная 50%я доза
ИД50 – 50% инфицирующая доза – вызывает клинические симптомы или пат изменения у зараженных лаб жив-х.
ЭЛД50 – эмбриональная летальная доза, вызывающая гибель 50% КЭ
ЭИД50 – эмбриональная, тоже, что ИД50, только для КЭ
ЦПД50 – цитопатическая 50% - доза вируса, вызывающая цитопатический эффект у 50% зараженных КК
Рассчитывают по формуле: lg ЛД50= lgB + (b-50)/(b-a)*lgd
B – разведение, дающее 50% эффект
b – летальный эффект B
a – летальный эффект разведения < 50%
d – коэффициент разведения (1:2, 1:10 и тд.)
107. Амниотическая полость является буферной системой развития зародыша КЭ
108. Рекомбинация — процесс обмена генетическим материалом путем разрыва и соединения разных молекул. Обмен генетическими структурами между двумя вирусными геномами, происходящий в смешанно-зараженных клетках. У вирусов возможна рекомбинация между молекулами РНК их геномов.
109. Вирусные включения - скопление вирусных частиц или отдельных компонентов вирусов в цитоплазме или ядре клеток, выявляемые под микроскопом при специальном окрашивании. Включения различаются по величине, форме, численности. Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса, аденовирусами, гриппа, бешенства, оспы и др. Т.-в. классифицируют по локализации в клетке (цитоплазматич., внутриядерные), составу нуклеиновой к-ты (ДНК-, РНК-содержащие), тинкториальным свойствам (базофильные, оксифильные), гомогенности (аморфные, зернистые).Т.-в. локализуются избирательно. Цитоплазматич. Т.-в. образуются при болезнях, вызываемых сравнительно крупными вирусами (оспа человека, осповакцина, оспа птиц, бешенство, грипп, парагрипп, чума кр.рог. скота, пситтакоз и др.). Чаще они представлены в виде округлых, овальных или неправильной формы образований размером от 1—2 до 20—30 мкм. В поражённой клетке может быть неск. Т.- в. различных размеров и форм. Для каждого Т.-в. характерна внутренняя структура. Внутри ядерные Т. - в. встречаются при инфекциях, вызываемых как относительно крупными вирусами (герпес, болезнь Ауески, рино-трахеит), так и вирусами, имеющими очень мелкие размеры (ящур, гепатит собаки др.). Они лучше выявляются в гистол. препаратах, их морфологич. детали видны только при контрастной окраске среза. Форма и размеры этих Т.-в. зависят от штаммовых особенностей вируса, а также методов гистол. обработки материала. В зависимости от структурных особенностей внутриядерных Т.-в. и состояния нуклеоплазмы поражённой клетки различают2 типа Т.-в.— А и В. При нек-рых вирусных болезнях (бешенство, оспа, ринопневмония лошадей, ринотрахеит кр.рог.скота) обнаружение специфич. Т.-в. имеет диагностич. значение. В диагностике гриппа животных, болезни Ауески, ларинготрахеита птиц, энцефаломиелита лисиц, чумы плотоядных и др. болезней выявление Т.-в.— вспомогательный метод.
110. Оспа коров (лат. — Variola vaccina; англ. — Cowpox; осповакцина, вакциния) — контагиозная болезнь, характеризующаяся интоксикацией организма, лихорадкой и узелково-пустулезной сыпью на коже и слизистых оболочках.
Вирус оспы представляет собой крупный ДНК-содержащий вирус из семейства Poxviridae, рода Orthopoxvirus. У коров оспу может вызывать как вирус истинной коровьей оспы, так и вирус осповакцины (вирус натуральной оспы человека). По антигенным, иммунологическим и морфологическим свойствам оба эти вируса сходны, но различаются по ряду биологических свойств. Репродукция вирусов приводит к появлению характерных патологических изменений в хорион-аллантоисной оболочке куриных эмбрионов, а в культуре клеток — к выраженному ЦПД.
Вирусы оспы коров и осповакцины обнаруживают в эпителиальных клетках и в струпе из пораженных участков кожи больных коров. При окраске по Пашену, Морозову или Романовскому элементарные тельца вирусов при микроскопии имеют вид круглых шариков или точек.
Вирусы оспы коров и осповакцины во внешней среде сравнительно устойчивы. При температуре 4 °С вирус сохраняется до 1,5 лет, при 20 "С — 6 мес, а при 34 "С — до 60 дней. Замораживание консервирует вирусы. В загнивающей ткани они быстро гибнут. Из химических веществ наиболее эффективны 2,5...5%-ные растворы серной, соляной и карболовой кислот, 1...4%-ные растворы хлорамина и 5%-ный раствор калия перманганата. Источником возбудителя служат больные животные и человек. Во внешнюю среду вирус выделяется с истечениями из носовой и ротовой полостей, а также в составе экссудата, отторгающегося эпителия кожи (оспины), глаз больных животных и вирусоносителей. В передаче возбудителя могут участвовать обслуживающий персонал в период вакцинации и ревакцинации их оспенным детритом, если не соблюдаются правила личной гигиены, а также предметы ухода за животными и корма. Основные пути заражения коров оспой — контактный, аэрогенный и алиментарный. Возможна передача вируса кровососущими насекомыми, в организме которых он может сохраняться более 100 дней. Переносчиками возбудителя могут быть также мыши и крысы. Заболеваемость обычно низкая (до 5...7 %), летального исхода не наблюдается. Сезонность и периодичность эпизоотических вспышек нехарактерны. Развитие инфекционного процесса зависит от путей проникновения и вирулентности возбудителя. На месте инокуляции вируса в результате взаимодействия его с эпителиальными клетками возникает специфическое воспаление. Клетки эпидермиса набухают, пролиферируют, в некоторых из них появляются специфические включения — тельца Гварньери, которые рассматривают как колонии возбудителя, окруженные продуктами метаболизма пораженной клетки. Дистрофические и некротические изменения тканей, сосудистые расстройства, размножение клеток и инфильтрация соединительной ткани дермы приводят к формированию оспин. В папулах вирус находится в виде чистой культуры. Через расширенные капилляры и лимфатические щели вирус попадает в кровь, развивается виремия, опровождающаяся повышением температуры тела, угнетением. В зависимости от стадии развития оспенного процесса можно обнаружить папулы, везикулы и пустулы, покрытые коричневыми корочками, а иногда рядом с оспинами — фурункулы, абсцессы и флегмоны. Эпителий слизистой оболочки ротовой полости отторгается, в результате чего образуются эрозии и язвочки диаметром до 15 мм. Регионарные лимфатические узлы несколько увеличены, их капсула напряжена, сосуды полнокровны. При гистологическом исследовании в эпителиальных клетках эпидермиса обнаруживают внутриплазматические включения типа телец Гварньери. Диагноз ставят на основании эпизоотологических, эпидемиологических данных, клинических признаков и результатов лабораторного исследования. Для оспы коров характерны спорадическое проявление, локализация оспин, образующихся стадийно на коже вымени, совпадение во времени заболевания коров, людей и иммунизации населения против оспы.
В лабораторию для вирусологического исследования направляют содержимое папул или формирующихся везикул.
Материал культивируют в развивающихся куриных эмбрионах или в культурах клеток, выделяют и идентифицируют возбудитель.
Для гистологических исследований готовят тонкий мазок с поверхности срезанной папулы, подсушивают его на воздухе и окрашивают по Морозову.
Обнаружение элементарных телец в окрашенных препаратах имеет диагностическое значение, а их отсутствие не служит основанием для исключения оспы. В этом случае испытуемым материалом заражают кроликов в роговицу (проба Пауля).
При гистологическом исследовании пораженных участков роговицы обнаруживают тельца-включения Гварньери.
В качестве экспресс-диагностики применяют РДП на предметном стекле с использованием содержимого оспенной сыпи и иммунной антивакцинальной кроличьей сыворотки.
Обнаружение элементарных частиц вируса в оспинах и телец Гварньери в пораженных участках роговицы экспериментально зараженных кроликов подтверждает диагноз на оспу коров.
При дифференциальной диагностике необходимо исключить ящур. Постинфекционный иммунитет при оспе тканево-гуморальный и сохраняется пожизненно. Для специфической профилактики применяют живую вирус-осповакцину.
111. Культивирование вирусов в куриных эмбрионах.
Большинство известных вирусов обладают способностью размножаться в курином эмбрионе (рис.4). Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9-10, осповакцины - в 12, паротита - в 7-дневных куриных эмбрионах. Размножение вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
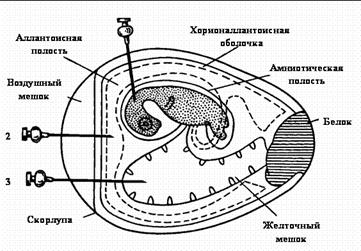
Существует несколько способов заражения развивающегося куриного эмбриона: на хорионаллантоисную оболочку, в аллантоисную и амниотическую полости, желточный мешок, тело эмбриона.
Заражение на хорионаллантоисную оболочку применяется для выделения и культивирования вирусов, образующих на оболочках бляшки (вирусы вакцины, натуральной оспы, простого герпеса). Перед заражением яйца просвечивают с помощью овоскопа, карандашом очерчивают границу воздушного пространства и хорионаллантоисной оболочки. Поверхность яйца над воздушным пространством и в месте заражения протирают спиртом, прожигают, обрабатывают йодом и делают отверстие в полости воздушного мешка. На месте заражения скорлупу удаляют так, чтобы не повредить подскорлупную оболочку, которую затем прокалывают короткой стерильной иглой, чтобы не повредить хорионаллантоисную оболочку. Воздух из полости воздушного мешка отсасывают. Вирусный материал (0,05 - 0,2 мл) наносят на хорионаллантоисную оболочку туберкулиновым шприцем с короткой иглой или пастеровской пипеткой. Отверстие в скорлупе закрывают стерильным покровным стеклом или тем же выпиленным кусочком скорлупы и по краям заливают расплавленным парафином. Зараженные эмбрионы располагают на подставке горизонтально и инкубируют в термостате. Вскрытие эмбрионов производится не раньше 48 часов инкубации. На зараженной оболочке обнаруживаются беловатые непрозрачные пятна разной формы (бляшки).
Заражение в аллантоисную полость. Вирус, введенный в аллантоис, размножается в эндодермальных клетках, переходя затем в аллантоисную жидкость. Заражение осуществляют следующим способом: в скорлупе над воздушной камерой острием скальпеля или ножниц производят прокол, после чего через отверстие в вертикальном направлении вводят иглу со шприцем, которая проходит через хорионаллантоисную оболочку и попадает в аллантоисную полость, материал вводится в объеме 0,1 мл и отверстие заливают парафином.
Заражение в желточный мешок. С этой целью используют эмбрионы 5 - 10-дневного возраста. Наиболее употребительны два метода заражения. По первому материал вводится через воздушное пространство. В центре яйца делают отверстие, помещают его на подставку тупым концом вправо и через отверстие в вертикальном направлении вводят иглу, надетую на шприц, игла проходит через хорионаллантоисную оболочку, аллантоисную полость в желток. В желточный мешок можно ввести от 0,1 до 0,5 мл вируссодержащего материала. После заражения отверстие в скорлупе заливают парафином, и эмбрион помещают в термостат. По второму методу на границе воздушного пространства с той стороны, где лежит желток (стороны, противоположной от эмбриона), делают прокол скорлупы, через который вводят инфекционный материал. Направление иглы должно быть к центру яйца.
Индикацию вирусов в курином эмбрионе осуществляют на основании специфических поражений оболочек и тела эмбриона (оспины, кровоизлияния), а также в РГА.
112. Клетки выращивают в специальных питательных средах, при постоянной температуре, а для клеток млекопитающих обычно необходима также специальная газовая среда, поддерживаемая в инкубаторе клеточных культур[6][7]. Как правило, регулируется концентрация в воздухе углекислого газа и паров воды, но иногда также и кислорода. Питательные среды для разных культур клеток различаются по составу, pH, концентрации глюкозы, составу факторов роста и др[8]. Факторы роста, используемые в питательных средах, чаще всего добавляют вместе с сывороткой крови. Одним из факторов риска при этом является возможность заражения культуры клеток прионами или вирусами. При культивировании одной из важных задач является исключение или сведение к минимуму использование зараженных ингредиентов. Однако на практике это бывает достигнуто не всегда. Наилучшим, но и наиболее дорогостоящим способом является добавление вместо сыворотки очищенных факторов роста[9].
Клетки можно выращивать в суспензии, либо в адгезивном состоянии. Некоторые клетки (такие, как клетки крови) в естественных условиях существуют во взвешенном состоянии. Существуют также линии клеток, искусственно измененных таким образом, чтобы они не могли прикрепляться к поверхности; это сделано для того, чтобы увеличить плотность клеток в культуре. Для выращивания адгезивных клеток требуется поверхность, например, культура ткани, или пластик, покрытый элементами внеклеточного матрикса для улучшения адгезивных свойств, а также для стимулирования роста и дифференцировки. Большинство клеток из мягких и твердых тканей адгезивны. Из адгезивного типа культуры выделяются органотипические культуры клеток, которые представляют собой трехмерную среду, в отличие от обычной лабораторной посуды. Этот система культивирования физически и биохимически наиболее сходна с живыми тканями, но имеет некоторые технические сложности в обслуживании (например, нуждается в диффузии). Особенности выращивания клеток
При выращивании клеток, из-за постоянного деления может возникнуть их переизбыток в культуре. В результате чего могут возникнуть следующие проблемы:
· Накопление в питательной среде продуктов выделения, в том числе токсичных.
· Накопление в культуре омертвевших клеток, прекративших жизнедеятельность.
· Скопление большого количества клеток оказывает негативное влияние на клеточный цикл, рост и деление замедляются, а клетки начинают стареть и отмирать (контактное ингибирование роста).
По той же причине может начаться клеточное дифференцирование.
Для поддержания нормального функционирования культур клеток а также для предотвращения негативных явлений периодически проводят замену питательной среды, пассажирование и трансфекция клеток. Во избежание загрязнения культур бактериями, дрожжами, или другими линиями клеток, все манипуляции обычно проводят с соблюдением правил асептики в стерильном боксе. Для подавления микрофлоры в питательную среду могут быть добавлены антибиотики (пенициллин, стрептомицин) и противогрибковые препараты(амфотерицин Б).
Одним из продуктов метаболизма в клетках являются кислоты, вследствие чего pH среды постепенно снижается. Для контроля кислотности питательных сред, в них добавляют индикаторы pH. Если культура клеток адгезивная, питательную среду можно полностью заменять.
Все среды по своему назначению делятся на ростовые и поддерживающие. В составе ростовых сред должно содержаться больше питательных веществ, чтобы обеспечить активное размножение клеток для формирования монослоя на поверхности стекла или достаточно высокую концентрацию клеточных элементов в суспензии (при получении суспензионных культур). Поддерживающие среды фактически должны обеспечивать лишь переживание клеток в уже сформированном монослое при размножении в клетках вирусных агентов. Ростовые и поддерживающие среды многокомпонентны. В их состав могут входить как естественные продукты (амниотические жидкости, сыворотки животных), так и субстраты, полученные в результате частичной обработки естественных продуктов (эмбриональные экстракты, гидролизат лактальбумина, гемогидролизат, аминопептид и т. д.), а также синтетические химически чистые вещества (аминокислоты, витамины, соли).
В качестве примера питательной среды, полностью состоящей из естественных компонентов, можно назвать среду Бакли, предложенную для выращивания клеточных культур из почечного эпителия обезьян. В эту среду входит коровья амниотическая жидкость (85%), лошадиная сыворотка (10%) и коровий эмбриональный экстракт (5%). Все естественные продукты малостандартны, их использование связано с большой опасностью микробной и вирусной контаминации клеточных культур. В связи с этим и происходит постепенное вытеснение их синтетическими стандартными смесями. Наибольшее применение находят синтетическая среда 199 и среда Игла. Широко используются среды, содержащие строго определенные количества солей, аминокислот и витаминов. Независимо от назначения все питательные среды для тканевых культур конструируются на основе какого-либо сбалансированного солевого раствора с достаточной буферной емкостью. Чаще всего ими являются растворы Хенкса и Эрла. Эти растворы — обязательный компонент любой питательной среды. Неотъемлемым компонентом большинства ростовых сред является сыворотка животных (телячья, бычья, лошадиная), без наличия 5—10% которой размножение клеток и формирование монослоя не происходит. Включение сыворотки в то же время препятствует созданию ростовых сред точного химического состава, весьма важных для развития фундаментальных исследований по клеточной физиологии, так как вместе с сывороткой (или ее дериватами) вводится целый комплекс неконтролируемых факторов, варьирующих в зависимости от серии сыворотки. В 50-е годы Ewans и Waymouth были предложены бессывороточные среды точного химического состава. Однако эти среды не обеспечивали тех показателей пролиферативной активности клеток, которые обусловливают среды с добавлением сывороток. В связи с этим представляет интерес работа Birch и Pirt, пока
 2015-06-10
2015-06-10 1419
1419








