Рис. 4. Мартеновская печь
1,5 – головки печи с каналами; 2 – газовые каналы; 3 – свод; 4 – плавильное пространство; 6,9 – регенераторы; 7 – под; 8 – окна для завалки шихты
Воздух и газ по каналам подаются в регенератор (рис.4), насадка которого нагрета до 1500…1550 ºС и отдает тепло проходящим через них воздуху и газу. Последние затем поступают по вертикальным каналам в рабочее пространство печи, где сгорают. Продукты горения через левые каналы направляются в регенераторы и нагревают там насадку, после чего удаляются в трубу. После остывания правой насадки клапаны перекидываются и газ, и воздух идут через левый регенератор.
Производство стали заключается в выжигании из доменного чугуна примесей за счет кислорода воздуха, проходящего над расплавленным металлом, и кислорода оксидов железа (в виде железного лома или чистой железной руды).
Большинство мартеновских печей работают на смеси доменного и коксового газов, иногда на мазуте.
Шихтовые материалы (скрап, чугун, флюсы) загружаются через завалочные окна. Готовая сталь выпускается через отверстие в поде печи, которое на время плавки забивается огнеупорной глиной. Емкость печей до 50 тонн металла.
Мартеновский процесс бывает кислым и основным. В зависимости от вида исходных материалов также могут быть разные плавки: при твердой шихте (чушковый чугун, лом, немного железной руды) – скрап-процесс.
На заводах с полным металлургическим циклом в мартены подают жидкий чугун (до 60%), металлические отходы (до 40%), железную руду и флюсы – скрап-рудный процесс.
Периоды работы печи:
1) загрузка и плавление шихты;
2) кипение металла;
3) доводка и раскисление металла.
Основной мартеновский процесс в настоящее время применяется чаще всего, т.к. он дает возможность использовать чугуны почти любого состава. Особенностью его является введение в шихту известняка и устройство основного пода печи (доломит или магнезит), благодаря чему удаляются из стали фосфор и сера, а шлаки имеют основный характер. Этот процесс может протекать как при твердой шихте (скрап-процесс), так и при жидкой (рудный процесс) и состоит из следующих этапов.
1) В период загрузки и плавления шихты частично окисляются железо и фосфор и польностью кремний и марганец, образуется первичный шлак (10…15 % FeO, 35…40 % СаО, 10…15 % MnO). После образования шлака жидкий металл не контактирует с газами, окисление примесей происходит закисью железа FeO).
К концу расплавления шихты значительная часть фосфора переходит в шлак:
2Р + 5FeO + 4СаО → (СаО)4·Р2O5 + 5Fe.
Во избежании обратного перехода фосфора в металл перед началом следующего периода плавки около 40…50 % первичного шлака из печи скачивают, добавляя известь для образования нового более основного шлака.
2) Через 15…20 минут после образования основного шлака в печь загружают железную руду, что приводит к окислению углерода:
С + FeO → СО + Fe.
Образующаяся СО выделяется из металла в виде пузырьков, вызывая кипение. Это способствует перемешиванию металла и равномерному распределению температуры.
3) Когда содержание углерода в пробах металла будет несколько меньше, чем требуется в стали, кипение прекращается и начинается период доводки и раскисления металла, для чего вводят в печь ферромарганец (12 % Mn) или ферросилиций (12…16 % Si):
Mn + FeO → MnO + Fe,
Si + 2FeO → SiO2 + 2Fe.
Металл раскисляется и реакция окисления углерода приостанавливается, шлак перестает кипеть.
4) После введения раскислителей происходит частичное удаление серы из металла:
FeS + СаО → СаS + FeО.
В основной мартеновской печи можно выплавлять легированную сталь многих марок, для чего после раскисления в ванну добавляют легирующие добавки (медь, хром, никель и др.) или ферросплавы (феррохром, ферротитан, ферромарганец и др.)
Перед выпуском сталь выдерживают в печи под слоем шлака для более равномерного распределения легирующих примесей по объему металла и некоторой дегазации металла.
Кислый мартеновский процесс состоит из тех же операций, что и основный, но требует применение шихты с минимальным количеством (менее 0,03 %) фосфора и серы, т.к. кислый шлак не обладает свойством задерживать эти вредные примеси стали.
Кислые мартены работают при скрап-процессе (скрапа 30…50%), в шихте должно быть не более 0,6% кремния. Все это ограничивает применение данного способа производства стали.
В мартеновских печах выплавляются обычные и высококачественные стали. В этих печах можно с большой точностью регулировать химический состав, периодически контролируя его в экспресс-лаборатории.
Металлические свойства кислой мартеновской стали выше, чем основной, т.к. в кислой меньше закиси железа FeО, растворенных газов и неметаллических включений. Однако, более распространен основной процесс, т.к. при кислом нельзя удалять фосфор и серу.
Достоинства:
– возможность переработки различных чугунов;
– длительный процесс позволяет контролировать химический состав по ходу плавки;
– лучшие (чем в конверторах) условия для раскисления, меньший угар металла (менее 2%).
Недостатки мартеновского производства:
– низкая производительность;
– участие газов в процессах окисления;
– невысокие температуры, что не позволяет полностью удалить примеси и затрудняет ввод легирующих элементов.
3.3. Выплавка стали в электропечах
Этот способ имеет ряд преимуществ:
– можно получать температуру до 2000 ºС и расплавлять металл с высокой концентрацией тугоплавких компонентов (хром, вольфрам, молибден и др.);
– иметь высокоосновный шлак (до 55…60 % СаО) и хорошо очищать металл от вредных примесей;
– создавать восстановительную атмосферу или вакуум и добиваться хорошего раскисления и дегазации металла.
В электропечах нагревание достигается за счет значительного сопротивления, оказываемого прохождению электрического тока слоем жидкого шлака, которого почти касаются концы угольных электродов, слой шлака одновременно предохраняет находящийся под ним металл от угара. В электропечи возможна очень точная дозировка отдельных составных частей шихты, благодаря чему получается сталь, отличаемая высоким качеством (электросталь).
Наибольшее распространение при электроплавке получили дуговые печи (рис.5), в которых высокая температура создается в результате образования электрической дуги между электродами и расплавленным металлом.
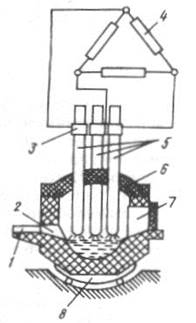
Рис. 5. Схема электродуговой печи
1 – желоб для слива металла; 2 – летка; 3 – электрододержатели; 4 – вторичная обмотка печного трансформатора; 5 – графитовые электроды; 6 – съемный свод; 7 – боковое рабочее окно; 8 – опорные сегменты
Под дуговой печи обычно основной, свод – из динаса. Емкость печей составляет от 250 до 200000 кг.
Процесс электроплавки разбивается на две стадии: окисления и раскисления.
1) На первой стадии расплавляется шихта из стального лома, известняка и руды и окисляются примеси кислородом, содержащимся в оксидах железа руды. После этого печь наклоняют и сливают шлак.
2) На второй стадии металл раскисляется, попутно науглероживаясь, и в него вводят легирующие добавки.
При изготовлении высоколегированных сталей плавку также ведут в высокочастотных (500…2500 Гц) индукционных печах, представляющих собой огнеупорный тигель, окруженный соленоидом, который питается током от генератора высокой частоты. Емкость таких печей от 50 до 10000 кг. Используются эти печи для выплавки высоколегированных сталей и сплавов особого назначения. Они позволяют вести плавку в вакууме или в нейтральной атмосфере.
Для улучшения структуры и свойств металла, лучшего удаления примесей стали могут переплавлять способами:
– вакуумно-дуговым,
– электро-шлаковым,
– электронно-лучевым,
– плазменно-дуговым и др.
3.4. Разливка стали и пороки стальных слитков
По степени раскисления сталь разделяют на спокойную, кипящую и полуспокойную. При полном раскислении получается спокойная сталь (весь кислород связываемся кремнием или марганцем раскислителей и уходит в шлак), при неполном раскислении в процессе разливки продолжается процесс связывания углерода с образованием углекислого газа, который пробулькивает через сталь, создавая эффект кипения– кипящая сталь. Полуспокойная сталь занимает промежуточное положение.
Готовая сталь выпускается из печи в подогретый сталеразливочный ковш, который футерован шамотом и имеет в дне отверстие, закрываемое пробкой для выпуска металла. Из ковша сталь разливают в чугунные изложницы для получения слитков или в земляные формы для получения фасонного литья.
Применяется три способа разливки:
1) сверху – для крупных слитков;
2) сифоном (снизу) – при отливке мелких и средних слитков;
3) непрерывный.

Рис. 6. Разливка стали в изложницы: (а) сверху, (б) снизу
1 – сталеразливочный ковш; 2 – промежуточная воронка; 3 – прибыльная надставка; 4 – изложница; 5 - башмак; 6 – каналы; 7 – поддон.
При разливке стали сверху каждую изложницу заполняют сталью отдельно. При сифонной разливке сталь из ковша поступает в центральный стояк и отводится из него в несколько изложниц летниковым каналам, расположенным в поддонах.
При соприкосновении жидкой стали с относительно холодными стенками чугунной изложницы возникает корковый слой металла, состоящий из мелких неориентированных кристаллов. Изложница, разогреваясь, расширяется, а сталь суживается, поэтому между слитком и стенками изложницы образуется воздушная прослойка, плохо проводящая тепло, в результате чего скорость охлаждения жидкого металла уменьшается. Наступают условия для возникновения длинных кристаллов, растущих по направлению отвода тепла перпендикулярно стенкам изложницы. В первую очередь затвердевают кристаллы более чистого металла, имеющего максимальную температуру затвердевания. Остающаяся внутри слитка жидкая фаза (маточный раствор) обогащается примесями углерода, серы, фосфора и др., что понижает ее температуру плавления. По мере охлаждения слитка внутри начинается рост кристаллов. Одновременно по всей массе возникает зона неориентированных зерен, свободно растущих в жидком расплаве. В нижней части слитка может образоваться конус осаждения, богатый неметаллическими включениями. В верхней части располагается усадочная раковина, эта часть называется прибылью, является дефектной частью слитка и идет в отход.

Рис. 7. Структура отливки
1 – усадочная раковина, 2 - зона неориентированных зерен, 3 – кристаллизационная зона с ориентированными кристаллами, 4 – корковый слой с мелкими зернами
Наличие усадочной раковины характерно для спокойной стали, поэтому ее обычно разливают сверху, за счет чего уменьшается высота усадочной раковины.
Слиток кипящей стали характеризуется отсутствием усадочной раковины и обилием газовых пузырей. Наличие газовых пузырей не является серьезным дефектом слитка, т.к. при соответствующей степени обжима слитка в процессе прокатки стенки пузыря будут заварены.
Контрольные вопросы
1. Что называют сталью? 2. Что является сырьем для получения стали? 3. В чем сущность процесса получения стали? 4. В каких агрегатах получают сталь и каковы принципы их работы? 5. Какие существуют способы разливки стали?
4. Металловедение
Для рассмотрения строения, превращений и свойств металлов и сплавов введем понятия «фаза» и «структура».
Фаза – однородная часть металла или сплава, имеющая одинаковый состав, кристаллическое строение и свойства и отделенная от остальных частей системы поверхностью раздела.
Структура – строение металла или сплава. Кристаллические тела в отличие от аморфных дают зернистый излом, по которому можно судить о размере зерна, термообработке и некоторых свойствах металла: крупный зернистый излом отвечает обычно худшим механическим свойствам, чем мелкозернистый.
4.1. Строение металлов
Технические металлы в твердом виде состоят из прочно связанных в одно целое кристаллических зерен, расположенных хаотически.
Характерным признаком кристаллического строения металлов является правильное расположение атомов в каждом отдельном кристалле металла. Атомы в кристаллах находятся на определенных расстояниях друг от друга, образуя пространственную кристаллическую решетку (дальний порядок размещения атомов).
Кристаллическая решетка – воображаемая пространственная сетка, в узлах которой располагаются атомы (ионы), образующие металл.
Для однозначной характеристики кристаллической ячейки необходимо знать: три ребра (a,b,c) и три угла между осями (α,β,γ). Исходя из соотношений между осевыми единицами все пространственные решетки делятся на 7 систем (сингоний):
1) a=b=c; α=β=γ=90° – кубическая;
2) a=b≠c; α=β=γ=90° – тетрагональная;
3) a≠b≠c; α=β=γ=90° – ромбическая;
4) a=b≠c; α=β=90°; γ=120° – гексагональная;
5) a=b=c; α=β=γ≠90° – ромбоэдрическая;
6) a≠b≠c; α=γ=90°; β≠90° – моноклинная;
7) a≠b≠c; α≠β≠γ≠90° – триклинная.

Рис. 8. Элементарная ячейка
Кристаллические решетки, в которых атомы расположены в вершинах – простые, а если атомы расположены в вершинах и внутри ячеек или на их границах – сложные.
Пространственная кристаллическая решетка любого металла слагается из бесчисленного множества сопряженных друг с другом элементарных ячеек, внутри которых в известном порядке размещаются отдельные атомы (ионы).
Основными видами элементарных ячеек большинства металлов являются:
1) простая кубическая (п.к.)
2) объемноцентрированная кубическая (о.ц.к.)
3) гранецентрическая кубическая (г.ц.к.)
4) гексагональная
1 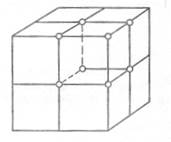 2
2  3
3  4
4 
Рис. 9. Виды элементарных ячеек
Расстояние «а» между центрами атомов, расположенных в узлах ячейки, называют периодом решетки (измеряется в ангстремах, 1Å=1·10-8 см).
Другими характеристиками решетки являются:
1) плотность упаковки – число атомов, приходящееся на одну элементарную ячейку (в простой кубической ячейке 8 атомов, но ее окружает еще 8 ячеек, т.е. каждый атом принадлежит 8 ячейкам, тогда на 1 ячейку приходится 1 атом, для о.ц.к. решётки плотность упаковки = 2, для г.ц.к. = 4);
2) координационное число – число атомов, находящихся на равном и наиболее близком расстоянии от избранного.
Вследствие неодинаковой плотности атомов в различных направлениях многие свойства (физические, химические, механические) кристалла зависят от направления. Подобная неодинаковость свойств монокристалла в разных направлениях называется анизотропией. Кристалл – анизотропное тело в отличие от изотропных аморфных тел, свойства которых не зависят от направления.
Металлы – поликристаллы, т.е. состоят из огромного числа анизотропных кристаллов (0,001…0,1 мм), различно ориентированных друг к другу, поэтому во всех направлениях свойства металла более или менее одинаковы, т.е. поликристаллическое тело является изотропным. Такая мнимая изотропность металла не будет наблюдаться, если кристаллы имеют одинаковую ориентировку, например, возникшую при холодной деформации; в этом случае металл приобретает анизотропность.
Впервые на связь между строением металлов и сплавов и их свойствами обратили внимание русские металлурги П.П.Аносов (1799-1851 г.г.) и Д.К.Чернов (1839-1921 г.г.). Для исследования строения металлов П.П.Аносов использовал микроскоп, Д.К. Чернов установил связь между строением, свойствами и термообработкой металлов. Труды этих ученых составляют основу современного металловедения.
Первое подробное описание структур железоуглеродистых сплавов было сделано Ржешетарским (1898 г.). Дальнейшее развитие металловедение получило в трудах отечественных ученых: Беляева, Курнакова, Байкова, Штейнберга и др. Из иностранцев наиболее известны работы Аустена и Сорби (Англия), Осмонда и Ле-Шателье (Франция), Мартенса и Рейна (Германия), Совера (США), Хонда (Япония).
Установление зависимости между строением металлов и их свойствами послужило толчком к дальнейшим исследованиям строения металла. Сейчас для этого используются рентген, электронный микроскоп, термический анализ. Современное металловедение использует данные атомной физики, что позволяет глубже понять природу строения металлов и указывает новые пути повышения механических свойств металлов и сплавов, применяемых в технике.
Многие особые свойства металлов (электро- и теплопроводность) определяются особенностями их внутриатомного строения. Принадлежащие атому электроны разделяются на валентные (внешние) и внутренние, движущиеся на более близких к ядру орбитах. Валентные электроны слабо связаны с ядром и могут подвергаться воздействию положительно заряженных ядер близлежащих атомов, поэтому их можно назвать свободными электронами.
Строение реальных кристаллов металлов в отличие от идеальных характеризуются большим количеством дефектов, влияющих на свойства металлов (для монокристалла железа минимальная теоретическая прочность сдвига 23000 МПа, а фактическая 400 МПа, для алюминия фактическая прочность почти в 500 раз меньше теоретической). Дефекты появляются в результате образования атомных дырок а (вакансий), внедрения инертных атомов б и перемещения атома в в междоузлие. Дефекты, распространяющиеся на большую длину, называются дислокациями (рис.10).

Рис. 10. Виды дислокаций
Переход металла из твердого состояния в жидкое происходит при строго определенной температуре (температуре плавления), тогда как аморфные вещества не имеют строго определенной температуры. И наоборот, переход металла из жидкого состояния в твердое происходит также при фиксированной температуре – температуре кристаллизации, которая равна температуре плавления.
|
|
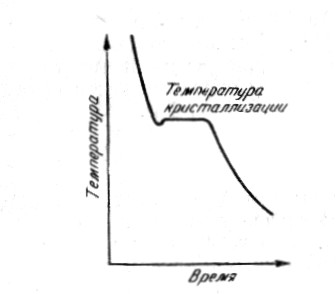
Рис. 11. Схема кристаллизации расплавленного металла
Точка m – возникновение при определённой температуре первых центров кристаллизации, количество которых увеличивается по мере отвода тепла. Ранее возникшие кристаллы увеличиваются до тех пор, пока весь металл не затвердеет (n). Этот процесс сопровождается выделением скрытой теплоты кристаллизации, поэтому t ºС = const..
Кристаллизацией называется процесс образования кристаллов из жидкой или газообразной фазы. При быстром охлаждении металл может некоторое находиться в жидком состоянии при температуре ниже температуры кристаллизации. Разность между теоретической tт при медленном охлаждении и фактической tф температурами кристаллизации называется степенью переохлаждения:
Δt = tт - tф.
Интенсивность кристаллизации (как установил Г.Тамман) зависит от степени переохлаждения и характеризуется:
1) скоростью зарождения – числом центров кристаллизации (ц.к.), зарождающихся в единице объема металла в единицу времени (мм-3·сек-1);
2) скоростью роста (с.к.) – скоростью увеличения линейных размеров растущей грани кристалла в единицу времени (мм/сек).
Зависимость этих характеристик от степени переохлаждения приведена на рис.12:

Рис. 12. Зависимость кристаллизации от скорости переохлаждения
Число центров кристаллизации и скорость роста с увеличением Δt увеличиваются, достигают максимума и уменьшаются до нуля. При малой степени переохлаждения Δt скорость роста велика, а скорость зарождения мала – в результате металл будет иметь крупнокристаллическое строение.
При большей степени переохлаждения скорость роста меньше скорости зарождения – мелкокристаллическое строение металла. Поскольку кристаллизация начинается одновременно в разных точках объема, рост кристаллов правильной формы постепенно нарушается вследствие столкновения кристаллов между собой. В результате образуется множество кристаллов неправильной формы – кристаллиты.
4.3. Аллотропические превращения
Некоторые металлы (железо, олово, титан, цирконий, кобальт и др.) в твердом состоянии способны к аллотропическим или полиморфным превращениям, т.е. могут переходить при охлаждении или нагревании из одной кристаллической формы в другую (перекристаллизация).
Аллотропические превращения железа можно проследить по кривым охлаждения и нагревания:

Рис. 13. Схема полиморфных превращений железа
Переход железа из одной формы в другую сопровождается выделением тепла - горизонтальной площадке, а при нагреве – поглощением тепла.
На кривой охлаждения при 1539ºС появляется первая горизонтальная площадка, соответствующая переходу железа из жидкого состояния в твердое Feδ с выделением тепла. Feδ – кубическая объемно-центрированная решетка с а=2,93 Å и координационным числом 8.
При 1390ºС Feδ переходит в Feγ с кубической гранецентрированной решеткой, что сопровождается уменьшением объема.
При 898ºС Feγ переходит в Feβ с кубической объемно-центрированной кристаллической решеткой и сопровождается увеличением объема, т.к. в Feβ атомы расположены менее тесно.
При 768ºС Feβ переходит в Feα. Переход состоит во внутриатомных превращениях, в результате которых у Feα появляются магнитные свойства, а кристаллическая решетка остаётся как у Feβ.
При нагреве железа превращения совершаются в обратном порядке.
Важное значение для термообработки имеет свойство Feγ давать с углеродом твердые растворы. Наибольшая растворимость углерода в Feγ (до 1,7%) наблюдается при t=1130ºС. При повышении и понижении температуры от 1130ºС растворимость углерода в Feγ понижается. Твердый раствор углерода и других элементов в Feγ называется аустенитом.
Feα не образует с углеродом устойчивых твердых растворов подобных аустениту. Растворимость углерода в Feα ничтожна. Твердые растворы небольших количеств углерода в Feα называют ферритом.
Полиморфное превращение носит кристаллизационный характер и осуществляется путем образования зародышей и последующего их роста в результате перехода атомов из старой модификации в новую. Зародыши новой модификации чаще возникают на границах зерен исходных кристаллитов. В результате образуются новые кристаллические зерна, имеющие другой размер и форму – перекристаллизация. Изменение компактности кристаллической решетки при переходе из одной полиморфной формы в другую влечет изменение объема вещества, что оказывает большое влияние на изменение размеров и формы стальных деталей при их термообработке.
4.4. Двойные сплавы
В технике широко применяют не чистые металлы, а сплавы, обладающие металлическими свойствами и состоящие из двух и более компонентов.
Однородные составные части сплава называются фазами. Фазами системы могут быть чистые элементы (в виде механической смеси), химические соединения и твердые растворы.
Механическая смесь компонентов А и В образуется в том случае, если они неспособны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. При этих условиях сплав будет состоять из кристаллов А и В со свойственными им решетками. Особенностью таких сплавов является то, что температура плавления сплава определённого состава будет минимальной. Сплавы такого состава называются эвтектическими или эвтектикой и могут образовываться не только чистыми металлами, но и другими фазами. В зависимости от числа компонентов эвтектики могут быть двойными, тройными и т.д. Например, ледебурит – смесь цементита и аустенита (Fe + 4,3% С)

Рис.14. Виды твёрдых растворов, а – замещения, б – внедрения
При образовании химического соединения компоненты А и В имеют общую кристаллическую решетку, отличающуюся от каждой из решеток сплавляемых компонентов. В химическом соединении существует строго определенное соотношение атомов исходных элементов, поэтому его состав можно выразить химической формулой AnBm (цементит Fe3C).
Твердый раствор – однородное твердое тело, состоящее из атомов взаиморастворимых элементов. В отличие от механической смеси твердый раствор является однофазным, имеет общую кристаллическую решетку, а в отличие от химического соединения твердый раствор существует не при строгом определенном соотношении исходных компонентов и сохраняет кристаллическую решетку одного из компонентов.
В твердых растворах замещения растворение компонента В в металле А происходит путем частичного замещения атомами растворенного металла В атомов в решетке металла-растворителя А. твердые растворы замещения образуются в сплавах железо+никель, железо+марганец, железо + хром, медь+никель и т.д.
Твердые растворы внедрения образуют кристаллическую решетку, в которой атомы растворенного вещества В располагаются между атомами металла-растворителя А (сплавы железо+углерод).
4.5. Диаграммы состояния
Рассмотрение диаграмм состояния сплавов позволяет определить фазовые превращения при понижении температуры расплава в условиях очень медленного охлаждения при всех соотношениях сплавляемых компонентов. Эти диаграммы характеризуют окончательное состояние сплавов, т.е. полученное после окончания всех превращений и полного окончания кристаллизации.
Это состояние сплава характеризуется числом и концентрацией образовавшихся фаз и зависит от внешних условий (температуры и давления). Закономерность изменения числа фаз в сплаве определяется правилом фаз, которое устанавливает зависимость между числом степеней свободы (С), числом компонентов (К) и число фаз (Ф):
С = К + 2 – Ф,
где 2 – число внешних факторов (давление и температура).
Под числом степеней свободы понимают возможность изменения температуры и давления без изменения числа фаз, находящихся в равновесии.
Пример: сплав из двух компонентов при затвердевании является двухкомпонентной и двухфазной системой. В этом случае, С=2 и, следовательно, можно (в определенных пределах) изменять температуру и давление без изменения числа фаз, т.е. состояния сплава. Такой сплав кристаллизуется в определённом интервале температур.
В процессе кристаллизации меняется не только состав фаз, но и количественное соотношение между ними. Чем ниже температура, тем больше будет твердой фазы и меньше жидкой. Для определения количественного соотношения между фазами, находящимися при данной температуре в равновесии, пользуются правилом рычага: для определения весового или объемного количества твердой фазы необходимо взять отношение длины отрезка ( ), примыкающего к составу жидкой фазы к длине всей коноды (
), примыкающего к составу жидкой фазы к длине всей коноды (  ). Для определения же количества жидкой фазы берется отношение длины отрезка, примыкающего к составу твердой фазы (
). Для определения же количества жидкой фазы берется отношение длины отрезка, примыкающего к составу твердой фазы ( ) к длине коноды. Следовательно, количество твердой и жидкой фаз в процентах определится соотношениями:
) к длине коноды. Следовательно, количество твердой и жидкой фаз в процентах определится соотношениями:
 2017-10-25
2017-10-25 923
923








