1. Особенности адсорбции на микропористых адсорбентах. Обобщенное уравнение теории Дубинина (теория объемного заполнения микропор), частные случаи этого уравнения (уравнение Дубинина-Радушкевича). Расчет общего объема микропор по изотерме адсорбции.
На первый взгляд может показаться, что закономерности заполнения микропор должны следовать теории капиллярной конденсации. Однако размеры микропор таковы, что в них происходит перекрытие полей поверхностных сил противоположных стенок пор, что значительно повышает энергию адсорбции и искажает профиль мениска конденсата в порах, соответствующий уравнению Кельвина, т. е. приводит к дополнительному всасыванию адсорбата, резкому увеличению адсорбционного потенциала.
Особенности адсорбции на микропористых телах проявляются в их избирательном действии. Избирательность, или селективность, микропористых адсорбентов существенно выше, чем переходнопористых, благодаря тому, что большинство адсорбированных молекул взаимодействуют непосредственно с поверхностью адсорбента. В более крупных порах такое взаимодействие характерно только для первого слоя. В последующих же слоях взаимодействие не зависит от природы·, адсорбента, а определяется только природой адсорбата. Кроме этой особенности у микропор может проявляться так называемый ситовой эффект, заключающийся в том, что адсорбироваться могут только те молекулы, размеры которых меньше размеров микропор или равны им, в связи с чем все микропористые адсорбенты (не только цеолиты) называют молекулярными ситами.
Переходя к количественным соотношениям теории объемного заполнения пор, необходимо отметить, что в ее основе лежат представления потенциальной теории Поляни, предложенной первоначально для описания полимолекулярной адсорбции, исходя из двух основных параметров: адсорбционного потенциала ε, адсорбционного объема V и двух положений:
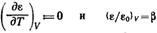
Степень заполнения адсорбента можно· представить как отношение величины адсорбции А к максимальной адсорбции А0, или как отношение заполненного объема V к предельному объему адсорбционного пространства V0, приведенных к нормальным условиям (давлению и температуре).
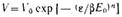 или
или 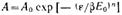
Эти уравнения являются общими уравнениями теории объемного заполнения микропор.
Заменив адсорбционный потенциал на его выражение через давление пара (ε = RTln(p/ps)) и прологарифмировав общее уравнение теории объемного заполнения микропор, получим:
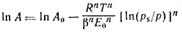
Для большинства активных углей n=2, тогда полученное уравнение переходит в уравнение Дубинина— Радушкевича:

Построение прямой в координатах 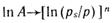 дает возможности найти константы этого уравнения A0 и E. Объем микропор Vп рассчитывают по уравнениям
дает возможности найти константы этого уравнения A0 и E. Объем микропор Vп рассчитывают по уравнениям
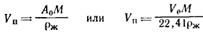
2. Факторы агрегативной устойчивости лиофобных дисперсных систем. Электролитная коагуляция (концентрационная и нейтрализационная коагуляция). Правило Шульце-Гарди и закон Дерягина. Способы стабилизации лиофобных дисперсных систем.
Различают следующие термодинамические и кинетические факторы агрегативной устойчивости дисперсных систем:
1. Электростатический фактор заключается в уменьшении межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана.
2. Адсорбционно-сольватный фактор состоит в уменьшении межфазного натяжения при взаимодействии частиц дисперсной фазы со средой (благодаря адсорбции и сольватации)
3. Энтропийный фактор, как и первые два относится к термодинамическим. Он дополняет первые два фактора и действует в системах, в которых частицы или их поверхностные слои участвуют в тепловом движении.
4. Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5. Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6. Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах, и об агрегативной устойчивости таких систем судят по скорости коагуляции.
Коагуляция может происходить как без внешнего воздействия на систему, так и при повышении температуры, межаническом, электрическом или другом воздействии, а в случае золей – при ведении коагулянтов, например электролитов.
Принято считать, что типичные лиофобные системы агрегатнвно устойчивы благодаря проявлению электростатического фактора стабилизации и коагулируют при введении в систему сравнительно небольших количеств любых электролитов. Наименьшая концентрация электролита см, при которой начинается коагуляция (медленная), называется порогом коагуляции. Для осуществления быстрой коагуляции требуется такая концентрация электролита сб, после увеличения которой скорость коагуляции остается постоянной (когда фактор устойчивости W=1, или потенциальный барьер ΔE = 0).
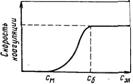 Зависимость скорости коагуляции от концентрации электролита показана на рисунке. Из этого рисунка следует, что введение электролита в дисперсную систему снижает потенциальный барьер, который при быстрой коагуляции (максимальной скорости) становится равным нулю. Порог коагуляции существенно зависит от момента его фиксирования, от метода наблюдения за коагуляцией (изменение интенсивности рассеяния света, реологических свойств и др.) и от концентрации золя, поэтому необходимо всегда подробно указывать условия определения этой величины.
Зависимость скорости коагуляции от концентрации электролита показана на рисунке. Из этого рисунка следует, что введение электролита в дисперсную систему снижает потенциальный барьер, который при быстрой коагуляции (максимальной скорости) становится равным нулю. Порог коагуляции существенно зависит от момента его фиксирования, от метода наблюдения за коагуляцией (изменение интенсивности рассеяния света, реологических свойств и др.) и от концентрации золя, поэтому необходимо всегда подробно указывать условия определения этой величины.
В соответствии с теорией ДЛФО введение электролита в дисперсную систему вызывает сжатие двойного электрического слоя на поверхности частиц, вследствие чего они могут подойти друг к другу на расстояния, на которых преобладают силы притяжения. Уменьшение толщины двойного слоя сопровождается обменом противоионов этого слоя на вызывающие коагуляцию ионы электролита.
Закон Дерягина: 
При высоких потенциалах порог быстрой коагуляции по теории ДЛФО не зависит от потенциала и обратно пропорционален заряду противоиона в шестой степени, что хорошо обосновывает известное эмпирическое правило Шульце — Гарди. По правилу Шульце — Гарди значения порогов коагуляции для электролитов с зарядами противоионов 1, 2, 3 находятся в соотношении 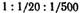 .
.
Чтобы обеспечить агрегативную устойчивость дисперсных систем, частицы которых имеют лиофобную поверхность, применяют стабилизаторы, способствующие увеличению межфазного взаимодействия. В качестве таких стабилизаторов широко применяют ПАВ и ВМС (имеющие неполярные и полярные части молекул), лиофилизируюшие поверхность частиц дисперсной фазы.
Стабилизацию лиофобных дисперсных систем с помощью лнофильных коллоидов (в первую очередь, ВМС) называют защитным действием стабилизаторов — коллоидной защитой.
3. Определите удельную поверхность (м2/г) порошка сульфата бария, если известно, что его частицы сферической формы оседают в водной среде с высоты 22,6 см за 1350 секунд. Плотность сульфата бария равна 4,5 г/см3, плотность и вязкость воды составляют 1 г/см3 и 10-3 Па·с, соотвстственно.

 2017-12-16
2017-12-16 2365
2365
