Обратимые и необратимые реакции:
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми.
Примером такой реакции может служить разложение хлората калия (бертолетовой соли) при нагревании:
2KClO3 ↔ 2KCl + 3O2 ↑
Реакция прекратится тогда, когда весь хлорат калия превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях.
В уравнениях обратимых реакций между левой и правой частями ставят две стрелки, направленные в противоположные стороны. Примером такой реакции может служить синтез аммиака из водорода и азота:
3H2+N2↔2NH3↑
Химическое равновесие:
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
Активность:
Термодинамическая Активность - величина, позволяющая представлять в удобной для практического использования форме концентрационную зависимость химических потенциалов компонентов реального раствора. С помощью этой величины можно применять к реальному раствору термодинамические соотношения, относящиеся к идеальному раствору, если заменить в них концентрации активностями. Отношение термодинамической активности компонента к его концентрации называется коэффициентом активности.
Константа равновесия, зависимость от температуры:
Константа равновесия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):

и изохоры химической реакции (изохоры Вант-Гоффа):

Здесь  и
и  — тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если
— тепловой эффект реакции, протекающей, соответственно, при постоянном давлении или при постоянном объёме. Если 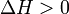 (тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия
(тепловой эффект положителен, реакция эндотермическая), то температурный коэффициент константы равновесия  тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье).
тоже положителен, то есть с ростом температуры константа равновесия эндотермической реакции увеличивается, равновесие сдвигается вправо (что вполне согласуется с принципом Ле Шателье).
Принцип Ле Шателье-Брауна:
Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:

Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоотводов.
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
· При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
· При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Представление о химической кинетике. Скорость химической реакции, средняя и истинная. Формальная кинетика. Основной закон химической кинетики. Кинетические уравнения. Константа скорости, физический смысл. Порядок реакции (частный и общий). Кинетический аспект химического равновесия.
Представление о химической кинетике:
Кинетика химических реакций, учение о химических процессах — о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных и торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации.
В реальных условиях, например в крупных промышленных аппаратах, химический процесс осложняется в связи с передачей тепла, выделяемого или поглощаемого в реакции, транспортом веществ в зону реакции, их искусственным или естественным перемешиванием. Эти проблемы решает так называемая Макрокинетика.
Вместе с тем многие уравнения, описывающие протекание во времени химических реакций, пригодны и для описания ряда физических процессов (распад радиоактивных ядер, деление ядерного горючего), а также для количественной характеристики развития некоторых биохимических, в том числе ферментативных, и других биологических процессов (нормальный и злокачественный рост тканей, развитие лучевого поражения, кинетические критерии оценки эффективности лечения). Химическая кинетика лежит в основе исследования сложных процессов горения газов и взрывчатых веществ, помогает изучению процессов в двигателе внутреннего сгорания. Таким образом, можно говорить об общей кинетике, частным случаем которой является кинетика химических реакций. Эти аналогии весьма удобны для практического использования, но всегда следует иметь в виду принципиальные различия в природе рассматриваемых явлений.
Ввиду сложности реальных химических систем и необходимости учета большого числа факторов и условий проведения процесса, при выяснении оптимальных режимов получения нужных продуктов в современной химической кинетике широко используются быстродействующие электронные вычислительные машины.
Скорость химической реакции, средняя и истинная:
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Закон действующих масс :Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным степени, равные их стехиометрическим коэффициентам.
Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
· природа реагирующих веществ,
· наличие катализатора,
· температура (правило Вант-Гоффа),
· давление,
· площадь поверхности реагирующих веществ.
Средней скоростью реакции называют отношение изменения концентрации вещества (уменьшения концентрации исходного вещества или увеличение концентрации продукта реакции) к промежутку времени, в течение которого это изменение произошло.
Предельная величина Δc/Δt, когда Δt стремится к нулю как к своему пределу (Δt → 0), называется истинной скоростью химической реакции.
Формальная кинетика:
Формальная кинетика – раздел кинетики, рассматривающий временной ход реакций вне зависимости от конкретных реагентов и продуктов.
Основные принципы:
- независимость скоростей элементарных стадий;
- принцип детального равновесия;
- материальный баланс по отдельным реагентам и продуктам.
Основной закон химической кинетики:
Основной закон химической кинетики вытекает из большого числа экспериментальных данных и выражает зависимость скорости реакции от концентраций реагирующих веществ:
 2018-01-21
2018-01-21 5307
5307
