Дисахариды
Строение
Дисахариды состоят из двух моносахаридных остатков, связанных гликозидной связью. Их можно рассматривать как О-гликозиды, в которых агликоном является остаток моносахарида.
Возможно два варианта образования гликозидной связи:
1) за счет гликозидного гидроксила одного моносахарида и спиртового гидроксила другого моносахарида;
2) за счет гликозидных гидроксилов обоих моносахаридов.
Дисахарид, образованный первым способом, содержит свободный гликозидный гидроксил, сохраняет способность к цикло-оксо-таутомерии и обладает восстанавливающими свойствами.
В дисахариде, образованном вторым способом, нет свободного гликозидного гидроксила. Такой дисахарид не способен к цикло-оксо-таутомерии и является невосстанавливающим.
В природе в свободном виде встречается незначительное число дисахаридов. Важнейшими из них являются мальтоза, целлобиоза, лактоза и сахароза.
Мальтоза содержится в солоде и образуется при неполном гидролизе крахмала. Молекула мальтозы состоит из двух остатков D-глюкозы в пиранозной форме. Гликозидная связь между ними образована за счет гликозидного гидроксила в -конфигурации одного моносахарида и гидроксильной группы в положении 4 другого моносахарида.
|
|
|
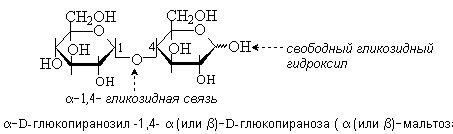
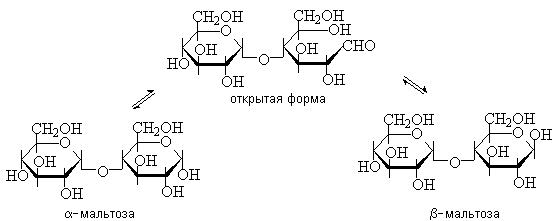
Мальтоза – это восстанавливающий дисахарид. Она способна к таутомерии и имеет - и -аномеры.
Целлобиоза – продукт неполного гидролиза целлюлозы. Молекула целлобиозы состоит из двух остатков D-глюкозы, связанных -1,4-гликозидной связью. Целлобиоза – восстанавливающий дисахарид.
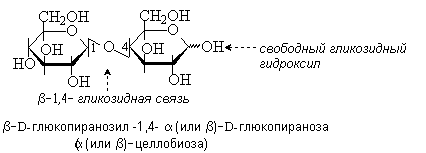
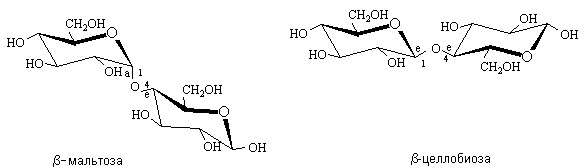
Различие между мальтозой и целлобиозой состоит в конфигурации гликозидной связи, что отражается на их конформационном строении. Гликозидная связь в мальтозе имеет аксиальное, в целлобиозе – экваториальное положение. Конформационное строение этих дисахаридов служит первопричиной линейного строения макромолекул целлюлозы и спиралеобразного строения амилозы (крахмал), структурными элементами которых они являются.
Лактоза с одержится в молоке (4-5%). Молекула лактозы состоит из остатков D-галактозы и D-глюкозы, связанных -1,4-гликозидной связью. Лактоза – восстанавливающий дисахарид.
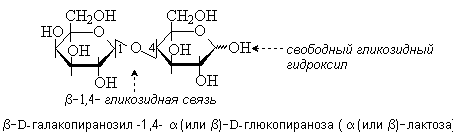
Сахароза содержится в сахарном тростнике, сахарной свекле, соках растений и плодах. Она состоит из остатков D-глюкозы и D-фруктозы, которые связаны за счет гликозидных гидроксилов. В составе сахарозы D-глюкоза находится в пиранозной, а D-фруктоза – в фуранозной форме. Сахароза – невосстанавливающий дисахарид.
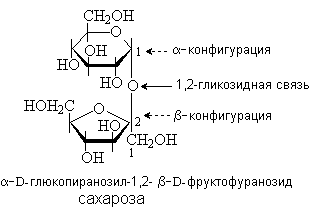
Дисахариды вступают в большинство реакций, характерных для моносахаридов: образуют простые и сложные эфиры, гликозиды, производные по карбонильной группе. Восстанавливающие дисахариды окисляются до гликобионовых кислот. Гликозидная связь в дисахаридах расщепляется под действием водных растворов кислот и ферментов. В разбавленных растворах щелочей дисахариды устойчивы. Ферменты действуют селективно, расщепляя только - или только -гликозидную связь.
|
|
|
Последовательность реакций – окисление, метилирование, гидролиз, позволяет установить строение дисахарида.
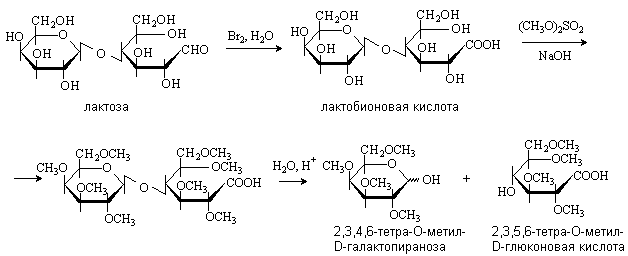
Окисление дает возможность определить, остаток какого моносахарида находится на восстанавливающем конце. Метилирование и гидролиз дают информацию о положении гликозидной связи и размерах цикла моносахаридных звеньев. Конфигурация гликозидной связи (или ) может быть определена с помощью ферментативного гидролиза.
11)Полисахариды.Классификация.Биологическая роль.+12)Гомополисахариды: крахмал (амилоза, амилопектин), гликоген, целлюлоза. Строение, химические св-ва, биологическая роль.
По своему функциональному назначению гомополисахариды могут быть разделены на две группы: структурные и резервные полисахариды. Важным структурным гомополисахаридом является целлюлоза, а главными резервными – гликоген и крахмал (у животных и растений соответственно).
Строгая классификация по химическому строению или биологической роли вследствие отсутствия для многих полисахаридов исчерпывающих данных невозможна. Поэтому чаще всего полисахариды «именуются» по источникам выделения, несмотря на то что один и тот же полисахарид может быть получен из совершенно разных источников.
Крахмал, как отмечалось, является основным резервным материалом растительных организмов. В небольших количествах он содержится в листьях, но главным образом накапливается в семенах (зерна злаков, например пшеницы, риса, кукурузы, содержат до 70% крахмала), а также в луковицах, клубнях и сердцевине стебля растений, где содержание его доходит до 30%.
Крахмал представляет собой смесь 2 гомополисахаридов: линейного – амилозы и разветвленного – амилопектина, общая формула которых (С6Н10О5)n. Как правило, содержание амилозы в крахмале составляет 10–30%, амилопектина – 70–90%. Полисахариды крахмала построены из остатков D-глюкозы, соединенных в амилозе и линейных цепях амило-пектина α-1–>4-связями, а в точках ветвления амилопектина – межцепочечными α-1–>6-связями:
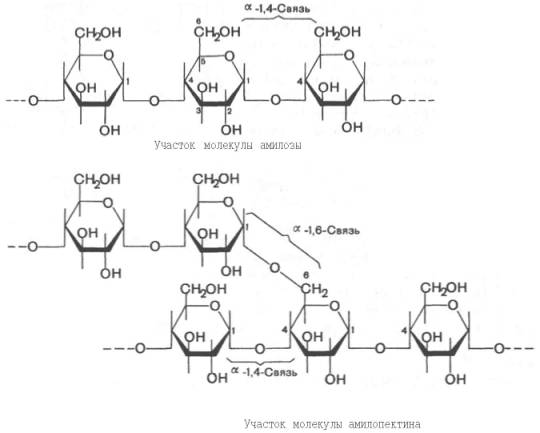
Итак, единственным моносахаридом, входящим в состав крахмала, является D-глюкоза. В молекуле амилозы линейно связано в среднем около 1000 остатков глюкозы; отдельные участки молекулы амилопектина состоят из 20–30 таких единиц. В настоящее время общепринятой является «ветвистая» структура отдельных цепочек с α-1–>4-связями в молекуле амилопектина (рис. 5.3).
Известно, что в воде амилоза не дает истинного раствора. Цепочка амилозы в воде образует гидратированные мицеллы. В растворе при добавлении йода амилоза окрашивается в синий цвет. Амилопектин также дает мицеллярный раствор, но форма мицелл несколько иная. Полисахарид амилопектин окрашивается йодом в красно-фиолетовый цвет.
Крахмал имеет молекулярную массу 105–107 Да. При частичном кислотном гидролизе крахмала образуются полисахариды меньшей степени полимеризации – декстрины, при полном гидролизе – глюкоза.
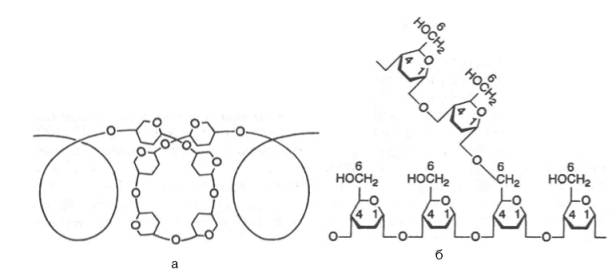
Рис. 5.3. Структура крахмала: а - амилоза с характерной для нее спиральной структурой; б - амилопектин, образующий в точках ветвления связи типа 1-6.
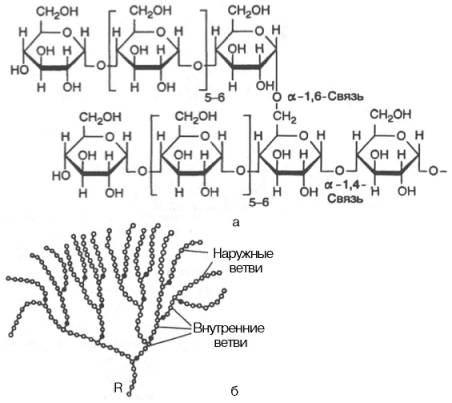
Рис. 5.4. Строение отдельного участка (а) и всей молекулы (б) гликогена (по Майеру). Белые кружки - остатки глюкозы, соединенные α-1,4-связью; черные кружки - остатки глюкозы, присоединенные α-1,6-связью; R - редуцирующая концевая группа. Внутренние цепи, или ветви,- участки между точками ветвления. Наружные цепи, или ветви, начинаются от точки ветвления и кончаются нередуцирующим остатком глюкозы.
|
|
|
Для человека крахмал является важным пищевым углеводом; содержание его в муке составляет 75–80%, в картофеле – 25%.
Гликоген – главный резервный полисахарид высших животных и человека, построенный из остатков D-глюкозы. Эмпирическая формула гликогена, как и крахмала, (С6Н10О5)n. Гликоген содержится практически во всех органах и тканях животных и человека; наибольшее количество обнаружено в печени и мышцах. Молекулярная масса гликогена 105–108 Да и более. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1–>4-гликозидными связями. В точках ветвления имеются α-1–>6-гликозидные связи. По строению гликоген близок к амилопектину. В молекуле гликогена различают внутренние ветви – участки от периферической точки ветвления до нередуци-рующего конца цепи (рис. 5.4).
Гликоген характеризуется более разветвленной структурой, чем амило-пектин; линейные отрезки в молекуле гликогена включают 11–18 остатков α-D-глюкопиранозы.
При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы.
Строение, номенклатура, стереоизомерия аминокислот.Классификация аминокислот: химические (по природе радикала и содержащихся в нём заместителей, по полярности радикалов) и биолгическая.
Стереоизомерия. Принцип построения аминокислот, т. е. нахождение у одного и того же атома углерода двух различных функциональных групп, радикала и атома водорода, уже сам по себе предопределяет хиральность альфа-атома углерода. Исключение составляет простейшая аминокислота глицин Н2N-СН2-СООН, не имеющая углеводородного радикала R и соответственно центра хиральности. Относительная конфигурация аминокислот определяется как и у гидроксикислот по конфигурационному стандарту — глицериновому альдегиду — с использованием гидроксикислого ключа. Расположение в стандартной проекционной формуле Фишера аминогруппы слева (подобно ОН-группе в L-глицериновом альдегиде) ответствует L-конфигурации, справа — D-конфигурации хирального атома углерода. По R,S-системе обозначений углеродный атом у всех аминокислот L-ряда имеет S-, а у D-ряда — R-конфигурацию (исключение составляет цистеин).
|
|
|
Большинство аминокислот содержит в молекуле один асимметрический атом углерода и существует в виде двух оптически активных энантиомеров и одного оптически неактивного рацемата. Почти все природные аминокислоты принадлежат к L-ряду.

Изолейцин, треонин, 4—гидроксипролин — содержат в молекуле по два центра хиральности. Эти аминокислоты могут существовать в виде четырех диастереомеров, представляющих собой две пары энантиомеров, каждая из которых образует рацемат. Из этих четырех стереоизомеров для построения белков человеческого организма используется только один.
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде:
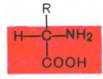
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (рI) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.
14 ) Кислотно-основные свойства альфа-аминокислот. Понятие об изоэлектрическом состоянии и изоэлектрической точке, электрофоретическом разделении аминокислот.Поясните на примере глицына, лизина, глутаминовой кислоты.
 2018-01-21
2018-01-21 15792
15792








