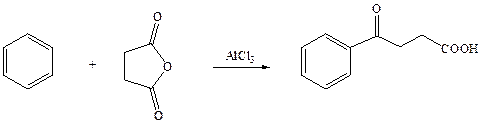
Реактивы: янтарный ангидрид – 6,8г (0,068 моль);
хлористый алюминий – 20,0 г (0,15 моль);
бензол (абсолютный) – 35,0г (43,75 мл, 0,45 моль).
Посуда: трехгорлая колба; термометр; механическая мешалка; делительная воронка; химический стакан; холодильник Либиха.
В трехгорлую круглодонную колбу на 250 мл, снабженную механической мешалкой и двумя обратными холодильниками, помещают 6,8 г ангидрида янтарной кислоты и 35,0 г сухого бензола. Мешалку пускают в ход и в колбу прибавляют за один прием 20,0 г (0,15 моль) растертого в порошок безводного хлористого алюминия. Начинается выделение хлористого водорода и смесь разогревается. При перемешивании смесь нагревают на масляной бане до кипения еще в течение получаса, затем смесь охлаждают холодной водой и через капельную воронку, вставленную в верхнюю часть одного из обратных холодильников, медленно приливают 30 мл воды. Избыток бензола отгоняют с водным паром и горячий раствор немедленно переливают в стакан. После охлаждения жидкость сливают с выделившегося осадка и подкисляют концентрированной соляной кислотой (около 2 мл); выпадает от 0,5 до 1,5 г бензоилпропионовой кислоты; ее отфильтровывают. Оставшуюся в стакане суспензию кипятят в продолжение 5 ч с 150 мл воды, содержащей 36 г карбоната натрия. Остаток отфильтровывают, промывают на фильтре горячей водой и фильтрат подкисляют концентрированной соляной кислотой (около 30 мл). Выпавшую бензоилпропионовую кислоту отфильтровывают и промывают горячей водой. Высушенная в продолжение одного дня кислота весит 9,5 – 10 г (72 – 82%); т. пл. 111-113 0С.
N-метоксиацетофенон

Реактивы: анизол 10 г – (9,8 мл, 0,11 моль);
хлористый алюминий – 14 г (0,11моль);
хлористый ацетил – 8,6 г (7,9 мл, 0,11 моль);
четыреххлористый углерод (абсолютный) – 60 мл.
Посуда: трехгорлая колба; термометр; механическая мешалка; делительная воронка; капельная мешалка; холодильник Либиха.
В трехгорлую колбу емкостью 250 мл, снабженную механической мешалкой, обратным холодильником и капельной воронкой, помещают раствор 14 г безводного AlCl3 в 60 мл сухого четыреххлористого углерода и при сильном перемешивании и охлаждении в бане со льдом медленно добавляют по каплям 8,6 г хлористого ацетила, а затем при охлаждении льдом и солью (0 – 5 0С в реакционной смеси) из той же воронки прибавляют 10 г анизола. Смесь перемешивают при комнатной температуре до прекращения выделения НCl и выливают (постепенно) в смесь 150 мл 2 н. НCl и 100 г льда. Тяжелый органический слой отделяют, промывают (по 2 раза порциями по 25 мл) 2 н. НCl, 2 н. раствором Na2CO3 и водой. Четыреххлористый углерод отгоняют. Остаток перегоняют в вакууме. Выход n -метоксиацетофенона – 12 г (85%); т. кип. 163 0С (28 мм рт. ст.); т. пл. 37 0С.
Ацетамид

Реактивы: этилацетат 17,6 г – (19,5 мл, 0,2 моль);
аммиак 25%-ный водный раствор – 200 мл
Посуда: трехгорлая колба; термометр; механическая мешалка; холодильник Либиха.
В трехгорлую колбу емкостью 250 мл, снабженную механической мешалкой и термометром, наливают 70 мл раствора аммиака, охлаждают смесью льда и соли до -10 0С и насыщают газообразным аммиаком, получающимся при кипячении раствора 25%-ного аммиака (130 мл). Затем при этой температуре к смеси добавляют 19,5 мл этилацетата в течение 15 мин и продолжают перемешивать в течение 1 ч. После этого реакционную смесь выливают в плоскодонную колбу с притертой пробкой и оставляют в холодильнике при температуре -15 0С на 24 ч.
Продукты реакции переливают в перегонную колбу, которую соединяют с холодильником, и без термометра под тягой отгоняют аммиак, воду и спирт до тех пор, пока в колбе не останется примерно четвертая часть первоначального объема жидкости. Остаток переливают в маленькую перегонную колбу, вставляют термометр и продолжают перегонку, пока термометр не покажет 190 0С. Тогда заменяют водяной холодильник коротким воздушным и, используя в качестве приемника небольшую коническую колбу, перегоняют ацетамид при температуре 210-216 0С. Застывший в приемнике ацетамид нагревают до плавления, переливают в фарфоровую чашку. Выход - 9,6 г (70%); т. пл. 78-81 0С.
Н-Бутилакрилат

Реактивы: метилакрилат – 8,6 г (0,1 моль);
н -бутиловый спирт – 3,7 г (0,1 моль);
п -толуолсульфокислота – 0,1 г;
гидрохинон – 0,2 г
Посуда: двугорлая колба; термометр; механическая мешалка; холодильник Либиха.
В двугорлую колбу на 100 мл, в одно из горл которой вставлена стеклянная трубка с оттянутым капилляром, помещают 3,7 г н -бутилового спирта, 8,6 г метилового эфира акриловой кислоты, 0,2 г гидрохинона и 0,1 г п -толуолсульфокислоты. К колбе елочный дефлегматор, и раствор нагревают на масляной бане до кипения. Колонка работает с закрытым краном и с полным возвратом дистиллята до тех пор, пока температура паров в головке не упадет до 62 – 63 0С, т. е. до температуры кипения азеотропной смеси «метиловый спирт – метиловый эфир акриловой кислоты». Эту азеотропную смесь отгоняют с такой скоростью, с какой она образуется, причем следят за тем, чтобы температура в головке не поднималась выше 65 0С. Когда образование метилового спирта замедлится через 6-10 ч, отгоняют избыток метилового эфира акриловой кислоты, после чего перегоняют бутиловый эфир акриловой кислоты при 39 0С (10 мм рт. ст.). Выход – 5 – 6 г (78 – 94%).
- Шабаров Ю.С. Органическая химия. Учебник для вузов. М.: Химия, 2000.
- Беккер Г., Бергер В. и др. Органикум: Практикум по органической химии. М.: Мир, 1992. Т.1, 453 с. Т.2, 442 с.
- Агрономов А.Е. Избранные главы органической химии. М: Изд-во МГУ, 1975.
- Голодников Г В., Мандельштам Т.В. Практикум по органическому синтезу. Л.: Изд-во ЛГУ, 1976. 373 с.
- Юрьев Ю.К., Левина Р.Я., Шабаров Ю.С. Практические работы по органической химии. Вып. 4. М.: Изд-во МГУ, 1969. 253 с.
- Днепровский А.С., Темникова Т.И. Теоретические основы органической химии. Л.: Химия, 1991.
- Титце Л., Айхер Т. Препаративная органическая химия. М.: Мир, 1999. 704 с.
- Бюлер К., Пирсон Д. Органические синтезы. М.: Мир, 1973. Ч.1, 620 с. Ч.2, 591 с.
- Вейганд - Хильгетаг. Методы эксперимента в органической химии.
М.: Химия, 1968. 944 с.
 2017-11-01
2017-11-01 1220
1220