Основные положения координационной теории: центральный ион-комплексообразователь, лиганды, координационное число. Геометрия координационной сферы, внешнесферные ионы. Природа хим.связи в комплексах (по методу ВС). Номенклатура комплексных соединений. Диссоциация и устойчивость комплексных соединений в растворах. Константа нестойкости.
Типы комплексных соединений. Роль комплексных соединений, гемоглобин и хлорофилл.
13 Химическая идентификация веществ
Вещество и его чистота. Качественный и количественный анализ. Аналитический сигнал и его виды. Химический, физический и физико-химический анализ. Теоретические основы видов анализа: титриметрический, гравиметрический, потенциометрический, рефрактометрический анализ.
Теоретические основы мембранных технологий
Теоретические основы мембранных технологий, современные мембранные материалы. Перспективы развития мембранных технологий.
Основные понятия органической химии
Радикалы, гомологические ряды, функциональные группы. Классификация и номенклатура органических веществ. Реакции полимеризации и поликонденсации как основа синтеза полимеров. Современные полимерные материалы. Полимеры и олигомеры. Пластмассы. Применение полимерных материалов в народном хозяйстве. Основные биохимические процессы, их применение в технологии различных отраслей промышленности.
Список рекомендуемой литературы
Основная:
1 Суворов А. В. Общая химия: учеб. для вузов / А. В. Суворов, А. Б. Никольский. - 5-е изд., испр. - СПб.: Химиздат, 2007. – 622с
2 Глинка Н.Л. Общая химия. М.: Интеграл-Пресс, 2007. 727 с.
3 Глинка Н.Л. Задачи и упражнения по общей химии. М.: Интеграл-Пресс,2002, 2006. 240 с.
Дополнительная:
1.Суворов А.В. Вопросы и задачи по общей химии: Учеб.пособие для вузов.-СПб.:Химиздат, 2002.-304с.
2. Задачи и упражнения по общей химии:Учеб.пособие для вузов/ Б.И. Адамсон, О.Н. Гончарук, В.К. Камышова и др.; Под ред.Н.В.Коровина. ─ 3-е изд.,испр. ─ М.:Высшая школа,2006. ─ 253,[3]с.:ил. ─ Библиогр.:с.255. ─
3. Сергеев Г.Б. Нанохимия: Учеб. пособие для вузов / Г.Б.Сергеев. 2-е изд. М.: Книжный дом "Университет", 2007. 333 с.
4 Коровин Н.В. Общая химия. М.: Высшая школа, 2007. 556 с.
Список методических рекомендаций и методических указаний
1 Кузьмичева В.П., Пчёлина Е.А. Основные классы неорганических соединений. - НовГУ, Новгород, 2007. - 26 с.
2 Кузьмичева В.П. Химическая посуда. – НовГУ, Новгород, 2007. – 6 с.
3 Кузьмичева В.П., Летенкова И.В. Получение солей. – НовГУ, Новгород, 2007. – 14 с.
4 Олисова Г.Н., Ульянова Н.И. Концентрация растворов. Приготовление растворов заданной концентрации. – Новгород, НовГУ, 2007. – 14 с.
5 Кузьмичева В.П., Бойко Е.Н., Летенкова И.В. Электролитическая диссоциация. – НовГУ, Новгород, 2007. – 6 с.
6 Бойко Е.Н., Олисова Г. Н., Ульянова Н. И. Водородный показатель. – НовГУ, Новгород, 2007. – 6 с.
7 Литвинов В.Ф., Летенкова И.В. Гидролиз солей. – НовГУ, Новгород, 2007.
– 12 с.
8 Бойко Е.Н., Олисова Г.Н., Ульянова Н.И. Окислительно-восстановительные реакции. - НовГУ, Новгород, 2007.- 38 с.
9 Бойко Е.Н., Кузьмичёва В. П., Петухова Е.А. Гальванический элемент. Электрохимическая коррозия металлов. – НовГУ, Новгород, 2007. – 9 с.
10 Бойко Е.Н., Кузьмичёва В. П., Петухова Е.А. Электролиз водных растворов электролитов.– НовГУ, Новгород, 2007. – 9 с.
ТЕСТОВЫЕ ЗАДАНИЯ
Экзамен по химии проводится в письменной форме с использованием экзаменационных тестов. Примеры тестовых заданий приведены на следующих страницах.
ОБРАЗЕЦ
1. Сколько протонов и нейтронов содержит ядро атома 88 Sr?
1.38; 50. 2. 50; 38. 3. 50; 50. 4. 88; 88. 5. 38; 38.
2.Атомы каких элементов имеют в основном состоянии на внешнем энергетическом уровне электронную конфигурацию ns1?
l.V,Nb,Ta. 2. Li,Na,K. 3. Al, Ga, In. 4. Cl, Br, I. 5. Mn, Tc, Re.
3. Какова электронная формула атома палладия?
1. [Kr]4d8s2. 2. [Kr]4d9 s1. 3. [Kr]4d10 5s°. 4. [Kr]4d105s2 5p6.
4. С точки зрения принадлежности к электронным семействам металлы бывают:
1.только s-элементами; 2. s- и p- элементами; 3.только d- элементами; 4.только f- элементами;
5.представителями всех четырех электронных семейств.
5. У какого из элементов наиболее сильно выражены неметаллические свойства?
1.А1. 2. Si. 3.S. 4.С1. 5.Mg.
6. Высшая и низшая степени окисления углерода равны, соответственно:
1.+3;-5. 2.+4;-4. 3.+5;-3. 4.+4; 0. 5. 0;-4.
7. Какое из веществ имеет молекулярную структуру?
1.Т аО2. 2. РbО2. З.ВаО2. 4. СО2. 5. SiO2.
8. Какой тип химической связи имеет место в молекуле SiH4?
1.Ионная. 2.Ковалентная полярная.3.Ковалентная неполярная.4.Водородная.5.Металлическая.
9. Атомная кристаллическая решетка может быть охарактеризована следующим образом:
1.В узлах - атомы, связи - ковалентные.
2.В узлах - ионы, связи - ионные.
3.В узлах - катионы, связь - металлическая.
4.В узлах - молекулы, связи - водородные или ван-дер-ваальсовы.
10. На основании приведенных термодинамических данных (∆Gо образования соединений) сделайте вывод, какой неметалл проявляет наибольшую окислительную активность при взаимодействии с магнием:
Мg3N2 MgF2 MgCl2 MgO
∆ Gо298, кДж/моль а)-400 б)-1091 в)-594 г)-567
11. Какой отрезок на диаграмме показывает значение теплового эффекта реакции?
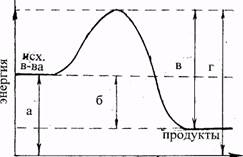
ход реакции
1.а. 2.б. З.в. 4. г.
13. Как можно сместить равновесие вправо в системе
2Р(Т) + ЗН2 (Г) ↔2РН3 (г); ΔН > 0? (Р - давление, Т- температура.)
1.уменьшить концентрацию Н2; 2.уменьшить Т; 3.уменьшить Р; 4.увеличить Р; 6 .у величить концентрацию РН3.
14. Решить задачу
Определите процентную концентрацию 0,9Н раствора фосфата натрия. Плотность раствора 1,06 г/мл.
15. Расположите вещества в порядке убывания силы электролитов:
а) Н2SeO3 Kд = 3,5 ∙ 10∙-3 б) Н2 S2 O3 Kд = 2,2 ∙ 10-1
в) Н2 С O3 Kд = 4,5 ∙ 10-7 г) Н2 Те O4 Kд= 2,3 ∙ 10-8
16. Каким молекулярным уравнениям соответствует сокращенное ионно-молекулярное уравнение:
СН3СОО-+Н+ =СН3СООН
а) NaCH3COO + HNO3 = CH3COOH+NaNO3
б) Ca (CH3COO)2 + H2SO4 = 2CH3COOH + CaSO4
в) K СН3СОО + НCl = CH3COOH + KCl
г) NaCH3COO + H2SO3 + CH3COOH + NaHSO3
17.Как влияет на смещение равновесия добавление сильной кислоты к равновесной системе
HNO2 ↔H+ + NO2-?
а)Равновесие смещается влево, степень диссоциации уменьшается;
б)Равновесие смещается вправо, степень диссоциации уменьшается;
в)Равновесие смещается вправо, степень диссоциации увеличивается;
г)Равновесие смещается влево, степень диссоциации увеличивается.
18. Назовите соединения. Расположите вещества в порядке уменьшения рН их растворов:
а) HCl б) K2S в) Н2S г) КOH
19. Решить задачу:
В 100мл раствора находится 3,65г соляной кислоты. Найти рН раствора.
20. В водном растворе соль Sr(CH3COO)2:
1.подвергается гидролизу только по катиону; 2.подвергается гидролизу только по аниону; 3.подвергается гидролизу по обоим ионам; 4.не подвергается гидролизу.
Для подтверждения напишите уравнение гидролиза, укажите кислотность среды.
21.Решить задачу:
Раствор, содержащий 12 г NaOH в 1000 г Н2О, кипит при 100,28 0С. Определите изотонический коэффициент i (Э=0,516К Кг/моль).
22. В реакции, протекающей по схеме Sn + Н2SO4 —> SnSO4 + S + Н2О,
окисляются и восстанавливаются, соответственно, атомы следующих элементов:
l.Sn,H. 2. Sn, S. З.Н, О. 4. Sn, О. 5. S, Sn.
Ураваняйте реакцию, исползуя метод электронного баланса.
23. При электролизе водного раствора сульфата цинка (катод - угольный,
анод - цинковый) на электродах происходят следующие процессы:
1.на катоде выделяются цинк и водород, на аноде выделяется кислород;
2.на катоде выделяется цинк, на аноде выделяется кислород;
3. на катоде выделяются цинк и водород, анод растворяется;
4.на катоде выделяется водород, на аноде выделяется кислород.
24. Каков состав продуктов коррозии, образующихся при контакте никеля со свинцом в соляной кислоте?
1.РbС12, Н2; 2 Рb(ОН)2; 3. Ni(OH)2. 4. NiС12, Н2. 5. NiС12, О2.
25. Какой из этих металлов можно использовать в качестве катодного
покрытия железа?
1.Zn. 2 Сr. 3. Сu. 4. Mg. 5. А1.
 2017-10-25
2017-10-25 1284
1284
