Найдем вероятность или относительное число молекул, модуль скорости которых заключен в интервале ( ,
,  + d
+ d  ). Таким молекулам соответствуют все точки, попадающие в шаровой слой с радиусами
). Таким молекулам соответствуют все точки, попадающие в шаровой слой с радиусами  и
и  + d
+ d  .
.
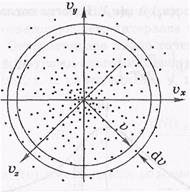
Объем этого слоя равен произведению поверхности слоя на его толщину, т. е. 4π  2d
2d  , объемная же плотность вероятности f(
, объемная же плотность вероятности f( ) во всех точках слоя одинакова.
) во всех точках слоя одинакова.
 Следовательно, согласно теореме сложения вероятностей, вероятность попадания в этот слой
Следовательно, согласно теореме сложения вероятностей, вероятность попадания в этот слой
Величина dP/d  — мы ее обозначим F(
— мы ее обозначим F( ) — характеризует искомую вероятность, т.е.
) — характеризует искомую вероятность, т.е.


Учитывая формулу для f( ), получим:
), получим:
Эта формула представляет собой закон распределения Максвелла по модулю скорости. Вид функции F( ) показан на следующем рисунке.
) показан на следующем рисунке.
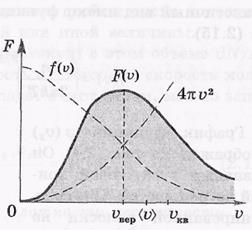
Эта функция тоже нормирована на единицу:

На рисунке пунктиром представлены сомножители функции F( ), один из сомножителей которой f(
), один из сомножителей которой f( ). Площадь под кривой f(
). Площадь под кривой f( ) физического смысла не имеет.
) физического смысла не имеет.
Следует отметить, что полученные Максвеллом распределения по скоростям не зависят ни от структуры молекул, ни от того, как они взаимодействуют друг с другом. Поэтому они применимы не только к газам, но и к другим агрегатным состояниям вещества.
Характерные скорости. К ним относятся три скорости: наиболее вероятная  вер, средняя <
вер, средняя <  > и среднеквадратичная
> и среднеквадратичная  кв.
кв.
Наиболее вероятной скорости соответствует максимум функции распределения F( ). Эта скорость определяется из условия dF/d
). Эта скорость определяется из условия dF/d  = О, откуда следует
= О, откуда следует

Средняя скорость по определению

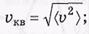
Среднеквадратичная скорость
 она находится из условия
она находится из условия
 откуда следует, что
откуда следует, что
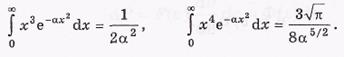 Этот результат можно получить путем интегрирования, используя табличные значения интегралов:
Этот результат можно получить путем интегрирования, используя табличные значения интегралов:
 В качестве примера приведем среднюю скорость молекул азота N2 при Т = 300 К: <v>» 480 м/с. Эта величина имеет порядок скорости звука в азоте, vзв =
В качестве примера приведем среднюю скорость молекул азота N2 при Т = 300 К: <v>» 480 м/с. Эта величина имеет порядок скорости звука в азоте, vзв = 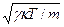 = 350 м/с.
= 350 м/с.
Приведенные характерные скорости отличаются друг от друга в пропорции
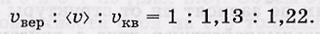
 Зависимость распределения от Т. Подставив значение
Зависимость распределения от Т. Подставив значение  вер и формулу F(
вер и формулу F( ), получим, что
), получим, что
В соответствии с этим результатом для разных температур Т1 < Т2 < Т3 кривые распределения F(v) будут иметь вид, показанный на следующем рисунке.

Видно, что с увеличением Т максимум функции F( ) смещается в сторону больших скоростей, а его величина уменьшается. При этом площадь под всеми тремя кривыми остается равной единице. Кривые на этом рисунке можно рассматривать и иначе — как соответствующие разным массам молекул газа при одной и той же температуре, причем m1 > m2 > m3.
) смещается в сторону больших скоростей, а его величина уменьшается. При этом площадь под всеми тремя кривыми остается равной единице. Кривые на этом рисунке можно рассматривать и иначе — как соответствующие разным массам молекул газа при одной и той же температуре, причем m1 > m2 > m3.
 2017-11-01
2017-11-01 1244
1244
