 Умножив обе части распределения Больцмана на kT, получим давление на высоте z
Умножив обе части распределения Больцмана на kT, получим давление на высоте z
где М — молярная масса, R — универсальная газовая постоянная.
Это так называемая барометрическая формула. Она строго справедлива для идеального газа, температура которого не зависит от высоты (изотермическая атмосфера). На рисунке показаны два графика барометрической формулы при разных температурах: Т2 > Т1.

В отличие от распределений n(z) кривые p(z) на этом рисунке начинаются в одной точке, независимо от температуры.
Явления переноса
Выведенная из состояния равновесия, любая макросистема стремится вернуться в равновесное состояние. При этом растет энтропия, значит этот процесс необратим. Нарушение равновесия сопровождается возникновением потоков или частиц, или тепла, или электрического заряда и др. Соответствующие процессы называют явлениями переноса. Все они являются необратимыми.
Рассмотрим три явления переноса: диффузия, внутреннее трение и теплопроводность (причем в условиях, когда отклонения от равновесия малы). Сначала приведем эмпирические уравнения этих процессов — они применимы к любым средам (газообразным, жидким и твердым). Затем получим молекулярно-кинетический вывод данных уравнений для газов, который позволяет раскрыть содержание коэффициентов, характеризующих соот-ветствующие явления.
|
|
|
В дальнейшем придется использовать понятие потока той или иной физической величины через интересующую нас поверхность S. Напомним, поток — величина скалярная и алгебраическая. Его знак зависит от выбора положительного «направления»; с одной стороны поверхности S к другой или наоборот. Положительное направление обычно выбирают произвольно (за исключением замкнутых поверхностей, где по соглашению его выбирают наружу области, ограниченной этой поверхностью).
Мы будем рассматривать потоки в основном через плоские поверхности S, перпендикулярные оси X, выбирая положительное «направление» поверхности S совпадающим с ортом оси X. Если физическая величина будет переноситься через S в направлении оси X, будем считать соответствующий поток положительным, если же в обратном направлении, то — отрицательным.
Любое явление переноса связано с неодинаковостью в пространстве некоторой величины. Например, поток тепла возникает в случае неодинаковости температуры в разных точках среды. На эту особенность потоков следует обратить внимание. Та же температура — это характеристика системы в целом, а здесь мы говорим, что она разная. Приходится вводить понятие локального равновесия. В состоянии локального равновесия среда в каждой малой части своего объема находится в тепловом равновесии, однако равновесие между различными частями отсутствует.
|
|
|
Под малостью имеют в виду объем, размер которого намного превышает, например, среднее расстояние между соседними молекулами. При этом число частиц в таком объеме должно быть макроскопическим, чтобы можно было применять макроскопические параметры состояния теплового равновесия.
Теперь перейдем к эмпирическим уравнениям процессов переноса.
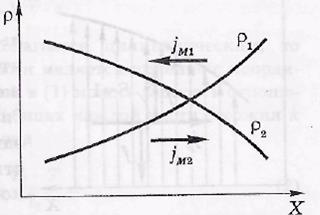 Диффузия. Так называют взаимопроникновение вещества в различных смесях, обусловленное тепловым движением молекул. Пусть смесь содержит две компоненты с парциальными плотностями ρ1 и ρ2. Концентрация каждой компоненты стремится выравняться, возникают потоки массы обеих компонент, направленные в сторону уменьшения их плотностей. Экспериментально было установлено выражение для плотности потока массы i-й компоненты:
Диффузия. Так называют взаимопроникновение вещества в различных смесях, обусловленное тепловым движением молекул. Пусть смесь содержит две компоненты с парциальными плотностями ρ1 и ρ2. Концентрация каждой компоненты стремится выравняться, возникают потоки массы обеих компонент, направленные в сторону уменьшения их плотностей. Экспериментально было установлено выражение для плотности потока массы i-й компоненты:

где D — коэффициент диффузии. Знак минус обусловлен тем, что поток i-й компоненты противоположен производной dρ/dх — ее называют градиентом плотности (см. риcунок).
Внутреннее трение. Из механики известно, что сила трения между двумя слоями жидкости или газа, отнесенная к единице площади поверхности раздела слоев, равна

где  -коэффициент вязкости (вязкость), производная du/dх — градиент скорости — характеризует степень изменения скорости жидкости или газа в направлении оси X, перпендикулярном направлению движения слоев.
-коэффициент вязкости (вязкость), производная du/dх — градиент скорости — характеризует степень изменения скорости жидкости или газа в направлении оси X, перпендикулярном направлению движения слоев.
Согласно 2-му закону Ньютона взаимодействие двух слоев с силой f можно рассматривать как процесс передачи в единицу времени импульса. Тогда предыдущее уравнение можно представить так

где jp — импульс, передаваемый ежесекундно от слоя к слою через единицу площади поверхности, т. е. плотность потока импульса. Знак минус обусловлен тем, что поток импульса противоположен по направлению градиенту du/dх. На следующем рисунке показаны силы, действующие в плоскости площадки S:

 левая f — сила, с которой действуют слои справа от площадки S (они движутся в дан
левая f — сила, с которой действуют слои справа от площадки S (они движутся в дан  ном случае быстрее), правая f — сила, с которой действуют слои слева от S. Эти силы взаимно противоположны и одинаковы по модулю. Вопрос, куда действует сила в плоскости S, не имеет смысла, пока не указано, со стороны каких слоев на какие.
ном случае быстрее), правая f — сила, с которой действуют слои слева от S. Эти силы взаимно противоположны и одинаковы по модулю. Вопрос, куда действует сила в плоскости S, не имеет смысла, пока не указано, со стороны каких слоев на какие.
Теплопроводность. Опыт показывает, что если в среде создать вдоль оси градиент температуры dТ/dх, то возникает поток тепла, плотность которого

где  - коэффициент теплопроводности (теплопроводность). Знак минус стоит по той же причине: плотность потока противоположна по направлению градиенту dТ/dх.
- коэффициент теплопроводности (теплопроводность). Знак минус стоит по той же причине: плотность потока противоположна по направлению градиенту dТ/dх.
Молекулярно-кинетическая интерпретация явлений переноса
Рассмотрим явления переноса в газах с молекулярно-кинетической точки зрения.
Ввиду полной хаотичности теплового движения молекул будем считать, что молекулы движутся по трем направлениям X, Y и Z, так что на каждое направление в одну сторону плотность потока молекул составляет
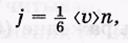
где п — концентрация молекул. Эти потоки и являются переносчиками определенных физических величин G. Плотность потока величины G будем обозначать JG.
Далее будем считать, что через интересующую нас площадку S молекулы будут переносить то значение величины G, которое они имели на расстоянии λ, от площадки S. Т. е. будем предполагать, что последнее соударение молекулы испытывают на этом расстоянии от S.
Общее уравнение переноса. Пусть величина G характеризует определенное молекулярное свойство, отнесенное к одной молекуле. Это может быть энергия, импульс, электрический заряд и др. Ясно, что при наличии градиента величины G должен возникнуть поток в сторону ее уменьшения.
Пусть величина G меняется только в направлении оси X, например, так, как показано на рисунке
|
|
|

 Площадку S будут пронизывать молекулы, движущиеся во встречных направлениях, их плотности потоков обозначим j' и j". Причем
Площадку S будут пронизывать молекулы, движущиеся во встречных направлениях, их плотности потоков обозначим j' и j". Причем
они должны быть равны друг другу (j' = j"), чтобы не возникало газодинамических потоков и чтобы все процессы сводились только к переносу величины G. Тогда для результирующей плотности потока величины G можно записать:
Благодаря малости λ разность значений G"- G' представим в виде

С учетом этой формулы выражение для JG. запишем так:
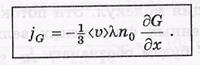
Это и есть общее уравнение переноса для любой величины G. Здесь по — концентрация молекул, <  > — их средняя тепловая скорость. Значения этих величин берутся в сечении S.
> — их средняя тепловая скорость. Значения этих величин берутся в сечении S.
Применим это уравнение к трем наиболее интересным явлениям переноса, связанным с диффузией, вязкостью и теплопроводностью.
Диффузия. Ограничимся рассмотрением самодиффузии, т. е. процессом перемешивания (взаимопроникновения) молекул одного сорта. Макроскопически самодиффузию наблюдать нельзя: из-за тождественности молекул она не может проявляться ни в одном явлении. Для наблюдения этого процесса часть молекул газа надо как-то «пометить». Практически это можно сделать с помощью так называемых «меченых» атомов: смесь газов берут из двух изотопов одного и того же элемента, один из которых радиоактивен. Тогда процесс диффузии можно наблюдать, регистрируя радиоактивное излучение радиоизотопа. Можно также взять смесь двух различных газов, молекулы которых почти одинаковы по массе и размерам (такие, например, как N2 и СО). В этом случае у обеих компонент газа будут одинаковы как средние скорости, так и длины свободного пробега, т. е. <v> и λ.
 Чтобы отсутствовали газокинетические потоки b перемешивание молекул происходило только за счет диффузии, необходимо (так мы и будем считать), чтобы суммарная концентрация п0 обеих компонент смеси не зависела от координаты в направлении оси X, вдоль которой происходит этот процесс (рисунок).
Чтобы отсутствовали газокинетические потоки b перемешивание молекул происходило только за счет диффузии, необходимо (так мы и будем считать), чтобы суммарная концентрация п0 обеих компонент смеси не зависела от координаты в направлении оси X, вдоль которой происходит этот процесс (рисунок).
Пусть концентрация молекул 1-го сорта зависит от координаты х как n1(x). Учитывая,что величина G есть характеристика переносимого количества, отнесенного к одной молекуле, имеем
|
|
|

 где п0 — равновесная концентрация. Тогда общее уравнение переноса примет вид
где п0 — равновесная концентрация. Тогда общее уравнение переноса примет вид
Сравнив это выражение с эмпирической формулой для плотности потока массы, находим, что коэффициент самодиффузии

Единицей измерения коэффициента D является м2/с. При нормальных условиях коэффициент D для кислорода и азота в воздухе имеет порядок 10-5 м2/с.
Мы ограничимся рассмотрением самодиффузии, поскольку взаимная диффузия разных газов требует весьма громоздких преобразований, но принципиально нового ничего не дает.
Вязкость (внутреннее трение). Это явление возникает в техслучаях, когда на хаотическое тепловое движение молекул накладывается упорядоченное движение.
 Пусть скорость u упорядоченного движения зависит только от координаты х, как показано на рисунке
Пусть скорость u упорядоченного движения зависит только от координаты х, как показано на рисунке
В этом случае через единичную площадку S будет происходить перенос импульса р = mu, где m —масса молекулы. Это значит, что в
данном случае величина G = р и плотность потока импульса

где ρ = mп0 — плотность газа. Сопоставив это уравнение с эмпирической формулой, находим выражение для вязкости:
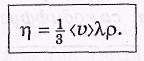
Более точный расчет дает несколько большее значение для числового коэффициента: не 1/3, а 0,49.Единицей вязкости в СИ является паскаль-секунда (Па-с), а в системе СГС — пуаз (П). Связь между ними: 1 Па-с = 10 П.
При нормальных условиях вязкость газов  - 10-5 Па-с.
- 10-5 Па-с.
 Теплопроводность. В этом явлении величиной G является средняя энергия теплового движения, приходящаяся на одну молекулу. Из теоремы о равнораспределении энергии по степеням свободы имеем G = (i/2)kT, и тогда плотность потока тепла
Теплопроводность. В этом явлении величиной G является средняя энергия теплового движения, приходящаяся на одну молекулу. Из теоремы о равнораспределении энергии по степеням свободы имеем G = (i/2)kT, и тогда плотность потока тепла
Для упрощения этой формулы введем удельную теплоемкость cv. Для этого обратим внимание на то, что (i/2)k — это теплоемкость при постоянном объеме, рассчитанная на одну молекулу. Произведение данной величины на концентрацию п0 дает теплоемкость единицы массы cv, умноженную на плотность газа ρ. Таким образом, учитывая, что (i/2)k-n0 = cvρ,


 Из сравнения этого выражения с эмпирической формулой получим, что теплопроводность
Из сравнения этого выражения с эмпирической формулой получим, что теплопроводность

где c v — удельная теплоемкость, отнесенная к единице массы, Дж/К۰кг).
Единицей теплопроводности является Вт/(м۰К).
При заданной концентрации п0 теплопроводность зависит в основном от средней скорости <  > Из-за этого легкие газы обладают значительно большей теплопроводностью, чем тяжелые, поскольку <
> Из-за этого легкие газы обладают значительно большей теплопроводностью, чем тяжелые, поскольку <  > ~ 1/
> ~ 1/  . Например, при нормальных условиях кислород имеет теплопроводность 0,024 Вт/(м۰К), а водород — 0,176 Вт/м۰К).
. Например, при нормальных условиях кислород имеет теплопроводность 0,024 Вт/(м۰К), а водород — 0,176 Вт/м۰К).
Анализ коэффициентов переноса. Прежде всего выпишем для удобства сопоставления и анализа все три коэффициента рассмотренных явлений переноса:

1. Определив по эмпирическим формулам коэффициенты D,  и
и  , мы имеем возможность вычислить
, мы имеем возможность вычислить  и диаметр d молекул.
и диаметр d молекул.
2.Все три коэффициента, D,  и
и  , с ростом температуры Т увеличиваются, так как <
, с ростом температуры Т увеличиваются, так как <  >~
>~  .
.
3.Поскольку  ~ 1/ п, а п ~ ρ, то как вязкость
~ 1/ п, а п ~ ρ, то как вязкость  , так и теплопроводность
, так и теплопроводность  не зависят от концентрации, а значит и от давления (при неизменной температуре).
не зависят от концентрации, а значит и от давления (при неизменной температуре).
Уравнения переноса, зависящие от времени. Приведенные выше расчеты и результаты относятся к так называемым стационарным задачам, когда распределение интересующей нас величины G зависит только от координат. Но процессы переноса (выравнивания величины G) зависят и от времени. Это обстоятельство приводит к необходимости решать нестационарные задачи, учитывающие зависимость величины G как от координат, так и от времени. В качестве примера приведем соответствующее одномерное дифференциальное уравнение для теплопроводности:

Для решения подобных уравнений необходимо знать начальные и граничные условия. Если они заданы и известен коэффициент  , то задача является чисто математической, ее решение подробно рассматривается в курсе математической физики.
, то задача является чисто математической, ее решение подробно рассматривается в курсе математической физики.
Реальный газ
Уравнение Ван-дер-Ваальса. При увеличении давления (при Т = const) оказывается, что pV  RТ. При р = 1000 атм произведение pV становится вдвое больше, чем предписывает модель идеального газа (газ не «сжимается»).
RТ. При р = 1000 атм произведение pV становится вдвое больше, чем предписывает модель идеального газа (газ не «сжимается»).
Причин этому две:
собственный размер молекул; он и уменьшает объем, доступный для движения молекул, при нормальных условиях он составляет ~ 0,07 % объема сосуда с газом, а при 100атм уже 70%; сложный характер взаимодействия между молекулами.
Типичная кривая зависимости энергии взаимодействия UB3 от расстояния r между их центрами приведена на рисунке. На малых расстояниях (г < г0) молекулы отталкиваются, на больших (г > г0) притягиваются.

Эти причины можно учесть путем введения поправок в уравнение состояния идеальных газов, что и выполнил Ван-дер-Ваальс.В результате уравнение состояния одного моля реального газа приняло вид

 Это и есть уравнение Ван-дер-Ваальса. Здесь а и b — постоянные Ван-дер-Ваальса, для разных газов они имеют свои значения.
Это и есть уравнение Ван-дер-Ваальса. Здесь а и b — постоянные Ван-дер-Ваальса, для разных газов они имеют свои значения.
Если мы имеем дело не с одним, а с  молями газа объемом V, то в уравнении вместо объема одного моля VM,следует подставить V /
молями газа объемом V, то в уравнении вместо объема одного моля VM,следует подставить V /  .
.
Поправка в первой скобке,  , обусловлена силами притяжения между молекулами. Она имеет размерность давления, и ее иногда называют внутренним давлением. На стенку сосуда такой газ оказывает давление р. Однако, если бы силы притяжения между молекулами мгновенно исчезли, то давление на стенку стало бы p + a /V2M. т. е. при переходе от идеального газа к реальному давление на стенку уменьшается — из-за сил притяжения между молекулами.
, обусловлена силами притяжения между молекулами. Она имеет размерность давления, и ее иногда называют внутренним давлением. На стенку сосуда такой газ оказывает давление р. Однако, если бы силы притяжения между молекулами мгновенно исчезли, то давление на стенку стало бы p + a /V2M. т. е. при переходе от идеального газа к реальному давление на стенку уменьшается — из-за сил притяжения между молекулами.
Поправка b связана с собственным объемом молекул, ее размерность м3/моль.
Газ, подчиняющийся данному уравнению называют ван-дер-ваальсовским.
Энергия ван-дер-ваальсовского газа. Внутренняя энергия такого газа U = К + Uвз, где К — суммарная кинетическая энергия молекул, Uвз — суммарная энергия взаимодействий молекул (собственная потенциальная энергия). Сначала найдем Uвз. Для этого воспользуемся тем, что работа сил притяжения равна убыли энергии Uвз: dA = - dUвз. Силы притяжения характеризуются внутренним давлением pi = a / V2. Тогда элементарная работа этих сил d'A =- pidV, где знак минус обусловлен тем, что при расширении газа (dV > 0) работа d'A должна быть отрицательной, т.е. d'A < 0. Итак,
 -
-
 Мы представили d'A как убыль некоторой величины — она и является энергией Uвз:
Мы представили d'A как убыль некоторой величины — она и является энергией Uвз:
Константа, которую здесь следовало бы добавить, несущественна. Поэтому мы сразу же положили ее равной нулю. Получается естественный результат: при V→ 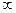 Uвз→ 0.
Uвз→ 0.
Суммарная кинетическая энергия К зависит от поступательного и внутреннего движений молекул, и определяется как CVT
Таким образом, внутренняя энергия моля ван-дер-ваальсовского газа

где CV =(i/2)R.
Если газ расширяется в пустоту без теплообмена с окружающими телами, то А = 0, Q = 0, и согласно первому началу в этом процессе U = const. Значит, с ростом объема температура газа уменьшается (в отличие от идеального газа).
Это можно представить и наглядно на рисунке. Видно, что при расширении газа (увеличении объема V) в случае U = const суммарная кинетическая энергия молекул газа, а значит и температура Т, уменьшается. Газ охлаждается.

Эффект Джоуля—Томсона. Исследования Джоуля и Томсона позволили не только экспериментально подтвердить зависимость внутренней энергии реального газа от его объема. Было открыто важное физическое явление, получившее название эффекта Джоуля-Томсона.
В их опытах использовалась теплоизолированная трубка, в середине которой помещалась пористая перегородка N.

Исследуемый газ под действием перепада давлений (p1>p2) медленно протекал через перегородку. Благодаря медленности течения кинетическая энергия газа как целого практически не менялась. В этих условиях газ в каждый момент по обе стороны перегородки находился в термодинамически равно
весных состояниях. Теплоизолированность трубки делала процесс течения адиабатическим. Давления газа по обе стороны перегородки (p1 и р2) поддерживались постоянными.
При стационарном течении с одной стороны перегородки устанавливалась постоянная температура Т1, а с другой стороны — Т2. Эти температуры и измерялись в опытах. Изменение температуры — приращение  T — при таком течении и называют эффектом Джоуля-Томсона.
T — при таком течении и называют эффектом Джоуля-Томсона.
Сначала попытаемся выяснить, что можно ожидать относительно  T. Для этого мысленно выделим слева от перегородки объем V1 моля газа. После прохождения через перегородку эта порция газа займет объем V2. Согласно 1-му началу термодинамики с учетом того, что в этом процессе Q = 0, приращение внутренней энергии
T. Для этого мысленно выделим слева от перегородки объем V1 моля газа. После прохождения через перегородку эта порция газа займет объем V2. Согласно 1-му началу термодинамики с учетом того, что в этом процессе Q = 0, приращение внутренней энергии  U данной порции газа равно работе А' внешних сил:
U данной порции газа равно работе А' внешних сил:

 При малом перепаде давлений
При малом перепаде давлений
где  U вз — приращение энергии взаимодействия моля молекул газа. Имея в виду, что
U вз — приращение энергии взаимодействия моля молекул газа. Имея в виду, что  U = А', получим из двух предыдущих формул, что
U = А', получим из двух предыдущих формул, что

Из этой формулы следует, что эффект (знак  T) зависит от соотношения между приращением внутренней энергии
T) зависит от соотношения между приращением внутренней энергии  U, равной работе
U, равной работе
внешних сил, и приращением энергии взаимодействия  Uвз. Это поясняет рисунок,
Uвз. Это поясняет рисунок,

где величина вертикального отрезка характеризует собственную кинетическую энергию газа К, а значит и температуру Т. В частности, если  U =
U =  Uвз, то
Uвз, то  T = 0.
T = 0.
Довольно громоздкий расчет дает возможность найти зависимость давления р1 от Т1 при которых эффект ( T) равен нулю. Соответствующая зависимость р1(T1) — ее называют кривой инверсии — показана на рисунке.
T) равен нулю. Соответствующая зависимость р1(T1) — ее называют кривой инверсии — показана на рисунке.

Начальные состояния (р1Т1) под кривой инверсии приводят к положительному эффекту Джоуля-Томсона, т. е. к охлаждению газа ( T < 0), Кривая инверсии не является универсальной, она своя для каждого газа, поскольку расчетная формула для
T < 0), Кривая инверсии не является универсальной, она своя для каждого газа, поскольку расчетная формула для  T зависит от постоянных а и b Ван-дер-Ваальса.
T зависит от постоянных а и b Ван-дер-Ваальса.
Температура. Это величина, характеризующая состояние термодинамического равновесия макросистемы. Если при установлении теплового контакта между телами одно из тел передает энергию другому посредством теплопередачи, то считают, что первое тело имеет большую температуру, чем второе.
Любой метод измерения температуры требует установления температурной шкалы. Для этого используют некоторые особые точки. По международному соглашению температурную шкалу строят по одной реперной точке, так называемой тройной точке воды (Ттр). В термодинамической шкале температур (шкале Кельвина) принимается по определению, что
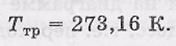
При таком значении Ттр интервал между точками плавления льда и кипения воды практически равен 100 кельвин, и температуры этих точек равны приближенно 273,15 и 373,15 К. Напомним, 1 К = 1°С. Температура t по шкале Цельсия связана с температурой по шкале Кельвина равенством

Температуру Т = 0 называют абсолютным нулем, ему соответствует t = -273,15 °С.
Состояние системы. Состояние макросистемы характеризуют величинами, которые называют термодинамическими параметрами (давление р, объем V, температура Т и др.). Если эти параметры имеют определенные и постоянные значения для любой части макросистемы, то ее состояние называют равновесным. Будучи выведена из состояния равновесия (система становится неравновесной), система в дальнейшем возвращается в равновесное состояние. Это происходит за время, равное по порядку величины времени релаксации (т). Так называют время, за которое первоначальное отклонение какого-либо параметра состояния уменьшается в е раз. Для каждого параметра состояния время т имеет свое значение. Решающую роль играет то т, которое является наибольшим. Его и считают за время релаксации системы.
Таким образом, состояние системы является равновесным, если все параметры ее имеют определенные и постоянные значения при неизменных внешних условиях.
Равновесное состояние можно представить точкой в пространстве, по координатным осям которого откладываются значения параметров состояния. Если независимыми являются всего две переменные (например, р и V), то равновесное состояние изображают точкой на диаграмме р, V.
Процесс. Любой процесс, т.е. переход системы из одного состояния в другое (происходящий, например, благодаря внешнему воздействию) проходит, вообще говоря, через последовательность неравновесных состояний. Но
если такое воздействие осуществляется
достаточно медленно, то можно сказать, что процесс проходит через последовательность равновесных состояний. Такой процесс называют равновесным или квазистатическим. Он
может быть изображен, например, на
диаграмме р, V соответствующей кривой.
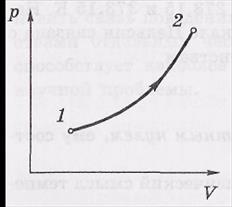
Направление процесса показывают стрелкой.
Неравновесные процессы мы будем условно изображать пунктирными кривыми.
Равновесный процесс может быть проведен в обратном направлении через ту же совокупность равновесных состояний, т. е. по той же кривой 1→2, но в обратном направлении 2→1. По этой причине равновесные процессы называют обратимыми.
 2017-11-01
2017-11-01 2062
2062
