Спирты до С10 при комнатной температуре – жидкости (плотности менее 1г/мл), С11 и выше - твердые вещества. Спирты С1-С3 смешиваются с водой в любых соотношениях и имеют характерный запах. С увеличением молекулярной массы растворимость жидких спиртов уменьшается, а их запах становится неприятным. Твердые спирты – вещества без запаха, не растворяются в воде.
Спирты нормального строения кипят при более высокой температуре, чем спирты с разветвленной цепью. При переходе первичный → вторичный →третичный спирт температура кипения уменьшается.
Температуры кипения спиртов значительно выше температур кипения соответствующих углеводородов и даже галогенопроизводных. Так, этан кипит при –68 ˚С, хлорэтан – при 12 ˚С, а этанол – при 78 ˚С. Это различие объясняется высокой полярностью ОН группы, которая приводит образованию водородных связей и ассоциации молекул спирта.
 |
Низшие гликоли и глицерин - сиропообразные бесцветние жидкости без запаха, очень хорошо растворимы в воде, обладают сладким вкусом. Плотность простейших гликолей и глицерина больше 1г/мл. Высшие гликоли – бесцветные кристаллические вещества. Высшие полиолы (пентиты, гекситы) - также бесцветные кристаллические вещества, они обладают сладким вкусом.
Спирты обладают сильным физиологическим действием. Метанол – яд.
Низшие одноатомные спирты обладают наркотическим действием.
Фенолы – бесцветные низкоплавкие кристаллические вещества с характерным запахом карболки, в воде растворяются значительно хуже, чем спирты. С ростом числа гидроксильных групп растворимость в воде повышается. Фенолы неустойчивы при хранении, легко окисляются.
Фенолы ядовиты, сброс фенолов в природные водоемы наносит непоправимый ущерб живой природе.
Способы получения гидроксипроизводных
Спирты
1. Гидролиз моногалогенопроизводных водными растворами щелочей.
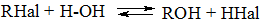 |
Гидролиз моногалогенопроизводных – обратимый процесс.
Hal = CI, Br, I
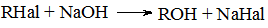 |
Щелочи ускоряют этот процесс и, связывая образующуюся кислоту, делают реакцию необратимой.
2. Действие воды на этиленовые углеводороды.
Реакция протекает при нагревании алкенов с водой обязательно в присутствии катализаторов: серной кислоты, хлорида цинка и др. При гидратации этилена образуется этанол –первичный спирт.
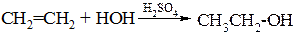 |
Присоединением воды к алкенам можно получать и другие спирты. Реакция протекает по правилу Марковникова. Так присоединением воды к пропилену получают пропанол-2 (вторичный спирт):
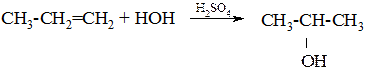
3. Восстановление альдегидов и кетонов в присутствии Ni, Cu, Pt, Pd. Восстановлением альдегидов получают первичные спирты, а кетонов – вторичные.
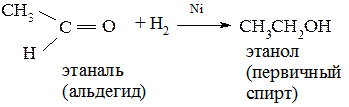
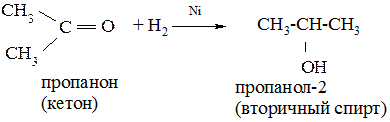
4.Синтез спиртов с использованием реактивов Гриньяра.
Имеет большое значение в лабораторной практике для получения спиртов с более сложным строением скелета, чем у исходных альдегидов и кетонов.
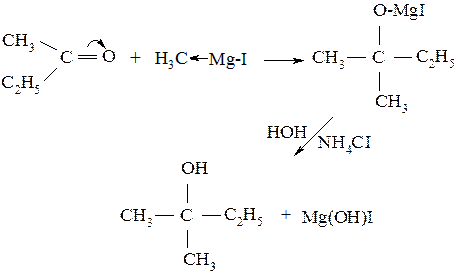
Благодаря поляризации в карбонильной группе у атома углерода возникает дробный положительный заряд, а у атома кислорода - дробный отрицательный заряд. В магнийгалогеналкиле R-MgI остаток R ведет себя как нуклеофильная частица. Она легко присоединяется к атому углерода карбонильной группы. Образующийся магниййодалкоголят подвергается гидролизу, образуя спирт.
Варьируя заместители у атома углерода карбонильной группы можно получать спирты с различным скелетом. Так, из формальдегида получают первичные спирты, из других альдегидов – вторичные, а из кетонов – третичные.
4. Сбраживание растительного сырья, содержащего крахмал.
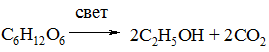 |
Общее уравнение превращения сахаров в этанол:
5. Нагревание под давлением СO и Н2 в присутствии катализаторов.
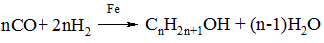
Гликоли. Полиолы
1. Синтез гликолей гидролизом вицинальных дигалогенопроизводных или хлоргидринов:
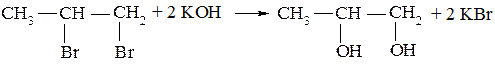
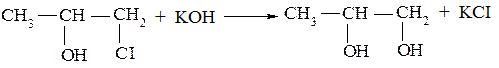
Другие двухатомные спирты получают аналогично из дигалогенопроизводных.
2. Окисление алкенов в мягких условиях (по Вагнеру)
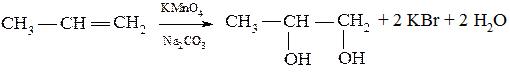
3. Гидратация окиси этилена
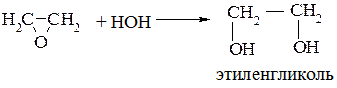
4. Синтез глицерина щелочным гидролизом жиров.
Гидролиз жиров в щелочной среде можно изобразить следующей общей схемой:
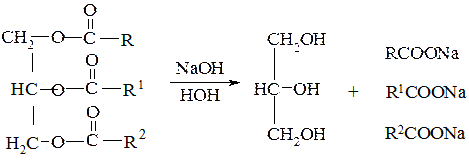
R, R1, R2 – остатки высших карбоновых кислот
Фенолы
1. Из каменноугольного дегтя (фракция 160 – 230 ºС содержит фенол и крезолы).
2. Сплавление солей сульфокислот со щелочами (t = 320 - 350ºС)
С6H5SO3Na + 2 NaOH → C6H5ONa +Na2SO4 + H2O
Метод позволяет получать фенолы с выходами до 70%.
3. Гидролиз арилгалогенидов
Атомы галогена, связанные с бензольным кольцом являются малоподвижными в силу p π-сопряжения, поэтому процесс ведут в присутствии солей меди в автоклаве при 250 ºС.
4. Кумольный метод
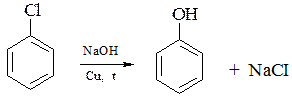 |
(Окисление изопропилбензола с последующим
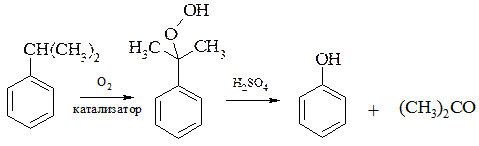 |
кислотным разложением гидроперекиси кумола)
Преимущество данного способа получения заключается в том, что он дает возможность получать не только фенол, но и другой ценный продукт – ацетон.
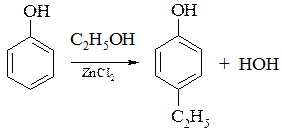 |
5. Гомологи бензола (наряду с описанными выше общими методами 2, 3) часто получают алкилированием фенола спиртами в присутствии ZnCI2
 2020-09-24
2020-09-24 456
456








