Основным структурным элементом, определяющим реакционную способность, является OH-группа, но ее свойства в свою очередь зависят от характера связи С–ОН. Несмотря на определенное сходство, спирты и фенолы существенно отличаются друг от друга. Кислотность фенолов значительно выше, чем у спиртов, а основность (нуклеофильность), на несколько порядков ниже. Для фенолов совсем не идут, а для спиртов характерны реакции с минеральными кислотами (SN1), дегидратации и дегидрирования. По-разному происходит окисление спиртов и фенолов; резко отличаются по механизму и направлению реакции их углеводородных радикалов.
Реакции, идущие с участием атома водорода гидроксильной группы
Кислотные свойства
Спирты являются очень слабыми кислотами (рКа спиртов равно 18, а рКа воды = 16). Таким образом, спирты, как кислоты, в 100 раз слабее, чем вода. Это объясняется тем, что алкоксид-ион, образующийся при диссоциации спирта, содержит на атоме кислорода большую электронную плотность по сравнению с гидроксид-ионом.
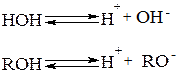
Электроноакцепторные заместители способствуют делокализации отрицательного заряда в алкоксид-ионе и повышают кислотность спирта. Электронодонорные заместители оказавают прямо противоположное действие и понижают кислотность спирта.
Установлено, что первичные спирты как кислоты сильнее вторичных, а вторичные - сильнее третичных. Одной из главных причин этого является пространственные затруднения, создаваемые алкильной группой при сольватации. В газовой фазе, где роль сольватации несущественна, порядок кислотности является обратным порядку кислотности в растворе.
Спирты, как кислоты, реагируют со щелочными металлами, образуя алкоголяты.
2 ROH + 2 Na → 2 RONa + H2
Алкоголяты – твердые вещества, легко растворимые в спирте. Алкоголяты натрия – нестойкие соединения, осмоляются на воздухе, особенно при нагревании. Наиболее устойчив метилат натрия. В присутствии следов влаги алкоголяты натрия легко разлагаются, и вновь образуют спирт.
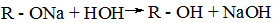
Этилат, метилат натрия, трет -бутилат калия широко используются в органическом синтезе.
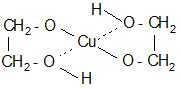 |
Гликоли обладают большей кислотностью, чем одноатомные спирты (для этиленгликоля p K a=14,8). Особенно легко идет замещение атома водорода на ионы тяжелых металлов в результате образования хелатных соединений
Хелаты ярко окрашены. Обычно они не могут быть выделены из-за малой устойчивости, однако, эта реакция используется при качественном определении гликолей.
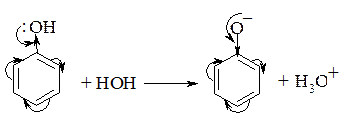 |
Фенолы имеют более ярко выраженные кислотные свойства, р Ка фенола =10. Это означает, что фенол и HCN имеют одинаковые кислотные свойства. Более сильная кислотность фенола в сравнению со спиртами (его еще называют карболовой кислотой) обусловлена устойчивостью сопряженного фенолят-аниона.
Введение в орто- и пара- положения электроноакцепторов способствует делокализации отрицательного заряда в фенолят анионе и повышает кислотные свойства фенола. Так, например, пикриновая кислота С6Н2(NO2)3OH по силе приближается к фосфорной кислоте. Введение же электронодонорных заместителей в о- и п -положения понижает кислотность фенола.
Фенолы в отличие от спиртов в обычных условиях реагируют со щелочами, образуя феноляты.
С6H5OH + NaOH → С6H5ONa + H2O
Фенолы выделяются из растворов фенолятов угольной кислотой.
С6H5ONa + СО2 + H2O →С6H5OH + NaНСО3
Две последние реакции используются для отделения фенолов от спиртов и карбоновых кислот.
 2020-09-24
2020-09-24 772
772








