Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях.
Прочность (напряженность) циклов зависит от числа атомов, участвовавших в кольце и эта закономерность объяснена теорией напряжения Адольфа Байера (1835-1917).
Прочность цикла определяется его степенью напряженности, обусловленной изменением валентных углов образующих его атомов и отклонением связей этих атомов от нормального направления.
В кольце циклопропана все образующие его атомы лежат в одной плоскости и углы между направлениями валентных связей равны 60о (как в правильном треугольнике). В циклобутане эти углы равны 90о (как в правильном четырехугольнике), а в циклопентане 108о (как в правильном пятиугольнике). Так как нормальный валентный угол атома углерода равен 109о 28’, можно вычислить величину уменьшения валентных углов атомов углерода, образующих названные циклы. Эта величина составляет:
у циклопропана 109о 28’ – 60о = 49о 28’

у циклобутана 109о 28’ – 90о = 19о 28’
у циклопентана 109о 28’ – 108о = 1о 28’
Так как при уменьшении валентного угла от нормального направления отклоняют-ся обе образующие его валентности, можно, разделив на 2 полученные выше разности, рассчитать величину угла отклонения каждой валентной связи. Она составляет:
у циклопропана 49о 28’ : 2 = 24о 44’
у циклобутана 19о 28’: 2 = 9о 44’
у циклопентана 1о 28’ : 2 = 0о 44’
Наибольшее отклонение валентных связей претерпевают атомы углерода в трехчленном кольце циклопропана; меньшее, но все же значительное – в четырехчленном кольце циклобутана. В пятичленном кольце циклопентана отклонение каждой валентной связи очень невелико. Поэтому кольца циклопропана и циклобутана сильно напряжены и непрочны. В реакции они сравнительно легко разрываются, образуя соединения с открытой цепью. Кольцо циклопентана напряжено незначительно и поэтому прочно.
Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения.
1. Гидрирование. При каталитическом гидрировании трех-,четырех- и пятичленные циклы разрываются с образованием алканов
С3Н6 + H2 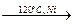 C3H8
C3H8
циклопропан пропан
С5Н10 + H2 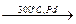 C5H12
C5H12
циклопентан пентан
2. Галогенирование. Трехчленный цикл при галогенировании разрывается, присоединяя атомы галогена
С3Н6 + Br2  BrCH2–CH2–CH2Br
BrCH2–CH2–CH2Br
циклопропан 1,3- дибромпропан
Циклопарафины с пяти- и шестичленными циклами вступают при галогенировании в обычные для парафинов реакции замещения
С5Н10 + Cℓ2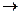 С5Н9Сℓ + HCℓ
С5Н9Сℓ + HCℓ
циклопентан хлорциклопентан
4. Гидрогалогенирование. Циклопропан и его гомологи взаимодействуют с галогеноводородами с разрывом цикла

 СН – СН3
СН – СН3
+ HBr → CH3- CH2 – CH – CH3
 Н2С СН2 |
Н2С СН2 |
Br
метилциклопропан 2-бромбутан
Реакция осуществляется в соответствии с правилом Владимира Васильевича Марковникова (1837-1904): водород присоединяется к наиболее гидрогенизированному атому углерода. Другие циклопарафины с галогеноводородами не реагируют.
4. Дегидрирование. Соединения с шестичленными циклами при нагревании с катализаторами дегидрируются с образованием ароматических углеводородов
С6Н12 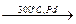 С6Н6
С6Н6 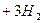
циклогексан бензол
5. Окисление. Несмотря на устойчивость циклопарафинов к окислителям в обыч-ных условиях, при нагревании сильные окислители превращают их в двухосновные карбоновые кислоты с тем же числом углеродных атомов.
Диеновые углеводороды (алкадиены)
Это непредельные углеводороды, содержащие две двойные углерод - углеродные связи. Общая формула алкадиенов CnH2n-2. В зависимости от взаимного расположения двойных связей диены подразделяются на три типа:
1) углеводороды с кумулированными двойными связями, то есть примыкающими к одному атому углерода. Например, пропадиен или аллен CH2=C=CH2;
2) углеводороды с изолированными двойными связями, то есть разделенными двумя и более простыми связями. Например, пентадиен -1,4 CH2=CH–CH2–CH=CH2;
3) углеводороды с сопряженными двойными связями, то есть разделенными одной простой связью. Например, бутадиен -1,3 или дивинил CH2=CH–CH=CH2, 2-метилбутадиен -1,3 или изопрен
| CH= С –CH=CH2. | CH3 |
Наибольший интерес представляют углеводороды с сопряженными двойными связями.
1. Получение
1. Дегидрирование алканов, содержащихся в природном газе и газах нефтепереработки, при пропускании их над нагретым катализатором
CH3–CH2–CH2–CH3 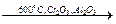 CH2=CH–CH=CH2 + 2H2↑
CH2=CH–CH=CH2 + 2H2↑

2. Дегидрирование и дегидратация этилового спирта при пропускании паров спирта над нагретыми катализаторами (метод акад. Сергея Васильевича Лебедева (1874-1934))
2CH3CH2OH 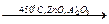 CH2=CH–CH=CH2 + 2H2O + H2↑
CH2=CH–CH=CH2 + 2H2O + H2↑
2. Химические свойства
Атомы углерода в молекуле бутадиена-1,3 находятся в sp2 - гибридном состоянии, молекула бутадиена -1,3 характеризуется системой сопряженных двойных связей (рис.).
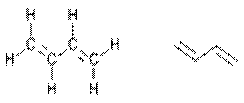
Рис. Строение молекулы бутадиена-1,3
Такая особенность в строении диеновых углеводородов делает их способными присоединять различные реагенты не только к соседним углеродным атомам (1,2- присоединение), но и к двум концам сопряженной системы (1,4- присоединение) с образованием двойной связи между вторым и третьим углеродными атомами. Отметим, что очень часто продукт 1,4- присоединения является основным.
Рассмотрим реакции галогенирования и гидрогалогенирования сопряженных диенов.
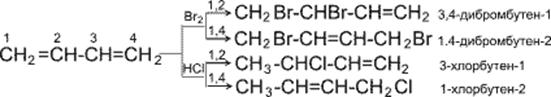 |
 2014-02-02
2014-02-02 1428
1428








