По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Это объясняется особенностями строения бензольного кольца. Делока-лизация шести π-электронов в циклической системе понижает энергию молекулы, что обусловливает повышенную устойчивость (ароматичность) бензола и его гомологов.
Поэтому арены не склонны вступать в реакции присоединения или окисления, которые ведут к нарушению ароматичности. Для них наиболее характерны реакции, идущие с сохранением ароматической системы, а именно, реакции замещения атомов водорода, связанных с циклом. Наличие областей повышенной π-электронной плотности с двух сторон плоского ароматического цикла ведет к тому, что бензольное кольцо является нуклеофилом и в связи с этим склонно подвергаться атаке электрофильным реагентом. Таким образом, для ароматических соединений наиболее типичны реакции электро-фильного замещения. Другие реакции (присоединение, окисление) идут с трудом:
1. Галогенирование. Замещение атома водорода в бензольном кольце на галоген происходит в присутствии катализаторов (кислот Гильберта Льюиса (1875-1946))
С6Н6 + Cℓ2 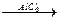 C6H5Cℓ + HCℓ
C6H5Cℓ + HCℓ
хлорбензол
2. Нитрование. Бензол реагирует с нитрующей смесью (смесью концентрированных азотной и серной кислот)
С6Н6 + НОNO2 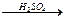 C6H5NO2 + H2O
C6H5NO2 + H2O
нитробензол
3. Алкилирование (реакция Фриделя-Крафтса). Замещение атома водорода в бен-зольном кольце на алкильную группу (алкилирование) происходит под действием алкилгалогенидов или алкенов в присутствии катализаторов (кислот Льюиса) (см. получение).
4. Реакции замещения производных бензола. Метильный радикал в молекуле толуола - донор электронов (индуктивное влияние (I+)) смещает электронную плотность в сторону бензольного кольца. Это приводит к повышению электронной плотности в орто- и пара-положениях, тем самым облегчая реакции электрофильного замещения в этих положениях. Поэтому, если бензол нитруется, галогенируется с образованием монозаме-щенных производных, то толуол нитруется и галогенируется, с образованием трех заме-щенных


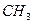
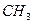
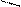

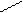

 О2N NO2
О2N NO2


 +
+
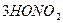
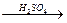 + 3Н2О
+ 3Н2О
NO2
тринитротолуол
5. Реакции присоединения. В реакции присоединения, приводящие к разрушению ароматической структуры бензольного кольца, арены могут вступать с большим трудом:
а) гидрирование.
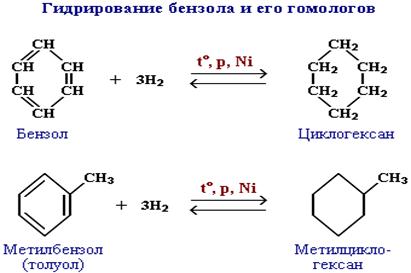
Эта реакция является обратной реакции образованию бензола при дегидрировании циклогексана;
б) радикальное хлорирование. В условиях радикальных реакций (ультрафиолетовый свет, повышенная температура) возможно присоединение галогенов к ароматическим соединениям. Практическое значение имеет радикальное хлорирование бензола для получения «гексахлорана» (средство борьбы с вредными насекомыми).
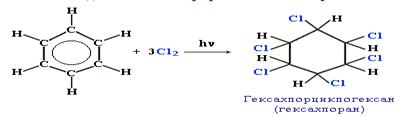
В случае гомологов бензола более легко происходит реакция радикального замещения атомов водорода в боковой цепи.
6. Реакции окисления. Бензол не окисляется даже под действием сильных окислителей (KМnO4, K2Cr2O7 и т.п.), поэтому он часто используется как инертный растворитель при проведении реакций окисления других органических соединений. В отличие от бензола его гомологи окисляются довольно легко:
а) при действии раствора KМnO4 и нагревании в гомологах бензола окислению подвергаются только боковые цепи.
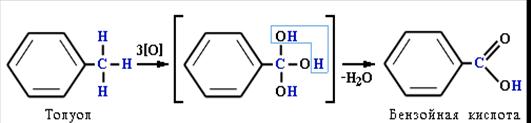 Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи
Окисление других гомологов (этилбензол, пропилбензол и т.д.) также приводит к образованию бензойной кислоты. Разрыв связи при этом происходит между двумя ближайшими к кольцу атомами углерода в боковой цепи
б) бензол и его гомологи на воздухе горят коптящим пламенем, что обусловлено высоким содержанием углерода в их молекулах
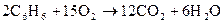
Бензол и его летучие гомологи образуют с воздухом и кислородом взрывоопасные смеси.
 2014-02-02
2014-02-02 2134
2134








