Хелатирование комплексообразователя лигандом, когда лиганд предоставляет комплексообразователю два и более атома, образуя с ним циклическую структуру, широко распространено в природе. Центральный атом такого комплекса оказывается как бы втянутым внутрь лиганда (см. строение глицината меди) и охвачен связями наподобие клешней рака. Отсюда их название хелатные (chelate – клешня).
Би- и полидентатные лиганды связываются с ионом комплексообразователя намного прочнее, чем монодентатные. Определяемая по величинам констант нестойкости прочность хелатных этилендиаминовых комплексов [M(En)2]n+ на 8-10 порядков выше, чем прочность комплексных ионов тех же металлов с аммиаком [M(NH3)4]n+, хотя у тех и у других по четыре однотипных связи M – N. Объясняется это взаимосвязанностью донорных атомов в пределах би- и полидентатного комплекса. Чтобы удалить молекулу NH3 из комплекса [M(NH3)4]n+, требуется разорвать только одну связь M – N. Для удаления H2NCH2CH2NH2 из комплекса [M(En)2]n+ необходим разрыв уже двух связей, образованных двумя атомами азота.
Повышенная прочность комплексных соединений с би- и полидентатными лигандами называется хелатным эффектом. Хелатный эффект полидентатных лигандов настолько велик, что они могут формировать устойчивые комплексы даже с ионами щелочных и щелочно-земельных металлов. Хорошо известным примером является хлорофилл – важнейший природный комплекс магния с порфином:

порфин хлорофилл
В молекуле порфина два протона, связанные с азотом, легко замещаются на атом металла. Еще две связи, двух оставшихся атомов азота с атомами магния, формируются по донорно-акцепторному механизму.
Хлорофилл играет ключевую роль в процессе фотосинтеза, являющемся самой масштабной химической реакцией на Земле. Хотя при этом утилизируется не более 1% световой энергии, падающей на лист растения, продукция фотосинтеза (1011 тонн органического вещества в год) в сотни раз превышает продукцию всего нефтехимического производства, а запасаемая в растениях энергия во столько же раз превышает энергию сжигаемого человечеством топлива.
Примерно одинаковую структуру ядра (порфиновое кольцо) имеет второй природный комплекс – гемоглобин. Разница лишь в том, что у гемоглобина роль комплексообразователя выполняют катионы двухвалентного железа. Координационное число ионов Mg2+ и Fe2+ равно 6, поэтому по вакантным местам присоединяются ещё две молекулы иных веществ. Например, в гемоглобине по одну сторону хелата присоединяется молекула белка глобина, а по другую – молекула кислорода, благодаря чему это соединение является переносчиком кислорода в крови:
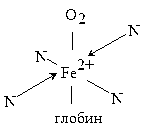
Роль металла в биокомплексах высокоспецифична: замена его даже на близкий по физико-химическим параметрам металл приводит к значительной или полной утрате физиологической активности комплекса. В случае гемоглобина только кобальтовый аналог природного соединения обладает незначительной способностью связывать и переносить кислород.
Из других значимых в биологическом отношении комплексных соединений следует выделить витамин В12 и многие металлоферменты (каталаза, переносчики электронов – цитохромы), дефицит которых у человека приводит к серьезным заболеваниям.
Хелатный эффект дает ключ к пониманию состояния катионов, особенно d-элементов, в организме. Все d-элементы оказываются прочно связанными теми или иными полидентатными биолигандами, как правило, аминокислотами, полипептидами или циклическими биолигандами – производными порфина. В свободном виде, и то в виде аквакомплексов: [Cu(H2O)4]2+, [Fe(H2O)6]3+ и др., эти катионы обнаруживаются лишь в плазме крови, причем в ничтожных количествах.
Наблюдаемое при хелатировании снижение констант нестойкости комплексных ионов обусловило использование полидентатных лигандов (комплексонов) в аналитической химии, токсикологии, гигиене и т.д. Часто это базируется на разрушении комплексоном менее устойчивого соединения с переводом его в более прочное комплексное, имеющее меньшую константу нестойкости. Примером может служить растворение осадка Cu(OH)2 в NH4OH, при этом образуется комплексная соль:
Cu(OH)2↓ + 4NH4OH = [Cu(NH3)4](OH)2 + 4H2O.
Связывание гемоглобина молекулами угарного газа (СО) является аналогичным примером разрушения одного биокомплекса – оксигемоглобина за счет формирования в 300 раз более прочного другого биокомплекса – карбоксигемоглобина:
 HbO2 + CO HbCO + O2.
HbO2 + CO HbCO + O2.
Комплексоны так прочно связывают катионы металлов, что при их добавлении растворяются такие плохо растворимые соли как сульфаты кальция и бария, оксалаты и карбонаты кальция. Поэтому их применяют для умягчения воды, для маскировки «лишних» ионов металла при крашении и в изготовлении цветной плёнки. В химическом анализе явление комплексообразования позволяет разделять столь близкие по свойствам элементы как лантаноиды и актиноиды. Некоторые давно используемые комплексоны приведены в таблице 1.3.
Таблица 1.3.
 2014-02-09
2014-02-09 4005
4005








