1.. Химический потенциал. Химическое сродство...Химическое равновесие.
2. Изотерма химической реакции Константа химического равновесия и способы ее выражения для гомо- и гетерогенных реакций.
4. Изотерма, изобара, изохора химической реакции.
5. Зависимость константы равновесия от температуры. Принцип Ле-Шателье - Брауна.
При протекании химических реакций в открытых системах состав и масса каждого компонента изменяется, что влияет на энергетическое состояние каждого участника и всей системы в целом.
Поэтому термодинамические потенциалы открытых систем зависят не только от внешних параметров, но и от количества каждого участника, т.е:
F = f (T,V,n1, n2, n3 …ni)
G=f (T,V,n1, n2, n3 …ni)
где n1, n2, n3 …ni – число молей каждого участника реакции.
Если продифференцировать функции F и G, (принимая во внимание, что изохорно-изотермический потенциал и изобарно-изотермический потенциал связаны с параметрами состояния следующими уравнениями:
dF<= - pdV – SdT и dG<= Vdp – SdT)
по числу молей всех участников при постоянстве всех остальных получим:
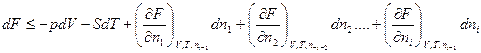 и
и

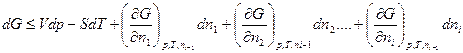
Частную производную термодинамического потенциала всей системы при изменении содеpжания i-го участника на 1 моль в условии постоянства содержания всех других участников и внешних параметров называют парциальным термодинамическим потенциалом (¯F, ¯G¯)данного i-го участника или химическим потенциалом μ следовательно, можно записать:
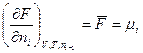 и
и 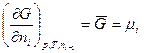
Чтобы понять физический смысл химического потенциала, необходимо рассматривать каждый вид энергии как произведение фактора интенсивности (интенсивного свойства) на фактор емкости (экстенсивного свойства). Например, механическая энергия определится как произведение силы на приращение пути – Fdl, так назыаемая "объемная энергия" pdV - произведение давления на изменение объема.
Аналогично этому химическая энергия μdn определяется произведением химического потенциала на приращени е массы.
Таким образом, μ является фактором интенсивности химической энергии.
Когда две системы с различными потенциалами приходят в контакт, идет выравнивание потенциалов за счет изменения фактора емкости – концентраций, т.е. химический потенциал служит движущей силой при переходе массы из одной системы в другую. что приводит к установлению равновесия.
С учетом вышеприведенных уравнений, можем записать:
dF<= - pdV – SdT +Σμ idni
и dG<= Vdp – SdT)+Σμ idni
или для химических реакций, протекающих при постоянных объеме и температуре и при постоянных давлении и температуре(изохорно-изотермический процесс и изобарно-изотермический процесс) имеем уравнения в упрощенном виде:
dF<= Σμ idni
dG<= Σμ idni
Понятно, что если реакция протекает самопроизвольно, то условием предела протекания реакции будет минимум химических потенциалов всех участников реакции.
Σμ idni<0
В отличие от других интенсивных параметров системы (Р. Т, V, n) химический потенциал нельзя измерить непосредственно. Поэтому наиболее часто используют выражение:
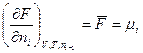 и
и 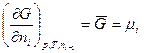
 2014-02-09
2014-02-09 1456
1456
