Пример 3. Наступило ли равновесие для реакции
СО + Н 2О (пар) = СО 2 +Н 2
при 500 С, если Кр = 6,2 а парциальные давления каждого компонента равно 1? (давление измеряется в атмосферах).
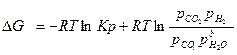 = -8,314 773 ln6,2 + 8,314 773ln 1=<0
= -8,314 773 ln6,2 + 8,314 773ln 1=<0
в системе равновесие не наступило, а реакция идет слева направо при указанных условиях.
Константа равновесия для гетерогенных систем
Гетерогенными химическими равновесиями называются равновесные состояния для реакций между веществами, находящимися в разных фазах.
Возьмем реакцию неполного сгорания углерода
С + 1/2О2 =СО
для гетерогенных систем парциальные давления конденсированных фаз при данной температуре постоянны. и поэтому их при расчете константы равновесия не учитывают, т. е. здесь
Kp=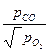
Пример 4. Написать выражение для константы равновесия в реакции получения негашеной извести при давлении 1 атм и температуре 500 С.
СаСО3 = СаО + СО2
Кр = РСО2
Так как реакция идет в открытом сосуде, получаемый углекислый газ удаляется из системы, реакция неравновесная. выражения для. константы равновесия не существует.
Константа равновесия для реакции негазообразных веществ.
Если участники реакции не газообразные вещества, а находятся в растворе, то их количество определяется через концентрацию вещества. а константа равновесия обозначается через Кс и выражается так:
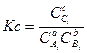 или
или 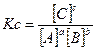
Если в выражении для константы равновесия парциальные давления выразить по уравнению Менделеева-Клапейрона через nRT|V, а
n|V = c. то легко показать, что Кр = Кс (RT)Δn
где изменение числа молей газообразных веществ в ходе реакции.
Если имеются в системе различные фазы и вещества находятся в растворенном и газообразном состояниях, то Кр надо выражать через мольную долю вещества К N и эта константа связана с Кр уравнением:
Кр= КN *PΔn
где р – общее давление системы.
Пример 5. Показать, что больше: Кр или Кс для реакции а) синтеза аммиака, в) реакции нейтрализации КОН.
Решение.
N2 + 3 H2 = 2 NH3
Кр = Кс (RT)Δn
Δn = 2-(1+3) = -2, Kp = Kc(RT)-2 = Kc| RT2, т.е. Кр <Кс.
2КОН + Н2SO4 = К2SO4+Н2О
нет понятия константа равновесия для такой реакции, реакция идет до конца. Реакция неравновесная.
Зависимость константы равновесия от температуры. Уравнение изохоры и изобары химической реакции.
Химическое равновесие является динамическим, т.е. может смещаться в любую сторону при условии изменения внешних условий.
Для того, чтобы определить, как изменится константа равновесия при изменении температуры, нужно продифференцировать уравнение Вант-Гоффа по температуре при условии, что парциального давления каждого из участников реакции заданы и не зависят от температуры:
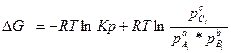
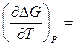

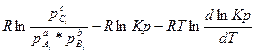
Подставляют в уравнение Гиббса-Гельмгольца 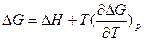
значение ΔG и 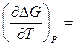 :
:
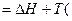
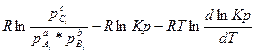 )=
)=
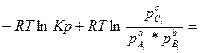 ΔH – T(
ΔH – T(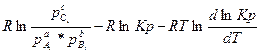 )
)
после сокращений получаем:
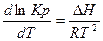
 2014-02-09
2014-02-09 1373
1373
