Частные производные от экстенсивных свойств по n при постоянных Р. Т, V, n называются парциальными величинами. В зависимости от единиц, в которых выражается масса компонента, различают мольные и удельные парциальные величины. Таким образом, μ является парциальной мольной энергией Гиббса.
Из фундаментального уравнения, записанного в виде:
dG= Vdp – SdT+Σμ idni
следует, что условием равновесия при постоянных Р и Т, т.е. при химических реакциях, будет условие:
Σμ idni =0
Величина химического потенциала зависит от природы вещества, давления, температуры и концентрации.
Для для химического потенциала идеального газа можно получить уравнение из выражения для полного дифференциала энергии Гиббса
dG<= Vdp – SdTi
и dG<= Vdp
и подставляя в него значение Vdp из уравнения Менделеева-Клапейрона V=RT/p
dG= dμ= RT dpi /pi
где рi – парциальное давление компонента (т.е. то давление, которое принял бы этот газ, будь ему предоставлен весь объем системы)
Интегрирование при постоянной температуре приводит к выражению:
dG= RT dpi /pi
и
μ= RT lnpi +const
Величина const (постоянная интегрирования) зависит от выбора стандартного состояния. По общепринятому стандартному состоянию р= 1.033 * 10 5 Па, тогда const = μ0 и const =G0 а
Gi= G0 +RT lnpi
и
μi= = μ0 +RT lnpi
где рi - давление индивидуального газа, G0 –стандартная энергия Гиббса
а μ0 - стандартный химический потенциал.
Так как в смеси газов рi= p Ni где р -общее давление в смеси, а Ni –мольная доля компонента, то можно записать:
μi= = μ0 + RT lnp +RT lnNi
или μi= = μ0(Т,р) +RT ln Npi
в этом уравнении химический потенциал есть функция не только температуры, но и давления.
Химическое сродство
Под химическим сродством понимается вопрос о взаимодействии веществ друг с другом.
Исторически сложилось представление, что скорость реакции взаимодействия и есть критерий сродства веществ друг к другу. Но этот принцип оценивания был ошибочен, так как скорость реакции есть функция многих переменных, в том числе она зависит и от наличия катализаторов.
Затем почти одновременно П.Бертло (1867) и Томсен (1853) предложили оценивать сродство по количеству теплоты, выделяющейся при проведении реакции. (Принцип Бертло-Томсена). Это тоже не являлось достаточной оценкой сродства, так как многие химические процессы идут эндотермически.
Поэтому общепринятым принципом оценки химического сродства в термодинамике служат критерии возможности самопроизвольного протекания процесса. т.е. величины ΔFV,T и ΔGp,T..
Закон действующих масс. Химическое равновесие. Константа равновесия.
Положения термодинамики могут быть применены к химическим процессам, так как направление протекания химических реакций и наступление равновесия должно подчиняться общим термодинамическим закономерностям.
Все химические реакции одновременно протекают в двух направлениях: в сторону образования продуктов и в сторону превращения продуктов в исходные вещества. Поскольку скорость реакции прямо пропорционально зависит от количества реагирующих веществ, то стечением времени скорость прямой реакции будет уменьшаться, а обратной – расти.
Когда скорости сравняются, наступит состояние химического равновесия,
Химическое равновесие – динамическое состояние реакции, характеризующееся постоянством равновесных концентраций или парциальных давлений всех участников реакции при постоянстве внешних условий и минимальном значении энергии Гиббса или энергии Гельмгольца.
Гиббса или энергии Гельмгольца.
Для реакции
аА +вВ =сС
скорость прямой реакции 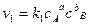
скорость обратной реакции 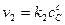 , т. е. можно записать:
, т. е. можно записать:
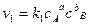 =
=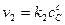 , или
, или 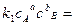
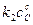
т.е. 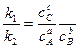 , или если выразить через парциальные давления:
, или если выразить через парциальные давления:
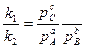
отношение к1 и к2 обозначают Кр и называют константой равновесия.
Отношение произведения равновесных концентраций или парциальных давлений продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам, к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная.
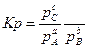
Кр есть величина постоянная при постоянной температуре, не зависящая от концентрации веществ.
Изотерма химической реакции. Константа химического равновесия и способы ее выражения для гомо- и гетерогенных реакций.
Константа равновесия химической реакции позволяет знать направление и предел протекания химической реакции.
Пусть реакция
аА +вВ =сС
протекает самопроизвольно при постоянных Р и Т., участвующие в ней вещества являются идеальными газами.
Изменение энергии Гиббса в ходе реакции описывается уравнением:
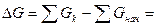 (μ C0 +RT ln pcC)- ((μ A0 +RT ln pa A) +
(μ C0 +RT ln pcC)- ((μ A0 +RT ln pa A) +
(μ B0 +RT ln p bB )) =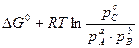
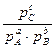 - константа равновесия, химической реакции Кр. А уравнение ΔG=
- константа равновесия, химической реакции Кр. А уравнение ΔG=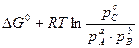 носит название уравнения изотермы Вант-Гоффа.
носит название уравнения изотермы Вант-Гоффа.
Если представить. что в системе наступило равновесие. то для состояния равновесия имеем:
0 =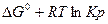
или
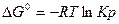
если система находится в равновесии, то при стандартных условиях Кр=1
В уравнении Вант-Гоффа парциальные давления 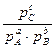 это равновесные давления, если же система находится в неравновесном состоянии, то для этого случая
это равновесные давления, если же система находится в неравновесном состоянии, то для этого случая
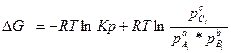
где 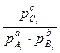 это парциальные давления в любой момент времени.
это парциальные давления в любой момент времени.
 2014-02-09
2014-02-09 1358
1358
