Термодинамика изучает закономерности передачи энергии теплового движения от тела к телу (от системы к системе) и имеет дело с термодинамич. системой (совокупностью макроскопич. тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами ( внешней средой )). Термодинамич. системы, не обменивающиеся с внешней средой ни энергией, ни веществом, называются замкнутыми.. Состояние системы задается термодинамич. параметрами. Выделяют равновесные процессы — это процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамич. параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но в ряде случаев (достаточно медленные процессы) неравновесностью реальных процессов можно пренебречь. Термодинамич. процесс называют обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым. Реальные процессы необратимы, в них всегда происходит диссипация (потеря) энергии (из-за трения, tеплопроводности и т.д.). Обратимые процессы — это физическая модель — это идеализация реальных процессов.
В термодинамически неравновесных системах (как правило, это газы или жидкости) рассматривают явления переноса. Это процессы, в к-рых происходит пространственный перенос энергии (теплопроводность), массы (диффузия), импульса (внутреннее трение). Двигаясь хаотически, молекулы переходят из одних точек пространства в объёме вещества в другие, перенося присущую им массу, энергию и импульс. Явления переноса получили объяснение на основе молекулярно-кинетич. представлений.
 Внутренняя энергия и теплота
Внутренняя энергия и теплота
Cоcтояние cиcтемы. Под физич. системой обычно понимают совокупность нек-рых тел – механич. (СМТ) или, напр-р, в термодинамике – жидкость и находящийся с ней в равновесии газ. Всякая система м-т находится в разных состояниях, различающихся температурой, давлением, объёмом и т.п. Подобные величины, характеризующие состояние системы, именуют параметрами системы (в дальнейшем, пос-ку речь идет о термодинамике: ТС ¾ термодинамическая система)
Любое движущееся тело обладает механической энергией (это его кинетическая и потенциальная энергия). Наряду с механической энергией направленного движения и взаимодействия тело (или физическая система) обладает внутренней энергией (энергией хаотического движения и взаимодействия частиц тела). В реальной физической системе их части, составляющие их частицы всегда взаимодействуют, и это взаимодействие происходит не только при их столкновениях, но и осуществляется на расстоянии ¾ при посредстве физических полей.
Величина внутренней энергии тела включает кинетическую энергию хаотического движения молекул и потенциальную энергию их взаимодействия: 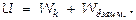 Для одного моля идеального газа
Для одного моля идеального газа 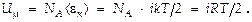 Для газа массой
Для газа массой 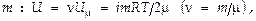 т.е. внутренняя энергия газа определяется его природой и температурой.
т.е. внутренняя энергия газа определяется его природой и температурой.
«Отметим далее, что в выражение для U входит величина i, выражающее число степеней свободы, и особо определим это понятие.
Числом степеней свободы (СС) механической системы называют число независимых переменных, которыми может быть определено положение материальной системы (материальной точки, их системы, т.е. некоторого физического объекта) в пространстве. Рассматриваются некоторые частные случаи.
1. Маятник (шарик), подвешенный бифилярно на двух нерастяжимых нитях имеет одну СС. Это ¾ угол отклонения плоскости нитей от их положения равновесия до положения плоскости их в данный момент времени. Значит, в этом случае i =1.
2. Свободная материальная точка имеет три СС (три координаты в декартовой системе координат), что соответствует молекулам, состоящим из одного атома: i = 3.
3. Система, состоящая из двух жёстко связанных между собой шариков А и В (двух атомов О 2, N 2 и т.д.) имеет i = 5 СС.
Это ¾ три координаты поступательного движения (поступательные СС) центра масс системы и две угловые координаты вращения (вращательные СС) вокруг осей ox и oz (вращение системы вокруг собственной оси oy не изменяет её положения в пространстве).
4. Жёстко связанная система из N частиц (как и твёрдое тело) имеет 6 СС (3 поступательные и 3 вращательные).
5. В реальных молекулах нет жёсткой связи между атомами в молекуле, поэтому необходимо учитывать также СС колебательного движения атомов внутри молекулы, т.е. полное число СС ¾ i = i п + i вр . + i кол..
«Известно, что энергия поступательного движения одной молекулы идеального газа равна 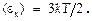 Эта молекула имеет три СС (i п = 3); следоват-но, наодну СС приходится энергия
Эта молекула имеет три СС (i п = 3); следоват-но, наодну СС приходится энергия 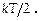 Доказывается, что для сложных молекул на одну СС поступательного и вращат. движения приходится столько же энергии, т.е.,
Доказывается, что для сложных молекул на одну СС поступательного и вращат. движения приходится столько же энергии, т.е., 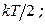 на каждую же колебательную СС в среднем приходится энергия, равная
на каждую же колебательную СС в среднем приходится энергия, равная 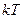 (в этом ¾ одно из основных положений МКТ ¾ положение о равнораспределённости энергии движения физич. системы по СС). Энергия колебательных СС вдвое больше, пос-ку колебательная система обладает равными по величине средними значениями как кинетич., так и потенциал. энергии.
(в этом ¾ одно из основных положений МКТ ¾ положение о равнораспределённости энергии движения физич. системы по СС). Энергия колебательных СС вдвое больше, пос-ку колебательная система обладает равными по величине средними значениями как кинетич., так и потенциал. энергии.
~ Итак, в нек-ром данном состоянии тело должно обладать вполне определёнными значениями механической E и внутренней U энергий. Если привести в соприкосновение два тела, то в процессе взаимодействия они смогут обмениваться энергиями. Известно, что количество переданной механической энергии определяет совершённую работу А (А ¾ это мера переданной механической энергии).
 Термодинамический метод — это метод исследования систем из большого числа частиц, оперирующий величинами, характеризующими систему в целом (напр-р, давление, объем, температура) при различных превращениях энергии, происходящих в системе (без учета внутреннего строения изучаемых тел и характера движения отдельных частиц). Этот метод лежит в основе термодинамики — раздела физики, изучающего общие свойства макроскопических систем, находящихся в состоянии термодинамич. равновесия, и процессы перехода между этими состояниями.
Термодинамический метод — это метод исследования систем из большого числа частиц, оперирующий величинами, характеризующими систему в целом (напр-р, давление, объем, температура) при различных превращениях энергии, происходящих в системе (без учета внутреннего строения изучаемых тел и характера движения отдельных частиц). Этот метод лежит в основе термодинамики — раздела физики, изучающего общие свойства макроскопических систем, находящихся в состоянии термодинамич. равновесия, и процессы перехода между этими состояниями.
 Cоcтояние термодинамической cиcтемы. Всякая система м-т находится в разных состояниях, различающихся температурой, давлением, объёмом и т.п. Подобные величины, характеризующие состояние системы, именуют параметрами системы (в дальнейшем, пос-ку речь идет о термодинамике: ТС ¾ термодинамич. система, СТС - состояние ТС). Не всякий параметр имеет определённые значения, характеризуя ТС в целом, – напр-р, температура м-т быть в пространствeннo разнесённых точках ТС разной, в этом случае телу нельзя приписать определённое значение параметра Т. В случае состояние ТС сч-ся неравновесным. Равновесным же состоянием ТС называют такое состояние ТС, при к-ром все её параметры имеют определённые значения, остающиеся при отсутствии воздействия на ТС неизменными бесконечно долго. Всякий процесс, т.е., переход ТС из одного состояния в др., связан с нарушением состояния ТС. Следоват-но, при протекании в ТС к.-л. процесса она проходит ч/з последовательность неравновесных состояний.
Cоcтояние термодинамической cиcтемы. Всякая система м-т находится в разных состояниях, различающихся температурой, давлением, объёмом и т.п. Подобные величины, характеризующие состояние системы, именуют параметрами системы (в дальнейшем, пос-ку речь идет о термодинамике: ТС ¾ термодинамич. система, СТС - состояние ТС). Не всякий параметр имеет определённые значения, характеризуя ТС в целом, – напр-р, температура м-т быть в пространствeннo разнесённых точках ТС разной, в этом случае телу нельзя приписать определённое значение параметра Т. В случае состояние ТС сч-ся неравновесным. Равновесным же состоянием ТС называют такое состояние ТС, при к-ром все её параметры имеют определённые значения, остающиеся при отсутствии воздействия на ТС неизменными бесконечно долго. Всякий процесс, т.е., переход ТС из одного состояния в др., связан с нарушением состояния ТС. Следоват-но, при протекании в ТС к.-л. процесса она проходит ч/з последовательность неравновесных состояний.
 |
ü Выделяют равновесные процессы — это процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамич. параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но в ряде случаев (достаточно медленные процессы) неравновесностью реальных процессов можно пренебречь. Круговым процессом (или циклом) называют такой процесс, при к-ром ТС после ряда изменений возвращается в исходное состояние ( рис .1). Работа при произвольном замкнутом процессе численно равна площади, охватываемой кривой, описывающей ход цикла, например, на шкале параметров V и P.
 |
ü Термодинамич. процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении, и система возвращается в исходное состояние, то в окружающей среде и в этой системе не должно происходить никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым. Реальные процессы необратимы, в них всегда происходит диссипация (т.е., потери) энергии (из-за трения, теплопроводности и т.д.). Обратимые процессы — это физическая модель, идеализация реальных процессов. Обратимый процесс, очевидно, обладает таким свойством: если при прямом ходе на нек-ром этапе ТС получает тепло dQ и совершает работу dA, то при обратном на том участке хода процесса ТС отдаёт тепло dQ ’ и над ней совершается работа dA ’= dA. Поэтому после протекания обратимого процесса в одном, а затем в обратном направлении, и возвращения ТС в первоначальное состояние в окружающих ТС телах не д-но оставаться никаких изменений.
 Работа газа при расширении
Работа газа при расширении
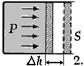
Если привести в соприкосновение два тела с различной температурой, то происходит обмен внутренней энергией. Величину переданной энергии теплового движения молекул измеряют количеством теплоты. Поэтому, как известно, количество теплоты есть мера переданной телу или отданной им внутренней энергии (энергии хаотичного движения). Работу, совершаемую данным телом над внешними, м-но выразить ч/з величины давления и изменения объёма тела. Так, элементарной работе, совершённой газом, напр-р, при перемещении поршня на отрезок 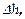 сопоставляется значение
сопоставляется значение 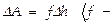 сила, с к-рой газ действует на поршень, рис .2), к-рое м-т быть выражено так
сила, с к-рой газ действует на поршень, рис .2), к-рое м-т быть выражено так 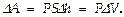 Полная работа при изменении СТС между точками (1) и (2) ( рис .1) выразится интегралом A 12 =
Полная работа при изменении СТС между точками (1) и (2) ( рис .1) выразится интегралом A 12 = 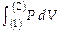 ( площадью под одной из кривых — 1→2 или 2→1). Если давление газа остаётся неизменным (в изобарич. процессе — p = pS — для этого д-на соответственно меняться температура газа), работа, к-рая совершается при изменении объема V 1 ® V 2, в непрерывном суммировании выразится так: A 12 =
( площадью под одной из кривых — 1→2 или 2→1). Если давление газа остаётся неизменным (в изобарич. процессе — p = pS — для этого д-на соответственно меняться температура газа), работа, к-рая совершается при изменении объема V 1 ® V 2, в непрерывном суммировании выразится так: A 12 = 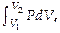 т.е., A 12 = pS × (V 2 – V 1 ). Для любой ТС м-но записать величину элементарной работы в виде:
т.е., A 12 = pS × (V 2 – V 1 ). Для любой ТС м-но записать величину элементарной работы в виде: 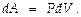
«Теплоёмкость ТС. Если привести в соприкосновение два тела с различной температурой, то происходит обмен внутренними энергиями. Величину переданной энергии теплового движения молекул измеряют kоличеством теплотыQ. Значит, количество теплоты Q тоже не является особой формой энергии. Количество теплоты есть мера переданной телу или отданной им внутренней энергии ( энергии хаотичного движения ).
 Теплоёмкостью нек-рого тела называют величину, равную колич-ву тепла, к-рое следует сообщить телу, чтобы повысить его температуру на 1 К. В пересчете на 1 моль нек-рого вещества
Теплоёмкостью нек-рого тела называют величину, равную колич-ву тепла, к-рое следует сообщить телу, чтобы повысить его температуру на 1 К. В пересчете на 1 моль нек-рого вещества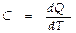 выражает молярную теплоёмкость. Если нагревание происходит при постоянном объёме, тело не совершает работы над внешними телами, а всё тепло идёт на приращение внутренней энергии:
выражает молярную теплоёмкость. Если нагревание происходит при постоянном объёме, тело не совершает работы над внешними телами, а всё тепло идёт на приращение внутренней энергии: 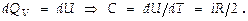 Т.о., теплоёмкость идеального газа при постоянном объёме оказывается величиной неизменной – не зависящей от пaраметров состояния газа, в частности, от T.
Т.о., теплоёмкость идеального газа при постоянном объёме оказывается величиной неизменной – не зависящей от пaраметров состояния газа, в частности, от T.
«В ходе нагревания газа при постоянном давлении, он расширяется. Над окружающими телами совершается положительная работа. Следоват-но, для повышения температуры 1 моля газа на 1 К уходит бóльшая энергия 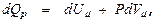 в этом случае молярную теплоёмкость выражают:
в этом случае молярную теплоёмкость выражают: 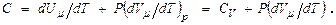 Далее это выражение преобразуют с учётом того, что
Далее это выражение преобразуют с учётом того, что 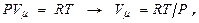 т.е. получают
т.е. получают 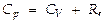 т.е. работа, к-рую совершает 1 моль идеального газа при повышении его температуры на 1 К в условиях постоянного давления, равна универсальной газовой постоянной R. Теплоёмкость же при этом
т.е. работа, к-рую совершает 1 моль идеального газа при повышении его температуры на 1 К в условиях постоянного давления, равна универсальной газовой постоянной R. Теплоёмкость же при этом 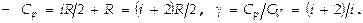
1-ое начало термодинамики. Любое движущееся тело обладает механической энергией (это его кинетическая и потенциальная энергия). Наряду с механической энергией направленного движения и взаимодействия тело обладает внутренней энергией (энергией хаотического движения и взаимодействия частиц тела).
Итак, в нек-ром данном состоянии тело должно обладать вполне определенными значениями механической E и внутренней U энергиями. Если привести в соприкосновение два тела, то в процессе взаимодействия они смогут обмениваться энергиями. Количество переданной механической энергии измеряется совершенной работой А. Например, вода, падающая на лопасти турбины, вращает ее. При этом происходит обмен механическими энергиями. Мерой же переданной механической энергии от одного тела к другому и является работа. За счет совершённой работы и переданной телу теплоты изменяется (повышается) внутренняя энергия 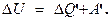
Из опыта известно множество примеров превращения механической энергии в энергию теплового движения и наоборот (поршень в двигателе, движимый расширяющимся при нагревании газом). Опыт показывает, что этот переход совершается в эквивалентных количествах. Но так как тепловое движение есть, в конечном итоге, тоже механическое движение отдельных частиц, то при всех этих превращениях должен соблюдаться закон сохранения энергии с учетом энергии не только внешних, но и внутренних движений. Отсюда следует вывод, что количество теплоты, сообщаемое телу, идет на увеличение его внутренней энергии и на совершение телом работы: 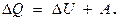 В этом — выражение первого закона термодинамики, его ещё именуют первым началом. Выше говорилось, что работу, совершаемую данным телом над внешними, м-но выразить ч/з величины давления и изменения объёма тела ¾ в элементарных (дифференциальных) величинах работы и изменения объёма для любой механич. системы м-но записать, что
В этом — выражение первого закона термодинамики, его ещё именуют первым началом. Выше говорилось, что работу, совершаемую данным телом над внешними, м-но выразить ч/з величины давления и изменения объёма тела ¾ в элементарных (дифференциальных) величинах работы и изменения объёма для любой механич. системы м-но записать, что 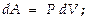 выражение для 1-ого начала ТД записывают с учетом этого так:
выражение для 1-ого начала ТД записывают с учетом этого так: 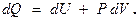
2-ое начало термодинамики. Все тепловые двигатели, независимо от их конструктивных особенностей, решают одну задачу — превращение внутренней энергии в механич. Энергия путём теплообмена передаётся нек-рому газу, к-рый расширяясь, производит работу против внешних сил, приводя в действие определённый механизм. Очевидно, в тепловом двигателе газ не м-т беспредельно расширяться, т.е. тепловой двигатель д-н работать циклично — в ходе цикла за процессом расширения газа следует его сжатие до первоначального состояния.
Реальные двигатели работают по так наз. разомкнутому циклу, когда газ после расширения выбрасывается, сжимается далее новая его порция. Это, однако, не особо влияет на термодинамику процесса, поэтому его анализируют, рассматривая замкнутый цикл с одной порцией газа. Для того, чтобы дв-ль в ходе цикла совершил полезную работу, надо чтобы работа в течение расширения газа была больше работы сжатия ( рис.1). В этом случае окружающие дв-ль тела получат больше механич. энергии, чем отдадут его при сжатии. Доказывается, что температура газа при его сжатии д-на быть ниже, чем при расширении. Начальное и конеч. состояния газа при расширении совпадают, cледоват-но, работа сжатия будет меньше работы расширения лишь в том случае, если во всяком промежуточ. состоянии давление в ходе сжатия будет меньше, чем при расширении. Это возможно, однако, только если на всех промежуточных этапах температура газа в процессе сжатия меньше, чем при расширении.
Любой тепловой двигатель состоит из 3-х основных частей: рабочего тела, нагревателя и холодильника. Рабочим телом служит нек-рый газ, за счёт расширения к-рого происходит работа. Рабочее тело получает нек-рое количество теплоты Q от нагревателя; на этапе сжатия газ передаёт тепло холодильнику – телу, температура T 2 к-рого остаётся неизменной и всегда меньше температуры нагревателя. За счёт этого давление газа при сжатии ниже, чем при расширении. Это является необходимым условием работы двигателя.
Баланс энергии в ходе цикла м-но записать на основании 1-го начала термодинамики. Поск-ку по завершении цикла термодинамич. система приходит к начальному состоянию, её внутренняя энергия не меняется 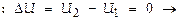
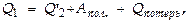 где
где 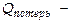 энергия, теряемая в ходе цикла на теплообмен с окружающей средой, на трение и т.п. Отсюда следует, что полезная работа, совершаемая дв-лем в ходе цикла
энергия, теряемая в ходе цикла на теплообмен с окружающей средой, на трение и т.п. Отсюда следует, что полезная работа, совершаемая дв-лем в ходе цикла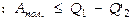 ( здесь случай равенства характеризует идеальную машину – без потерь, неравенство же соответствует реальному дв-лю ). Коэффициентом полезного действия h называют отношение полезной работы к энергии, к-рое рабочее тело получает от нагревателя, т.е. к колич-ву теплоты
( здесь случай равенства характеризует идеальную машину – без потерь, неравенство же соответствует реальному дв-лю ). Коэффициентом полезного действия h называют отношение полезной работы к энергии, к-рое рабочее тело получает от нагревателя, т.е. к колич-ву теплоты 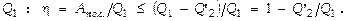 Т.о., даже у идеального теплового дв-ля, работающего без потерь, КПД принципиально ниже 100 %. КПД мог равняться 100%, если бы в течение цикла не передавалась энергия холодильнику, т.е. когда было бы возможным достичь
Т.о., даже у идеального теплового дв-ля, работающего без потерь, КПД принципиально ниже 100 %. КПД мог равняться 100%, если бы в течение цикла не передавалась энергия холодильнику, т.е. когда было бы возможным достичь 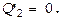 Но с этим условием работа двигателя невозможна, поск-ку в процессе сжатия газ следует охладить, что и означает передачу холодильнику определённого количecтва тепла
Но с этим условием работа двигателя невозможна, поск-ку в процессе сжатия газ следует охладить, что и означает передачу холодильнику определённого количecтва тепла 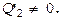 Двигатель с КПД h, равным 1, в принципе невозможен.
Двигатель с КПД h, равным 1, в принципе невозможен.
На принципе такого запрета (т.е. невозможности 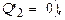 сформулированного Дж.Томсоном и М.Планком, основывается 2-ое начало ТД: невозможен процесс, единственным результатом к-рого было бы охлаждение нагревателя и превращения полученного количества теплоты полностью в работу. В иной, также очевидной, трактовке: невозможен процесс, единственным результатом к-рого был бы переход тепла от тела, менее нагретого, к телу, более нагретому. Переход должен сопровождаться изменением в окружающих телах, связанным с совершением над системой работы А.
сформулированного Дж.Томсоном и М.Планком, основывается 2-ое начало ТД: невозможен процесс, единственным результатом к-рого было бы охлаждение нагревателя и превращения полученного количества теплоты полностью в работу. В иной, также очевидной, трактовке: невозможен процесс, единственным результатом к-рого был бы переход тепла от тела, менее нагретого, к телу, более нагретому. Переход должен сопровождаться изменением в окружающих телах, связанным с совершением над системой работы А.
 2014-02-09
2014-02-09 1041
1041








