Эти уравнения позволяют переходить от одного термодинамического потенциала к другому, т.е. рассчитывать (в обобщенном выражении) Ψk(Pk), если дано Ψl(Pk): 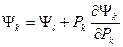 . На практике важнейшее значение имеют три частных случая уравнений Гиббса-Гелмгольца:
. На практике важнейшее значение имеют три частных случая уравнений Гиббса-Гелмгольца:
а) 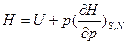 - позволяет рассчитывать энтальпию, если известна внутренняя энергия как функция давления.
- позволяет рассчитывать энтальпию, если известна внутренняя энергия как функция давления.
б) 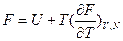 - позволяет рассчитывать свободную энергию Гельмгольца, если известна внутренняя энергия как функция температуры.
- позволяет рассчитывать свободную энергию Гельмгольца, если известна внутренняя энергия как функция температуры.
в) 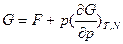 - позволяет рассчитывать свободную энергию Гиббса, если известна энтальпия как функция температуры.
- позволяет рассчитывать свободную энергию Гиббса, если известна энтальпия как функция температуры.
г) 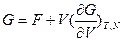 - позволяет рассчитывать свободную энергию Гиббса, если известна свободная энергия Гельмгольца как функция объема, например, из статистических расчетов.
- позволяет рассчитывать свободную энергию Гиббса, если известна свободная энергия Гельмгольца как функция объема, например, из статистических расчетов.
д) 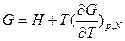 - позволяет рассчитывать свободную энергию Гиббса, если известна энтальпия как функция температуры. Общее решение этого уравнения имеет вид:
- позволяет рассчитывать свободную энергию Гиббса, если известна энтальпия как функция температуры. Общее решение этого уравнения имеет вид: 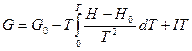 , где I – термодинамически неопределенная постоянная, зависящая от давления. В соответствие с теоремой Нернста (третьим законом термодинамики)
, где I – термодинамически неопределенная постоянная, зависящая от давления. В соответствие с теоремой Нернста (третьим законом термодинамики) 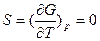 при Т =0 I =0 и
при Т =0 I =0 и 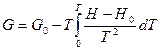 .
.
Уравнение д) является практически наиболее важным, так как применимо для наиболее часто встречающихся условий при анализе конденсированных материальных систем. Функцию Н(Т) можно получить интегрированием уравнения 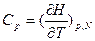 , если известна легко экспериментально определяемая величина теплоемкости при постоянном давлении. Величину G как функцию Т можно определить интегрированием уравнений в) и д):
, если известна легко экспериментально определяемая величина теплоемкости при постоянном давлении. Величину G как функцию Т можно определить интегрированием уравнений в) и д): 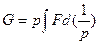 и
и 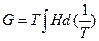 соответственно, с определением констант интегрирования, или по уравнению г) без интегрирования, если F известна иp статистических расчетов. Уравнения д) можно также легко преобразовать в соотношение
соответственно, с определением констант интегрирования, или по уравнению г) без интегрирования, если F известна иp статистических расчетов. Уравнения д) можно также легко преобразовать в соотношение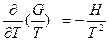 , которое можно записать в изменениях свободной энергии Гиббса и энтальпии
, которое можно записать в изменениях свободной энергии Гиббса и энтальпии 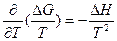 , позволяющее определять тепловые эффекты (
, позволяющее определять тепловые эффекты (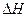 ) равновесных процессов (химических реакций, процессов растворения и фазовых переходов) через их «стандартную энергию Гиббса».
) равновесных процессов (химических реакций, процессов растворения и фазовых переходов) через их «стандартную энергию Гиббса».
Б. С оотношения Максвелла.
Как уже указывалось, основные термодинамические функции состояния (U,S,F,G) являются характеристическими функциями многих независимых переменных, содержащих все термодинамические сведения о системе. Полный дифференциал функции многих переменных Y(x1,x2,…,xn) выражается через первые частные производные в виде: 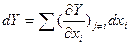 , причем отдельные их слагаемые не являются дифференциалами, так как их интегралы мрогут принимать любые значения с учетом констант интегрирования. Первые частные производные таких функций по интенсивным независимым переменным дают экстенсивные параметры, а по экстенсивным – измеряемые и регулируемые интенсивные параметры
, причем отдельные их слагаемые не являются дифференциалами, так как их интегралы мрогут принимать любые значения с учетом констант интегрирования. Первые частные производные таких функций по интенсивным независимым переменным дают экстенсивные параметры, а по экстенсивным – измеряемые и регулируемые интенсивные параметры 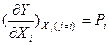
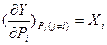 , где Y – характеристическая функция, Pi - интенсивные и Xi - экстенсивные параметры (более подробно – см. раздел 3). Их вторые частные производные дают дополнительные измеримые величины. Воспользовавшись хорошо разработанной теорией таких функций и используя ее основополагающие соотношения (для трех переменных x,y,z, которые могут быть представлены к в виде функции двух других, т.е. x=х(y,z); y=у(х,z); z=z(х,у):
, где Y – характеристическая функция, Pi - интенсивные и Xi - экстенсивные параметры (более подробно – см. раздел 3). Их вторые частные производные дают дополнительные измеримые величины. Воспользовавшись хорошо разработанной теорией таких функций и используя ее основополагающие соотношения (для трех переменных x,y,z, которые могут быть представлены к в виде функции двух других, т.е. x=х(y,z); y=у(х,z); z=z(х,у): 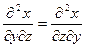 (смешанные производные не зависят от порядка дифференцирования);
(смешанные производные не зависят от порядка дифференцирования); 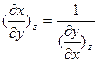 и
и 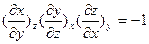 , а для двух разных функций одних и тех же переменных z=z(х,у) и f=f(x,y):
, а для двух разных функций одних и тех же переменных z=z(х,у) и f=f(x,y): 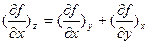 ), Максвелл получил большое количество дополнительных соотношений между термодинамическими величинами, позволяющие связывать трудно измеряемые параметры с легко измеряемыми. Частными случаями соотношений Максвелла для внутренней энергии являются, например:
), Максвелл получил большое количество дополнительных соотношений между термодинамическими величинами, позволяющие связывать трудно измеряемые параметры с легко измеряемыми. Частными случаями соотношений Максвелла для внутренней энергии являются, например: 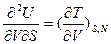 ;
; 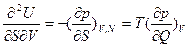 , откуда
, откуда 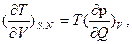 т.е трудно определяемая величина, означающая прирост температуры на единицу объема при квазистаитчески-адиабатическом расширении, равна легко определяемому повышению давления при подводе единицы количества теплоты при постоянном объеме и составе.
т.е трудно определяемая величина, означающая прирост температуры на единицу объема при квазистаитчески-адиабатическом расширении, равна легко определяемому повышению давления при подводе единицы количества теплоты при постоянном объеме и составе.
Для термодинамических потенциалов в обобщенном выражении 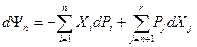 следует:
следует: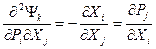 ,
,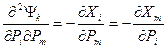 ,
, 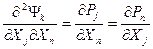 (i,m≤k; j,n>k). Полученные при этом частные случаи соотношений Максвелла из свободных энергий Гельмгольца и Гиббса, а также из внутренней энергии и энтальпии чаще всего используются для представления производных термодинамических функций, которая легко может быть связана с экспериментально измеряемыми величинами. Например, вторая частная производная свободной энергии Гельмгольца как функции V и Т дает соотношение Максвелла в виде:
(i,m≤k; j,n>k). Полученные при этом частные случаи соотношений Максвелла из свободных энергий Гельмгольца и Гиббса, а также из внутренней энергии и энтальпии чаще всего используются для представления производных термодинамических функций, которая легко может быть связана с экспериментально измеряемыми величинами. Например, вторая частная производная свободной энергии Гельмгольца как функции V и Т дает соотношение Максвелла в виде: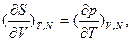 а вторая частная производная свободной энергии Гиббса как функции р и Т - в виде:
а вторая частная производная свободной энергии Гиббса как функции р и Т - в виде: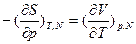 . В обоих соотношениях производную в правой части сравнительно легко определить экспериментально. Соотношения Максвелла позволяют выразить термодинамические производные через экспериментально определяемые величины, в частности (для однокомпонентных систем): мольную теплоемкость при постоянном давлении
. В обоих соотношениях производную в правой части сравнительно легко определить экспериментально. Соотношения Максвелла позволяют выразить термодинамические производные через экспериментально определяемые величины, в частности (для однокомпонентных систем): мольную теплоемкость при постоянном давлении 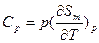 , где Sm - мольная энтропия; термический коэффициент объемного расширения
, где Sm - мольная энтропия; термический коэффициент объемного расширения 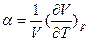 и коэффициент изотермической сжимаемости (величину, обратную модулю объемного сжатия)
и коэффициент изотермической сжимаемости (величину, обратную модулю объемного сжатия) 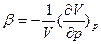 , коэффициент давления
, коэффициент давления 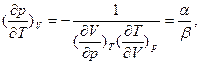 разность мольных теплоемкостей при постоянном давлении и объеме
разность мольных теплоемкостей при постоянном давлении и объеме 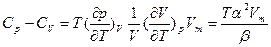 , где Vm - мольный объем.
, где Vm - мольный объем.
 2014-02-09
2014-02-09 1423
1423
