Из условия независимости вторых производных фундаментального уравнения в энтропийном выражении по объему V и температуре Т (для закрытых систем) 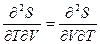 получено соотношение, получившее название уравнения Гельмгольца:
получено соотношение, получившее название уравнения Гельмгольца: 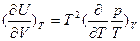 , с помощью которого можно рассчитывать изотермические изменения внутренней энергии по известному уравнению состояния. С помощью этого уравнения можно показать, что для идеального газа с уравнением состояния pV=nRT внутренняя энергия при постоянной температуре не зависит от объема. Для N молей реального газа, состояние которого описывается уравнением Ван дер Ваальса
, с помощью которого можно рассчитывать изотермические изменения внутренней энергии по известному уравнению состояния. С помощью этого уравнения можно показать, что для идеального газа с уравнением состояния pV=nRT внутренняя энергия при постоянной температуре не зависит от объема. Для N молей реального газа, состояние которого описывается уравнением Ван дер Ваальса 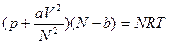 :
: 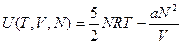 ;
; 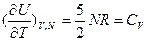 ;
; 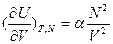 ;
; 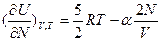 .
.
1.5.2. Условия эволюции макроскопических систем в равновесное состояние.
В классической равновесной термодинамике общие условия эволюции систем в равновесное состояние определяются вариационным принципом (принципом экстремумов). Этот принцип гласит, что при любом ограничении термодинамических параметров эволюция системы к равновесному состоянию соответствует стремлению к достижению некоторой основной функцией состояния своего экстремального значения. Так, закрытые системы при постоянных Т и V переходят в состояние c минимальной свободной энергией Гельмгольца, а при постоянных Т и р – в состояние c минимальной свободной энергией Гиббса. В случае многокомпонентных конденсированных материальных систем химические потенциалы как парциальные мольные свободные энергии компонентов также стремятся к минимуму при эволюции системы в равновесное состояние, причем в условиях термодинамического равновесия химический потенциал каждого отдельного компонента во всех частях системы одинаков. Изолированные системы (при постоянных U и V) эволюционируют в состояние с максимальной энтропией. Очевидно, что при этом производство энтропии стремится к нулю, так что условие приближения системы к равновесию с точки зрения современных представлений термодинамики может быть записано не только как устойчивое увеличение энтропии до максимума, но и как устойчивое уменьшение производства энтропии до нуля. Последнее условие может быть распространено на эволюцию любых систем в равновесное состояние.
 2014-02-09
2014-02-09 994
994







