Недостатки теории Бора.
Главное, орбитальное и магнитное квантовые числа. Кратность
Волновые функции, описывающие электрон в атоме водорода.
Уравнение Шредингера для атома водорода.
Недостатки теории Бора.
1). Т.Б. не могла предсказать интенсивности спектральных линий.
2). Невозможность создания теории атома гелия, содержащего помимо ядра два электрона.
3). Т.Б. не могла объяснить тонкой структуры спектров атомов различных элементов (особенно тяжелых).
Рассмотрим движение электрона в кулоновском поле ядра Ze, т. е. задачу об электроне, обладающем потенциальной энергией:
U(r)= - Ze2/4πε0r, (13-1а)
где r - расстояние между электроном и ядром. Состояние электрона в водородоподобном атоме описывается некоторой волновой функцией ψ,удовлетворяющей стационарному уравнению Шредингера:
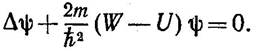 (13-1б)
(13-1б)
Здесь W- значения полной энергии электрона в атоме, которые требуется отыскать при условии, что ψ удовлетворяет требованиям:
конечности,
однозначности,
непрерывности.
Силовое поле, в котором движется электрон в атоме водорода, имеет центрально - симметричный характер. Решить уравнение Шредингера это значит найти собственные значения энергии W и собственные функции ψ. Все уравнения отличаются только значением U - потенциальной энергией квантовой системы.
Для атома водорода и водородоподобных систем применимо выражение для U (13-1а). Поэтому, для водородоподобных атомов (включая атом водорода) уравнение Шредингера имеет вид:
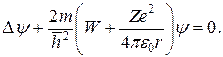 (13-1в).
(13-1в).
 2014-02-09
2014-02-09 4667
4667