1. Для проведения лекарственных веществ в составе суспензии предложите достоверные реакции идентификации и количественного определения при совместном присутствии:
· Приведите русское, латинское и рациональное название препарата. Охарактеризуйте физико-химические свойства (внешний вид, растворимость, спектральные и оптические характеристики) и их использование для оценки качества.
· В соответствии с химическими свойствами предложите реакции идентификации и методы количественного определения. Напишите уравнения реакций.
Bismuthi subnitratis
Magnesii oxydi ana 2,0
Aguae purificatae 100 ml
M.D.S. по 1 ч.л. 2 раза в день
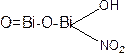 висмут нитрат основной
висмут нитрат основной
Mg=O магния оксид
Применяется внутрь как вяжущее, антисептическое, при повышенной кислотности, при желудочно-кишечных заболеваниях.
Висмут субнитрат – белый аморфный порошок, практически нерастворим в воде, легко – в соляной и азотной кислотах.
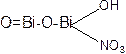 + 5 Н2О 2Bi(NO3)3 + 3 H2O
+ 5 Н2О 2Bi(NO3)3 + 3 H2O
Водные смеси окрашивают синюю лакмусовую бумагу в красный цвет.
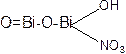 + Н2О HNO3 + 3 H2O +
+ Н2О HNO3 + 3 H2O + 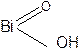
Магния окись – белый мелкий порошок без запаха, практически нерастворим в воде и спирте, растворим в HCl, H2SO4, CH3COOH.
Подлинность
1. Висмута нитрат основной:
При прибавлении HNO3 и Na2S образуется коричнево-чёрный осадок
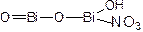 + 5HNO3 → 2Bi(NO3)3 + 3H2O
+ 5HNO3 → 2Bi(NO3)3 + 3H2O
2Bi(NO3)3 + 3Na2S → BiS3↓ + 6NaNO3
2. При прибавлении H2SO4 после фильтрации, при добавлении к фильтрату раствора KI образуется чёрный осадок йодида висмута, растворимый в избытке реактива с образованием жёлто-оранжевого раствора комплексной соли.
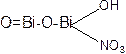 + 3 H2SO4 → Bi(SO4)3 + HNO3 + 3H2O
+ 3 H2SO4 → Bi(SO4)3 + HNO3 + 3H2O
Bi(SO4)3 + 6KI → 2BiI3↓ + 3K2SO4
BiI3 + KI → KBiI4
Определение магния оксида. После прибавления раствора HCl и фильтрации в фильтрате определяют Mg2+
MgO + 2HCl → MgCl2 + H2O
MgCl2 + NaHPO4 + NH3·H2O  MgNH4PO4↓ + 2NaCl + H2O
MgNH4PO4↓ + 2NaCl + H2O
растворение в CH3COOH
MgNH4PO4 + 2CH3COOH → Mg(CH3COO)2 + NH4H2PO4
Общим реактивом обнаружения является минеральная кислота (HCl и HNO3), которая растворяет оба ингредиента. После действия кислоты проводят частные реакции на каждый катион (Mg2+ и Bi3+)
Метод трилонометрии
Точную навеску лекарственной формы растворяют в азотной кислоте, затем прибавляют аммиачно-буферный раствор и титруют 0,05 М раствором Трилона Б в присутствии индикатора терокатехинового фиолетового от синего до жёлтого окрашивания (висмута субнитрата)
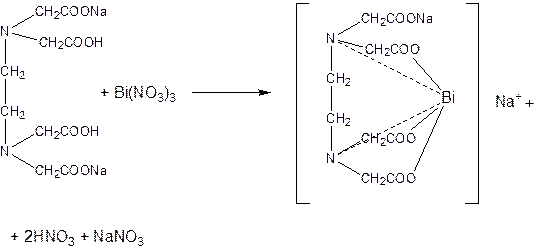
Определение висмута нитрата основного: расчёт ведут по оксиду висмута Bi2O3, который должен быть 79-82%
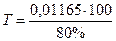 =0,01456 г/мл
=0,01456 г/мл
н.о. висмута субнитрата в л.ф. ±5%
| 2 — 100 х — 5 | Х= ±0,1 |
1,9-2,1
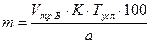 ;
;
Определение магния оксида проводят методом трилонометрии с индикатором кислотным хром чёрным предварительно растворив в HCl до синего окрашивания
MgO + 2HCl → MgCl2 + H2O
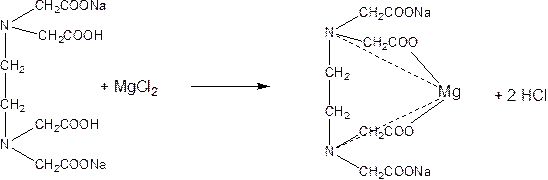
 2015-01-30
2015-01-30 3927
3927
