· Связь между молярной (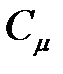 ) и удельной (с) теплоемкостями газа
) и удельной (с) теплоемкостями газа
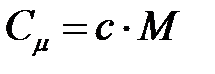 ,
,
где М — молярная масса газа.
· Молярные теплоемкости при постоянном объеме и постоянном давлении соответственно равны (в целях упрощения записи в индексах обозначений молярной теплоемкости при постоянном давлении и постоянном объеме букву «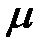 » будем опускать)
» будем опускать)
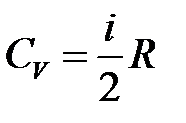 ;
; 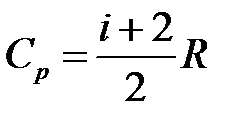 ,
,
где 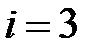 для газа одноатомных молекул,
для газа одноатомных молекул, 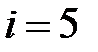 для газа двухатомных молекул,
для газа двухатомных молекул, 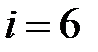 для газа трех- и более атомных молекул.
для газа трех- и более атомных молекул.
· Уравнение Майера
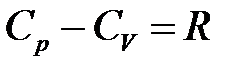 .
.
· Показатель адиабаты
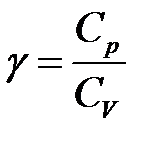 .
.
· Внутренняя энергия идеального газа
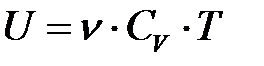 ,
,
где 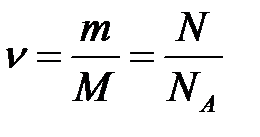 — количество вещества.
— количество вещества.
· Работа, связанная с изменением объема газа, в общем случае вычисляется по формуле
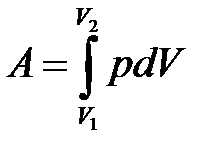 ,
,
где V 1 — начальный объем газа; V 2 — его конечный объем.
Работа газа:
а) при изобарном процессе (p =const)
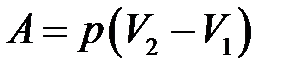 ;
;
б) при изотермическом процессе (T =const)
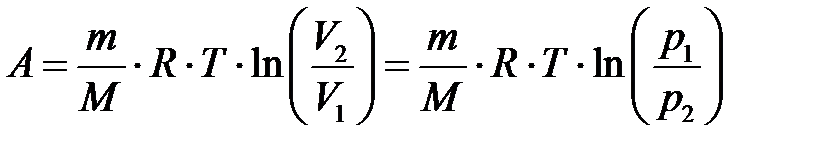 ;
;
в) при адиабатном процессе
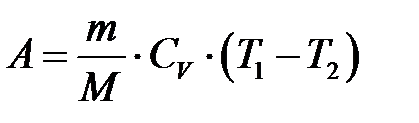 , или
, или 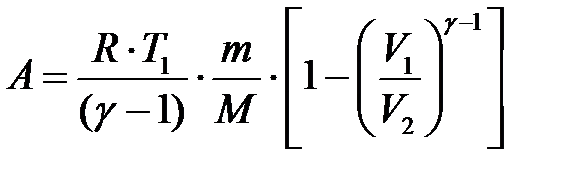 ,
,
где T 1 — начальная температура газа; T 2 — его конечная температура.
· Уравнение Пуассона (уравнение газового состояния при адиабатном процессе)
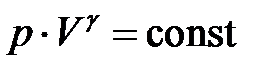 .
.
· Связь между начальным и конечным значениями параметров состояний газа при адиабатном процессе:
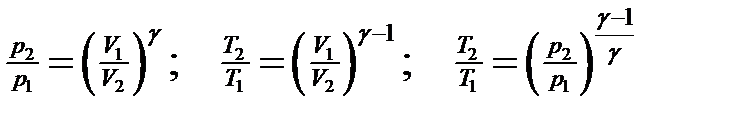 .
.
· Первое начало термодинамики в общем случае записывается в виде
Q=DU+A,
где Q – количество теплоты, сообщённое газу; DU —изменение его внутренней энергии; А — работа, совершаемая газом против внешних сил.
а) при изобарном процессе
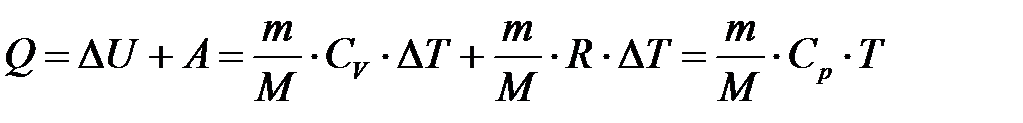
б) при изохорном процессе (A =0)
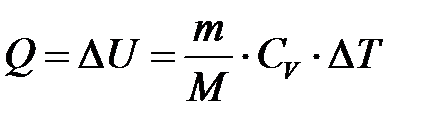 ;
;
в) при изотермическом процессе (D U =0)
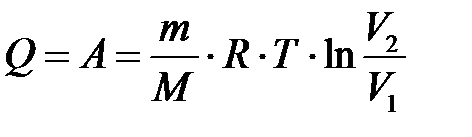 ,
,
г) при адиабатном процессе (Q =0)
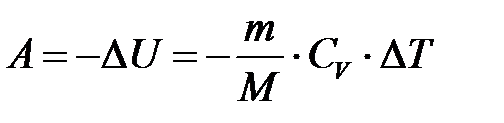 .
.
· Термический коэффициент полезного действия (КПД) цикла в общем случае
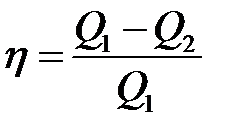 ,
,
где Q 1 – количество теплоты, полученное рабочим телом (газом) от нагревателя; Q 2 – количество теплоты, переданное рабочим телом охладителю.
КПД цикла Карно
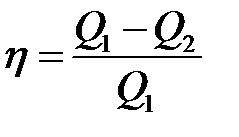 , или
, или 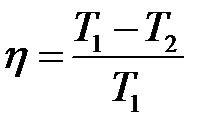 ,
,
где T 1 — температура нагревателя; T 2 — температура охладителя.
· Изменение энтропии
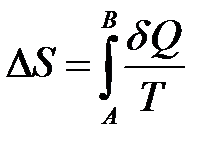
где A и B — пределы интегрирования, соответствующие начальному и конечному состояниям системы. Так как процесс равновесный,то интегрирование проводится по любому пути.
 2015-01-07
2015-01-07 1080
1080








