Электронная плотность. Из рассмотрения диаграммы энергетических уровней бутадиена хорошо видно, что электронная плотность на каждом атоме углерода, которые входящят в состав рассматриваемой молекулы, создаётся за счёт электронов, находящихся на молекулярных орбиталях 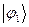 и
и 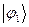 (
(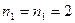 ). Учитывая значения орбитальных коэффициентов полученных для молекулярных орбиталей
). Учитывая значения орбитальных коэффициентов полученных для молекулярных орбиталей 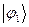 и
и 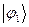 , на основании формулы вида:
, на основании формулы вида:
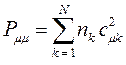
здесь 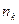 - число электронов на молекулярной орбитали
- число электронов на молекулярной орбитали 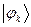 с номером
с номером 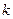 , будем иметь соответственно:
, будем иметь соответственно:
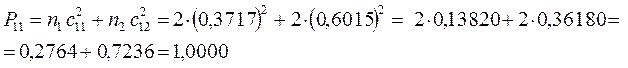
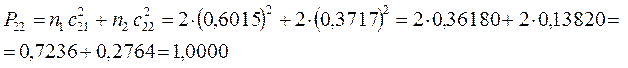
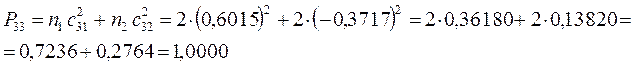
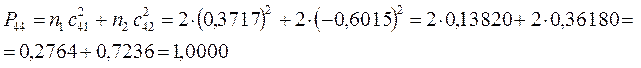
поскольку:
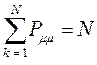
имеем таким образом:
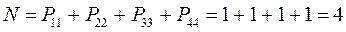
Заряд на атоме. Поскольку в результате делокализации некоторая часть  - электронов сосредотачивается у атома
- электронов сосредотачивается у атома 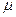 , то в силу этого, электронная плотность на этом атоме
, то в силу этого, электронная плотность на этом атоме 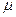 будет равна
будет равна 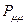 . Очевидно, разность величин
. Очевидно, разность величин 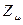 и
и 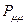 будет определять остаточный заряд, который будет сосредотачиваться у данного атома:
будет определять остаточный заряд, который будет сосредотачиваться у данного атома:
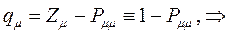
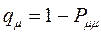
Поскольку, как было показано выше:
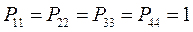
тогда соответственно:
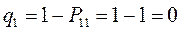
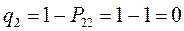
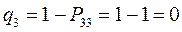
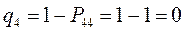
т.е. имеем:
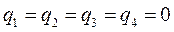
Порядок связи. Поскольку в приближении ЛКАО – МО,  - электроны делокализованны по всей молекуле, то вклад в образование
- электроны делокализованны по всей молекуле, то вклад в образование  - связи между любой парой атомов будут вносить электроны всех заполненных молекулярных орбиталей. В методе Хюккеля порядок связи вычисляют по формуле вида:
- связи между любой парой атомов будут вносить электроны всех заполненных молекулярных орбиталей. В методе Хюккеля порядок связи вычисляют по формуле вида:
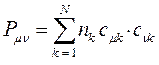
По аналогии с трактовкой 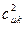 произведение орбитальных коэффициентов
произведение орбитальных коэффициентов 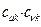 можно интерпретировать как плотность электронов, сосредоточенную между двумя атомами
можно интерпретировать как плотность электронов, сосредоточенную между двумя атомами  и
и 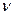 . В общем случае, в приближении Хюккеля, порядок связи будет характеризовать степень
. В общем случае, в приближении Хюккеля, порядок связи будет характеризовать степень  - электронного связывания. Воспользовавшись коэффициентами входящих в выражения для связывающих молекулярных орбиталей
- электронного связывания. Воспользовавшись коэффициентами входящих в выражения для связывающих молекулярных орбиталей 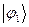 и
и 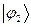 , учитывая при этом, что
, учитывая при этом, что 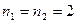 , будем иметь:
, будем иметь:
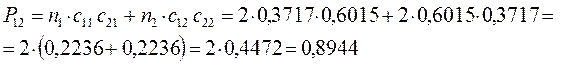
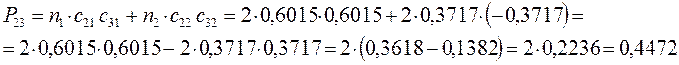
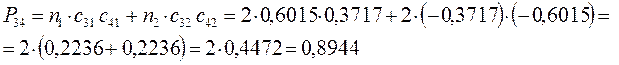
Принимая порядок локализованной 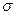 - связи равным единице
- связи равным единице 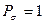 , получим полный порядок кратной
, получим полный порядок кратной 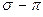 - связи, который будет равен соответственно:
- связи, который будет равен соответственно:
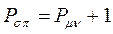
откуда следует, что:
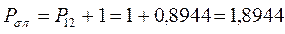
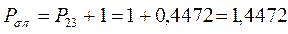
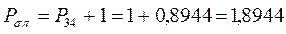
все возможные для данной системы величины 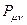 соберём в матрицу порядков связей (матрицу плотности первого порядка)
соберём в матрицу порядков связей (матрицу плотности первого порядка) 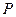 размером
размером 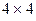 :
:
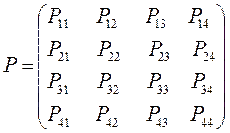
здесь диагональные элементы представляют собой электронные плотности на атомах 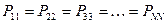 , а недиагональные – порядки связей. Как было установлено:
, а недиагональные – порядки связей. Как было установлено:
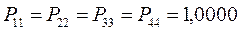
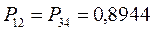
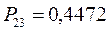
Для построения матрицы плотности первого порядка, рассчитаем также дальние порядки связей, которые для некоторых классов органических реакций могут быть использованы как индексы реакционной способности:
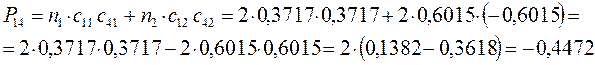
поскольку матрица порядков связей симметрична 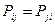 , тогда соответственно:
, тогда соответственно:
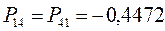
Учитывая приведенные выше данные, строим матрицу порядков связи в виде:
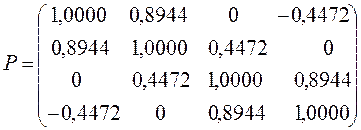
Индекс свободной валентности. Поскольку полный порядок связи 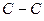 может иметь различные значения, то соответственно этому и реакционная способность атомов углерода может быть также различной. Мерой реакционной способности молекулы является индекс свободной валентности, который определяют как разность между максимально возможным полным порядком связей и реальным полным порядком связей данного атома. Индекс свободной валентности на атоме
может иметь различные значения, то соответственно этому и реакционная способность атомов углерода может быть также различной. Мерой реакционной способности молекулы является индекс свободной валентности, который определяют как разность между максимально возможным полным порядком связей и реальным полным порядком связей данного атома. Индекс свободной валентности на атоме 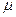 вычисляют по формуле:
вычисляют по формуле:
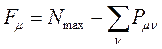
поскольку:
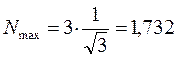
в связи с этим, при вычислениях удобно использовать формулу вида:
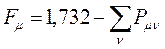
учитывая, что:
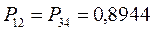
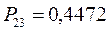
после подстановки будем иметь соответственно:
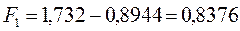
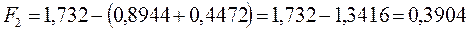
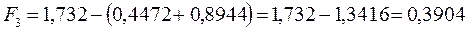
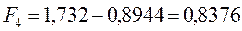
6.1.3. Гексатриен: 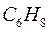
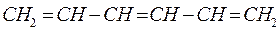
Изобразим граф рассматриваемой молекулы гексатриена и пронумеруем атомы углерода, входящие в её состав:
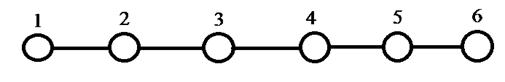
Рис. 12. Граф молекулы гексатриена.
На основании данных о молекулярном графе и виде топологической матрицы (или матрицы смежности), передающих информацию о молекулярной структуре сопряжённых и ароматических соединений, с учётом введенного орбитального параметра 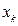 :
:
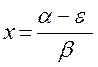
составим хюккелевский детерминант, порядок которого очевидно будет равен общему числу атомов углерода в молекуле:
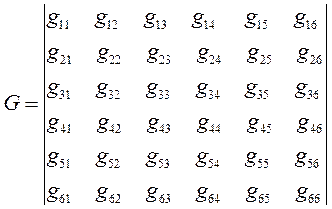
Полагая значения диагональных матричных элементов равными 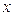 и далее, присваивая значения 1 тем недиагональным матричным элементам, которые соответствуют соседним атомам (между которыми имеет место химическая связь) и нуль тем недиагональным матричным элементам, которые отвечают несоседним атомам (между которыми химической связи нет), приходим к выражению вида:
и далее, присваивая значения 1 тем недиагональным матричным элементам, которые соответствуют соседним атомам (между которыми имеет место химическая связь) и нуль тем недиагональным матричным элементам, которые отвечают несоседним атомам (между которыми химической связи нет), приходим к выражению вида:
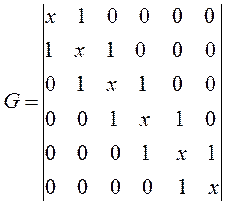
полученный таким образом детерминант приравнивают нулю, т.е. имеем:
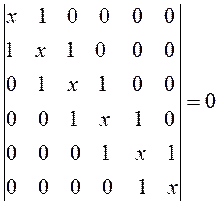
Для того чтобы раскрыть полученный в ходе проделанных выше выкладок определитель, используют самые различные подходы. Наиболее простой путь решения детерминанта такого типа является метод, основанный на получении общих решений, предложенный в своё время Ч. Коулсоном. Так, применительно к молекулам линейных полиенов – углеводородов с открытой цепью общей формулы 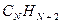 и чередующимися (альтернирующими) двойными и одинарными связями, хюккелевский детерминант как это было показано выше, будет иметь вид:
и чередующимися (альтернирующими) двойными и одинарными связями, хюккелевский детерминант как это было показано выше, будет иметь вид:
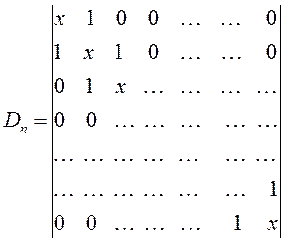
Понижение порядка детерминанта такого типа, когда число атомов углерода в молекуле полиена 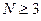 , производится на основании общей формулы вида:
, производится на основании общей формулы вида:
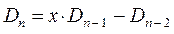
имеем:
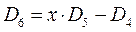
учитывая, что:
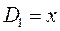
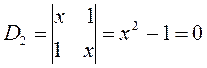
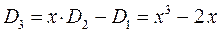
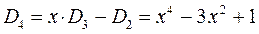
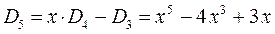
приходим для гексатриена к выражению вида:
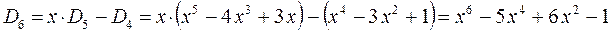
откуда следует, что:
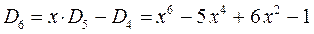
На основании общих решений векового детерминанта, рассчитаем значения орбитальных параметров, энергий и коэффициентов разложения для случая молекулы гексатриена:
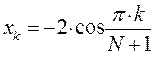
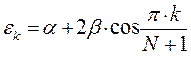
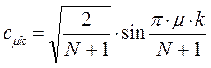
здесь 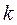 - индекс молекулярной орбитали,
- индекс молекулярной орбитали, 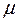 - индекс атомной орбитали и величина
- индекс атомной орбитали и величина 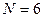 есть число атомов углерода в цепи сопряжения. Поскольку:
есть число атомов углерода в цепи сопряжения. Поскольку:
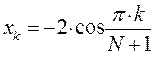
тогда после подстановки соответствующих величин, будем иметь:
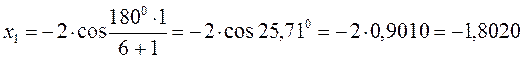
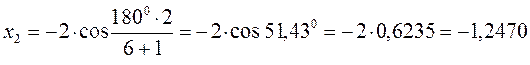
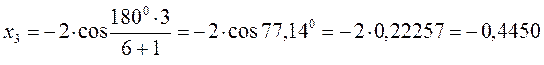
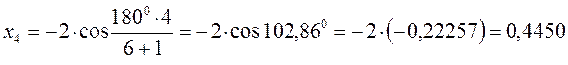
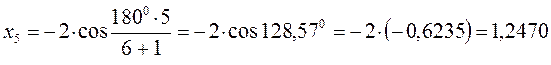
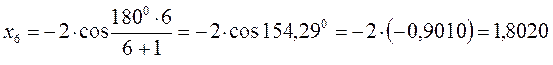
Поскольку:
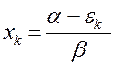
имеем:
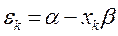
учитывая, что:
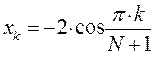
имеем:
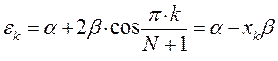
или после подстановки значений орбитальных параметров:
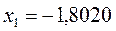
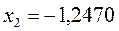
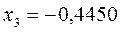
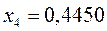
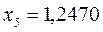
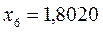
в уравнение вида:
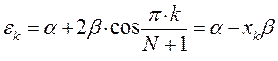
будем иметь соответственно:
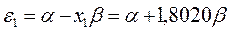
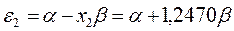
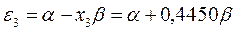
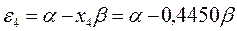
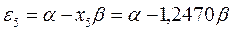
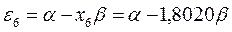
Расположение энергетических уровней связывающих и разрыхляющих молекулярных орбиталей, хорошо видно из приведенной ниже энергетической диаграммы. Как это можно заметить, последние располагаются симметирично относительно уровня несвязывающей молекулярной орбитали.
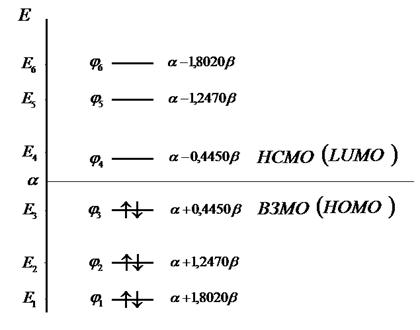
Рис.13. Диаграмма энергетических уровней молекулы
гексатриена (основное состояние).
На основании выражения вида:
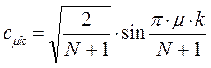
рассчитаем теперь значения орбитальных коэффициентов и построим аналитические выражения для связывающей и разрыхляющей молекулярных орбиталей гексатриена. Учитывая, разложение молекулярной орбитали 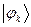 по базисному набору соответствующих атомных орбиталей
по базисному набору соответствующих атомных орбиталей 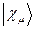 :
:
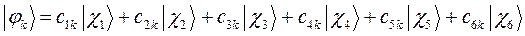
где 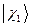 ,
, 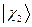 ,
, 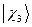 ,
, 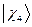 ,
, 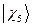 и
и 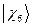 - атомные
- атомные 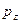 - орбитали слэйтеровского типа.
- орбитали слэйтеровского типа.
Учитывая также, что 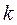 - индекс молекулярной орбитали,
- индекс молекулярной орбитали, 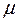 - индекс атомной орбитали и величина
- индекс атомной орбитали и величина 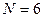 есть число атомов углерода в цепи сопряжения.
есть число атомов углерода в цепи сопряжения.
Расчитаем орбитальные коэффициенты для самой низкой в энергетическом отношении молекулярной орбитали 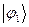 :
:
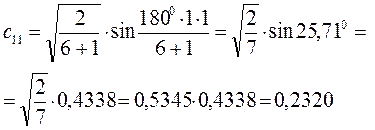
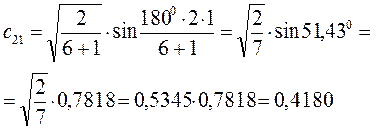
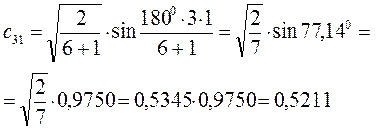
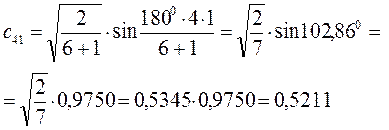
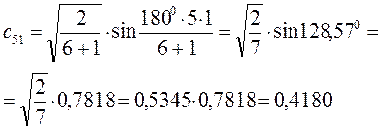
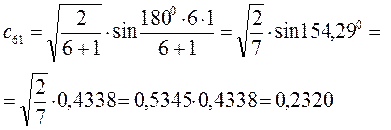
Рассчитаем теперь орбитальные коэффициенты для молекулярной орбитали  , в результате будем иметь соответственно:
, в результате будем иметь соответственно:
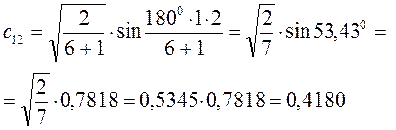
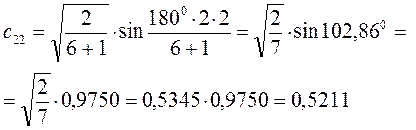
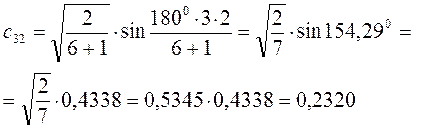
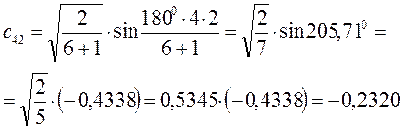
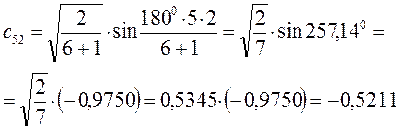
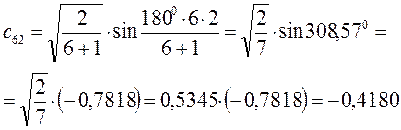
Рассчитаем теперь орбитальные коэффициенты для молекулярной орбитали  , в результате будем иметь соответственно:
, в результате будем иметь соответственно:
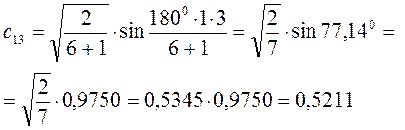
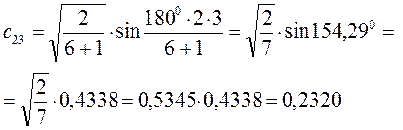
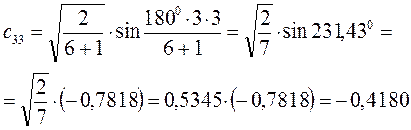
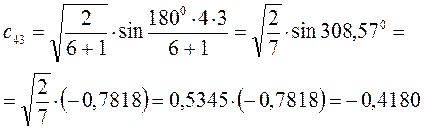
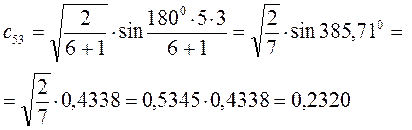
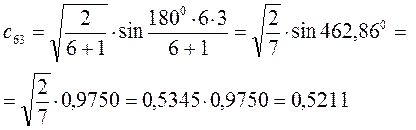
Рассчитаем орбитальные коэффициенты для молекулярной орбитали 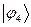 :
:
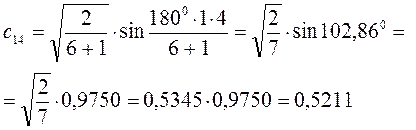
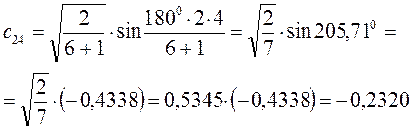
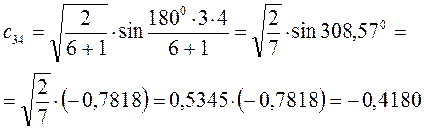
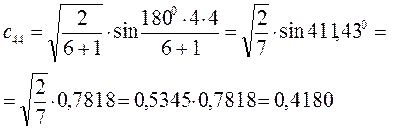
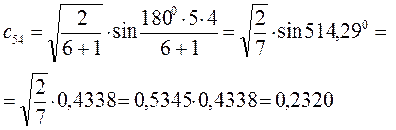
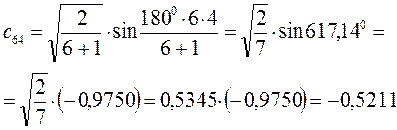
Рассчитаем орбитальные коэффициенты для молекулярной орбитали 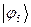 :
:
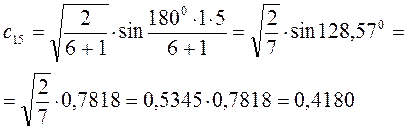
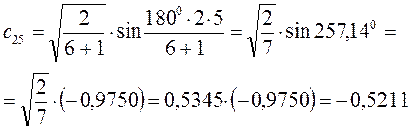
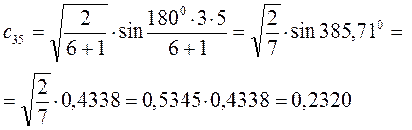
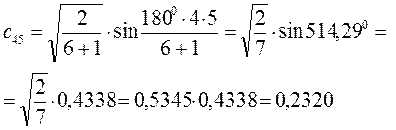
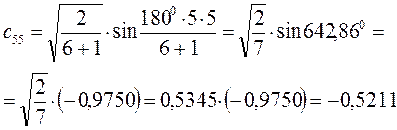
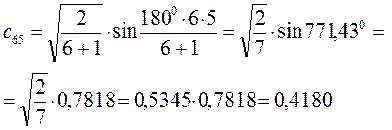
Рассчитаем орбитальные коэффициенты для молекулярной орбитали  :
:
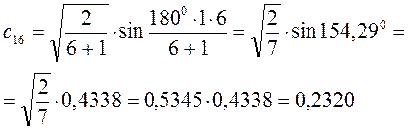
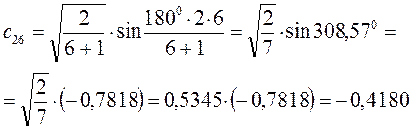
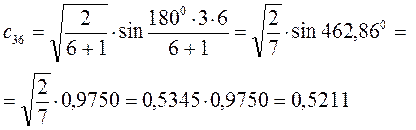
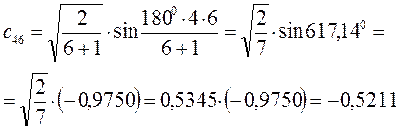
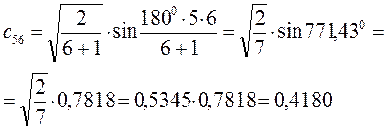
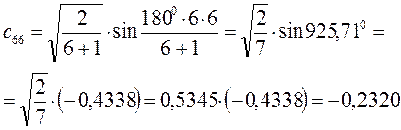
В ходе проделанных выше выкладок, приходим к выражениям для энергий и соответствующих им волновых функций связывающего и разрыхляющего состояний гексатриена, полученных в ходе решения хюккелевского детерминанта 6-го порядка  .
.
Таблица 12. Энергии связывающей и разрыхляющей молекулярных орбиталей молекулы гексатриена.
| Симметрия МО | Орбитальный параметр, 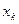 | Энергия МО, 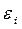 | МО, 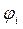 |
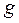 | 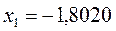 | 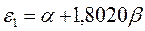 | 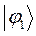 |
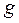 | 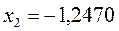 | 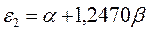 | 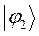 |
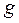 | 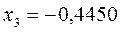 | 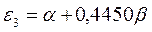 | 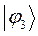 |
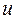 | 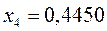 | 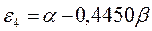 | 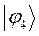 |
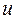 | 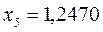 | 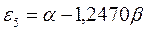 | 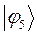 |
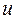 | 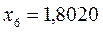 | 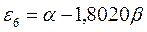 | 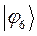 |
Таблица 13. Значения орбитальных коэффициентов.
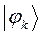 | 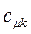 | 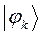 | 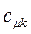 |
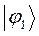 | 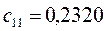 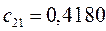 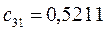 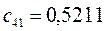 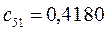 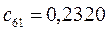 | 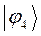 | 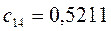 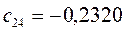 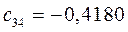 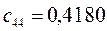 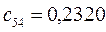 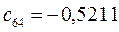 |
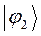 | 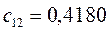 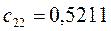 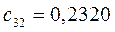 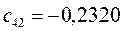 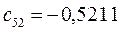 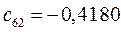 | 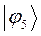 | 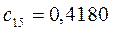 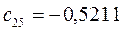 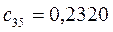 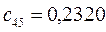 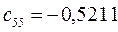 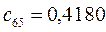 |
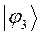 | 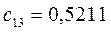 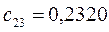 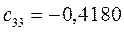 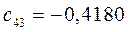 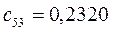 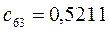 | 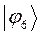 | 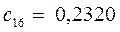 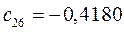 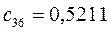 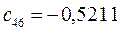 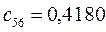 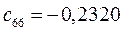 |
Учитывая разложение молекулярной орбитали 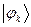 по базисному набору соответствующих атомных орбиталей
по базисному набору соответствующих атомных орбиталей 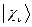 :
:
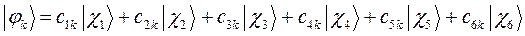
а также учитывая значения полученных выше коэффициентов разложения 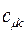 для каждой из молекулярных орбиталей, будем иметь соответственно выражения для волновых функций связывающего и разрыхляющего состояний:
для каждой из молекулярных орбиталей, будем иметь соответственно выражения для волновых функций связывающего и разрыхляющего состояний:
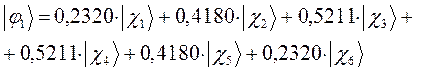
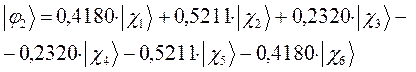
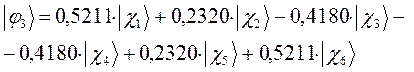
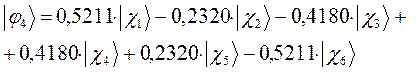
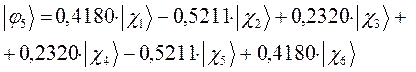
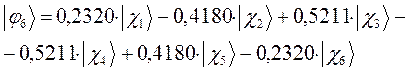
 2015-03-22
2015-03-22 1110
1110








