1) Способность к декарбоксилированию при нагревании первых гомологов – щавелевой и малоновой кислот:
t0
Н ООС ®СООН ® Н–СООН + СО2
t°
Н ООС ®СН2СООН ® СН3–СООН + СО2
Декарбоксилирование двух и трехосновных кислот характерно для многих биохимических процессов.
2) С увеличением длины цепи взаимное влияние карбоксильных групп ослабевает, и при нагревании янтарной и глутаровой кислот происходит отщепление воды и образуются циклические ангидриды. Это обусловлено образованием устойчивого 5- или 6–членного цикла.
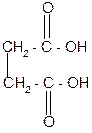 | 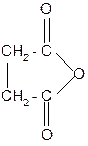 | ||
t° + Н2О
янтарная кислота янтарный
ангидрид
При дальнейшем увеличении длины цепи взаимное влияние карбоксильных групп прекращается.
2) С–Н – кислотность в малоновой кислоте.
В малоновой кислоте водородные атомы метиленовой группы –СН2– очень подвижны:
НООССН2®СООН
В эфирах малоновой кислоты они легко замещаются атомами щелочных металлов действием, например, натрия или алкоголята натрия с образованием натрий – малонового эфира:
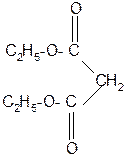

 -
-
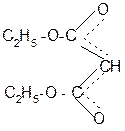 |
 + NaOR Na+
+ NaOR Na+
-ROH
С помощью натрий-малонового эфира можно синтезировать одно- и многоосновные кислоты.
Например:
 |  |
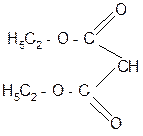
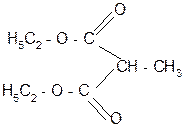
CH3J

 -
-
Na+ - NaJ гидролиз
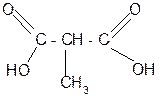 | |||
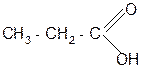 | |||
Н2О/Н+ t° + СО2

- 2 С2Н5ОН декарбокси- пропановая
лирование кислота
метилмалоновая
кислота
Тема 5. Липиды
Цель занятия: сформировать представление о структуре, свойствах и биологических функциях липидов; научиться устанавливать взаимосвязь между их химическим строением и свойствами.
 2015-04-30
2015-04-30 543
543








