Периодическая таблица и электронные конфигурации атомов. В настоящее время известно более 500 вариантов изображения периодической системы: это различные формы передачи периодического закона.
Первым вариантом системы элементов, предложенным Д. И. Менделеевым 1 марта 1869 г., был так называемый вариант длинной формы. В этом варианте периоды располагались одной строкой. В декабре 1870 г. он опубликовал второй вариант периодической системы — так называемую короткую форму. В этом варианте периоды разбиваются на ряды, а группы — на подгруппы (главную и побочную).
В периодической системе по горизонтали имеется 7 периодов, из них первые три называются малыми, а остальные — большими. В первом периоде находится 2 элемента, во втором и третьем — по 8, в четвертом и пятом — по 18, в шестом — 32, в седьмом (незавершенном) — 21 элемент. Каждый период, за исключением первого” начинается щелочным металлом и заканчивается благородным газом (7-й период — незаконченный).
Все элементы периодической системы пронумерованы в том порядке, в каком они следуют друг за другом. Номера элементов называются порядковыми или атомными номерами.
|
|
|
В системе 10 рядов. Каждый малый период состоит из одного ряда, каждый большой период — из двух рядов: четного (верхнего) и нечетного (нижнего). В четных рядах больших периодов (четвертом, шестом, восьмом и десятом) находятся одни металлы, и свойства элементов в ряду слева направо изменяются слабо. В нечетных рядах больших периодов (пятого, седьмого и девятого) свойства элементов в ряду слева направо изменяются, как у типических элементов
Основным признаком, по которому элементы больших периодов разделены на два ряда, является их степень окисления. Их одинаковые значения дважды повторяются в периоде с ростом атомных масс элементов. Например, в четвертом периоде степени окисления элементов от К до Mn изменяются от +1 до +7, затем следует триада Fe, Со, Ni (это элементы четного ряда), после чего наблюдается такое же возрастание степеней окисления у элементов от Cu до Br (это элементы нечетного ряда). То же мы видим в остальных больших периодах, исключая седьмой, который состоит из одного (четного) ряда. Дважды повторяются в больших периодах и формы соединений элементов.
В шестом периоде вслед за лантаном располагаются 14 элементов с порядковыми номерами 58-71, называемых лантаноидами (слово “лантаноиды” означает подобные лантану”, а “актиноиды” — “подобные актинию”). Иногда их называют лантанидами и актинидами, что означает следующие за лантаном, следующие за актинием). Лантаноиды помещены отдельно внизу таблицы, а в клетке звездочкой указано на последовательность их расположения в системе: La-Lu. Химические свойства лантаноидов очень сходны. Например, все они являются реакционно-способными металлами, реагируют с водой с образованием гидроксида и водорода. Из этого следует, что у лантаноидов сильно выражена горизонтальная аналогия.
|
|
|
В седьмом периоде 14 элементов с порядковыми номерами 90-103 составляют семейство актиноидов. Их также помещают отдельно — под лантаноидами, а в соответствующей клетке двумя звездочками указано на последовательность их расположения в системе: Ас-Lr. Однако в отличие от лантаноидов горизонтальная аналогия у актиноидов выражена слабо. Они в своих соединениях проявляют больше различных степеней окисления. Например, степень окисления актиния +3, а урана +3, +4, +5 и +6. Изучение химических свойств актиноидов крайне сложно вследствие неустойчивости их ядер.
В периодической системе по вертикали расположены восемь групп (обозначены римскими цифрами). Номер группы связан со степенью окисления элементов, проявляемой ими в соединениях. Как правило, высшая положительная степень окисления элементов равна номеру группы. Исключением являются фтор — его степень окисления равна -1; медь, серебро, золото проявляют степень окисления +1, +2 и +3; из элементов VIII группы степень окисления +8 известна только для осмия, рутения и ксенона.
В VIII группе размещены благородные газы. Ранее считалось, что они не способны образовывать химические соединения.
Каждая группа делится на две подгруппы — главную и побочную, что в периодической системе -подчеркивается смещением одних вправо, а других влево. Главную подгруппу составляют типические элементы (элементы второго и третьего периодов) и сходные с ними по химическим свойствам элементы больших периодов. Побочную подгруппу составляют только металлы— элементы больших периодов. VIII группа отличается от остальных. Кроме главной подгруппы гелия она содержит три побочные подгруппы: подгруппу железа, подгруппу кобальта и подгруппу никеля.
Химические свойства элементов главных и побочных подгрупп значительно различаются. Например, в VII группе главную подгруппу составляют неметаллы F, С1, Вг, I, Аt, побочную — металлы Мn, Тc, Rе. Таким образом, подгруппы объединяют наиболее сходные между собой элементы.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения; существует всего 8 форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RО, R2O3, RO2, R2O5, RО3, R2O7, RO4, где R — элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы (главной и побочной), кроме тех случаев, когда элементы не проявляют степени окисления, равной номеру группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения, форм таких соединений 4. Их также изображают общими формулами в последовательности RН4, RН3, RН2, RН. Формулы водородных соединений располагаются под элементами главных подгрупп и только к ним относятся.
Свойства элементов в подгруппах закономерно изменяются: сверху вниз усиливаются металлические свойства и ослабевают неметаллические. Очевидно, металлические свойства наиболее сильно выражены у франция, затем у цезия; неметаллические — у фтора, затем — у кислорода.
Наглядно проследить периодичность свойств элементов можно и исходя из рассмотрения электронных конфигураций атомов.
Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. По числу энергетических уровней в электронной оболочке атома элементы делятся на семь периодов. Первый период состоит из атомов, в которых электронная оболочка состоит из одного энергетического уровня, во втором периоде — из двух, в третьем — из трех, в четвертом — из четырех и т. д. Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень.
|
|
|
В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем Уровне имеют2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов.
Далее мы видим, что внешние электронные оболочки сходны у атомов элементов (Li, Na, К, Rb, Cs); (Ве, Mg, Са, Sr); (F, Сl, Вг, I); (Не, Nе, Аг, Kr, Хе) и т. д. Именно поэтому каждая из вышеприведенных групп элементов оказывается в определенной главной подгруппе периодической таблицы: Li, Na, К, Rb, Cs в I группе, F, Сl, Вг, I — в VII и т. д. Именно вследствие сходства строения электронных оболочек атомов сходны их физические и химические свойства.
Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на d-подуровне и равно 10 в каждом из больших периодов.
Поскольку в периодической системе химических элементов Д. И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам (так называемые триады Fe-Со-Ni, Ru-Rh-Pd, Os-Ir-Pt), то число побочных подгрупп, так же как и главных, равно 8.
По аналогии с переходными элементами число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на f-подуровне, т. е. 14.
Период начинается элементом, в атоме которого на внешнем уровне находится один s-электрон: в первом периоде это водород, в остальных — щелочные металлы. Завершается период благородным газом: первый — гелием (1s2), остальные периоды — элементами, атомы которых на внешнем уровне имеют электронную конфигурацию ns2np6.
|
|
|
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делят на четыре типа (семейства).
1. s-Элементы: заполняется электронами s-подуровень внешнего уровня. К ним относятся первые два элемента каждого периода.
2. р-Элементы: заполняется электронами р-подуровень внешнего уровня. Это последние 6 элементов каждого периода (кроме первого и седьмого).
3. d-Элементы: заполняется электронами d-подуровень второго снаружи уровня, а на внешнем уровне остается один или два эле трона (у Pd — нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s- и р-элементами (их также называют переходными элементами).
4. f-Элементы: заполняется электронами f-подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Это лантаноиды и актиноиды.
Таким образом, строгая периодичность расположения элементов в периодической системе химических элементов Д. И. Менделеева полностью объясняется последовательным характером заполнения энергетических уровней.
Выводы:
Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание положительных зарядов атомных ядер от 1 до 107 обусловливает периодическое повторение строения внешнего энергетического уровня. А поскольку свойства элементов в основном зависят от числа электронов на внешнем уровне, то и они периодически повторяются. В этом — физический смысл периодического закона.
В свете учения о строении атомов становится обоснованным разделение Д.И. Менделеевым всех элементов на семь периодов. Номер периода соответствует числу энергетических уровней атомов, заполняемых электронами. Поэтому s-элементы имеются во всех периодах, р-элементы — во втором и последующих, d-элементы — в четвертом и последующих и f-элементы — в шестом и седьмом периодах.
Различия в строении обусловливают и различия в свойствах элементов разных подгрупп одной группы. Так, на внешнем уровне атомов элементов подгруппы галогенов имеется по семь электронов подгруппы марганца — по два электрона. Первые — типичные неметаллы, а вторые — металлы.
Отсюда же следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом — физический смысл номера группы.
Итак, строение атомов обусловливает две закономерности: 1) изменение свойств элементов по горизонтали — в периоде слева право ослабляются металлические и усиливаются неметаллические свойства; 2) изменение свойств элементов по вертикали — в подгруппе с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические. В таком случае элемент (и клетка системы) находится на пересечении горизонтали и вертикали, что определяет его свойства. Это помогает находить и писывать свойства элементов, изотопы которых получают искусственным путем.
Значение П.С.Э. продолжает играть огромную роль в развитии естествознания. Она явилась важнейшим достижением атомно-молекулярного учения, позволила дать современное определение понятия "химический элемент" и уточнить понятия о простых веществах и соединениях. Закономерности, вскрытые П. с. э., оказали существенное влияние на разработку теории строения атомов, способствовали объяснению явления изотонии. С П. с. э. связана строго научная постановка проблемы прогнозирования в химии, что проявилось как в предсказании существования неизвестных элементов и их свойств, так и в предсказании новых особенностей химического поведения уже открытых элементов. П. с. э.- фундамент химии, в первую очередь неорганической; она существенно помогает решению задач синтеза веществ с заранее заданными свойствами, разработке новых материалов, в частности полупроводниковых, подбору специфических катализаторов для различных химических процессов и т.д. П. с. э.- также научная основа преподавания химии.
2. Предельные углеводороды, общая формула гомологов данного ряда, электронное и пространственное строение.
Химические свойства метана
Предельные углеводороды, или алканы – это соединения, состав которых выражается общей формулой C n H2 n +2, где n – число атомов углерода. В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы также называют насыщенными углеводородами, или парафинами.
Первым членом гомологического ряда алканов является метан CH4.Окончание -ан является характерным для названий предельных углеводородов. Далее следуют этан C2H6,пропан С3H8,бутан С4H10.Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания - ан. Это пентан C5H12,гексан C6H14,гептан C7H16,октан C8H18,нонан C9H20,декан C10H22и т.д.
В предельных углеводородах атом углерода находится в состоянии sp 3-гибридизации. Это означает, что у него имеются четыре одинаковые sp 3-гибридные орбитали, способные образовывать четыре 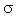 -связи: (сигма – связи)
-связи: (сигма – связи)
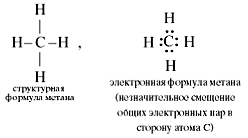
Но молекула метана в действительности имеет тетраэдрическую форму, а не плоскую.
Атом углерода в основном состоянии имеет два неспаренных электрона (двухвалентен), в возбужденном состоянии – четыре (четырехвалентен):
С – 1 s 22 s 22 p 2, С* – 1 s 22 s 12 p 3.
Следовательно, в возбужденном состоянии атом углерода может присоединять четыре атома водорода:
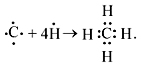
В молекуле метана у атома углерода подвергаются гибридизации (т.е. взаимному выравниванию) одна s - и три p -орбитали. Эти орбитали после гибридизации располагаются в пространстве так, что их оси оказываются направленными к вершинам тетраэдра. Валентный угол между осями гибридных орбиталей составляет 109о28'.Поскольку в гибридизации участвуют 1 s -электрон и 3 p -электрона, то такой ее вид называется sp 3- гибридизацией. В результате перекрывания четырех гибридных sp 3-орбиталей атомауглерода и s -орбиталей четырех атомов водорода образуется прочная молекула метана с четырьмя одинаковыми связями.
Электронное и пространственное строение других представителей предельных углеводородов сходно со строением молекулы метана.
В молекуле этана C2H6химическая связь образуется между С-атомами перекрыванием двух гибридных электронных облаков.
В связи с тем, что гибридные электронные облака С направлены к вершинам тетраэдра, при образовании молекулы пропана C3H8углеродная цепь принимает зигзагообразную форму.
В гомологическом ряду каждый последующий углеводород отличается от предыдущего группой атомов CH2 (гомологической разностью).
С ростом молекулярной массы возрастает плотность алканов. Низшие алканы – метан, этан, пропан, бутан – газы, с C5H12до C16H34 – жидкости, а с C17H36 – твердые вещества. С ростом молекулярной массы алканов возрастают температуры их кипения и плавления. При одинаковом числе атомов углерода в молекуле алканы с разветвленным строением имеют более низкие температуры кипения, чем нормальные алканы.
Алканы практически нерастворимы в воде, т.к. их молекулы малополярны и не взаимодействуют с молекулами воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких, как бензол, тетрахлорметан и др.
При обычных условиях предельные углеводороды химически малоактивны. На них не действуют (при обычной температуре) даже концентрированные растворы щелочей, а также кислоты и окислители. Алканы не вступают в реакции присоединения. Все реакции с их участием можно подразделить на два типа: реакции с разрывом связей C–H (реакции замещения) и реакции с разрывом связей C–C,при которых происходит расщепление молекул на отдельные осколки (крекинг).
Свойства алканов рассмотрим на примере метана.
Метан – газ без цвета и запаха, почти в два раза легче воздуха, малорастворим в воде.
 2015-05-13
2015-05-13 3204
3204