Теория к коллоквиуму по молекулярной физике и термодинамике.
(Основная часть соответствует методичке к лабораторной работе № 67. Есть дополнительный материал. Ориентируйтесь на вопросы к коллоквиуму).
Молекулярная физика. Термодинамика
В отличие от механики, которая изучает движение отдельных частиц или тел под действием различных сил, молекулярная физика имеет дело со свойствами вещества. Как показывает опыт, всякое вещество состоит из большого числа отдельных микроскопических частиц — атомов и молекул, которые взаимодействуют между собой и находятся в непрестанном движении. Такая система частиц называется макроскопической.
Можно выделить три наиболее характерных состояния, в которых может находиться вещество, — твердое, жидкое и газообразное. Свойство тела находиться в одном из этих состояний есть его макроскопическое свойство, не зависящее от свойств отдельных частиц, образующих тело. Например, железо может существовать в кристаллическом состоянии (в виде твердого тела) или пребывать в расплавленном состоянии (в виде жидкости), или испаряться в виде газа, хотя при переходе из одного состояния в другое с самими атомами железа не происходит никаких изменений. Макроскопическими являются также свойства вещества по отношению к внешним воздействиям, например, сжимаемость. Другими словами, макроскопические свойства — это свойства тела, рассматриваемые без учета его внутренней структуры. Задача молекулярной физики — объяснение и изучение макроскопических свойств вещества исходя из известных микроскопических взаимодействий между отдельными составляющими его частицами.
Основные определения и законы молекулярно-кинетической теории идеальных газов.
Идеальный газ - это газ, удовлетворяющий следующим условиям:
1) собственный объём молекул газа пренебрежимо мал по сравнению с объёмом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие;
Состояние данной массы газа 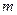 характеризуют параметры: давление
характеризуют параметры: давление 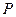 , объём
, объём 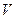 , температура
, температура 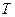 . Связь между термодинамической температурой T и температурой по стоградусной шкале Цельсия имеет вид T = t+273,15 °С.
. Связь между термодинамической температурой T и температурой по стоградусной шкале Цельсия имеет вид T = t+273,15 °С.
Законы описывающие поведение идеальных газов:
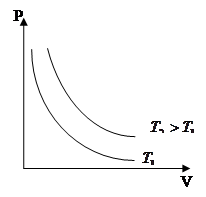
Для данной массы газа при постоянной температуре произведение давления газа на его объём есть величина постоянная:
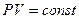 при
при 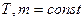
Процесс, протекающий при постоянной температуре, называется изотермическим.
Законы Гей-Люссака:
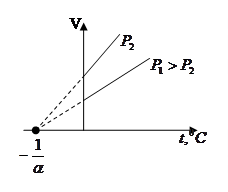
1) Объём данной массы газа при постоянном давлении изменяется линейно с температурой:
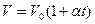 при
при 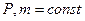
Процесс, протекающий при постоянном давлении, называется изобарным.
2) 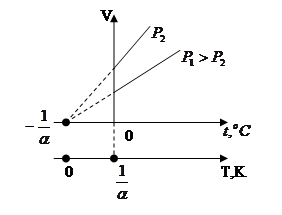 Давление данной массы газа при постоянном объёме изменяется линейно с температурой:
Давление данной массы газа при постоянном объёме изменяется линейно с температурой:
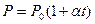 при
при 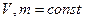
Процесс, протекающий при постоянном объёме, называется изохорным.
В этих уравнениях t - температура по шкале Цельсия, Vo¸Po - объём и давление при 0 ºC, α=1/273,15 K-¹.
Вводя термодинамическую температуру, законам Гей-Люссака можно придать вид:
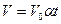 ,
, 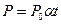 или
или
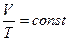 при
при 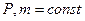 ;
; 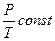 при
при 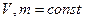
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объёмы. При нормальных условиях
(P = 1,013×105 Па; T = 273,15 K) этот объём равен 22,41×10-3 м3/моль.
В одном моле различных веществ содержится одно и тоже число молекул, называемое постоянной Авагадро: NA =6,022×1023 моль-1
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в неё газов, т.е.
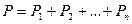
где 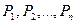 - парциальные давления - давления, которые оказывали бы газы смеси, если бы они одни занимали объём, равный объёму смеси при той же температуре.
- парциальные давления - давления, которые оказывали бы газы смеси, если бы они одни занимали объём, равный объёму смеси при той же температуре.
Уравнение состояния идеального газа - уравнение Клайперона-Менделеева:
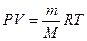 ,
,
где 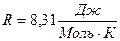 - молярная газовая постоянная,
- молярная газовая постоянная,
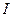 - молярная масса,
- молярная масса, 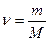 - число молей,
- число молей, 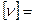 моль.
моль.
Часто пользуются несколько иной формой уравнения состояния идеального газа, введя постоянную Больцмана 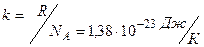
Умножим и разделим правую часть уравнения на число Авогадро:
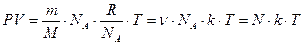
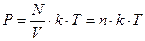 , где
, где 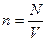 -
-
концентрация молекул.
Итак, уравнение состояния идеального газа: 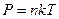 .
.
Основное уравнение молекулярно-кинетической теории газов:
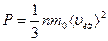 ,
,
где 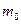 - масса одной молекулы идеального газа,
- масса одной молекулы идеального газа, 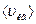 - средняя квадратичная скорость.
- средняя квадратичная скорость.
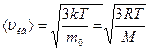
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа:
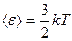
Из этого уравнения следует, что при 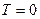 , т.е. при
, т.е. при 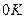 прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа.
прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа.
 2015-07-21
2015-07-21 4026
4026