Закон Авогадро. Запишем для двух: газов уравнения (7.10) при одинаковых  и
и 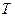 , занимающих одинаковые объемы.
, занимающих одинаковые объемы.  ;
;  . Отсюда следует
. Отсюда следует  , т.е. в одинаковых объемах при одинаковых
, т.е. в одинаковых объемах при одинаковых  и
и 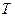 содержится одинаковое число молекул.
содержится одинаковое число молекул.
Число молекул в объеме одного моля называется числом Авогадро  . Оно равно
. Оно равно  1/моль.
1/моль.
Уравнение Менделеева-Клапейрона. Число молекул 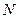 в газа можно записать как
в газа можно записать как  , где
, где 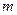 - масса газа;
- масса газа;  - молекулярная масса;
- молекулярная масса;  - число молей. Тогда уравнение состояния будет:
- число молей. Тогда уравнение состояния будет:
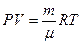 , (7.11)
, (7.11)
где  - газовая постоянная. Используя значения
- газовая постоянная. Используя значения 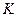 и
и  , найдем:
, найдем:

 (7.12)
(7.12)
При  (7.11) получаем
(7.11) получаем  - закон Бойля-Мариотта,
- закон Бойля-Мариотта,
при  ; при
; при  . Если
. Если 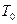 - температура замерзания воды, а вместо
- температура замерзания воды, а вместо  использовать
использовать  , то записанные соотношения примут вид:
, то записанные соотношения примут вид:  при
при  - закон Гей-Люссака и
- закон Гей-Люссака и  при
при  - закон Шарля.
- закон Шарля.
Закон Дальтона. Если имеем смесь газов, то  . Так как молекулы каждой компоненты газа занимают весь объем,
. Так как молекулы каждой компоненты газа занимают весь объем,  и,
и,  (7.13)
(7.13)
т.е. давление смеси газов равно сумме парциальных давлений.
| Лекция 10 | Распределение Максвелла для молекул идеального газа по скоростям и энергиям. |
| Распределение Больцмана. Барометрическая формула. Опыт Перрена. |
 2015-10-22
2015-10-22 1584
1584








