Молекулярность – это числа частиц, которые участвуют в одном элементарном хим. акте. Бимолекулярная р-ия – H2(г)+I2(г)=2HI(г); тримолекулярная – 2NO(г)+Cl2(г)=2NOCl(г). Порядок р-ии – это сумма показателей степеней при концентрациях реагирующих в-в, входящих в кинетическое уравнение: 2SO2+)2<=>2SO3, V=k[SO2]^2*[O2], n=2+1=3 => порядок р-ии = 3, молекулярноть = 3. Порядок может быть = 0, если V=const и не зависит от концентрации реаг. В-в. Нулевой порядок:  =
= 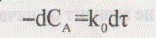 =
=  =
=  =
= 
Первый порядок: 

Энергия активации. Уравнение Аррениуса
Энергия активации (Еа) – это та энергия, которую должны накопить нормальные молекулы, чтобы иметь возможность прореонировать.. Ур-е Аррениуса:  Ea- эн.акт., A – предэксп. Множ.
Ea- эн.акт., A – предэксп. Множ.
Для расчета Еа по эксперим. Данным использую ур-е Аррениуса в логарифмическом виде: 
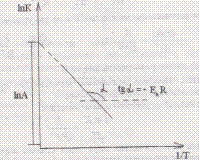
Значение. Е находят по тангенсу угла наклона.


Теория активных соударений: Число эл. Актов р-ии А+В в единице объема пропорционально число столкновений Z между частицами А и В в единицу времени. Чтобы при столкновении произошла р-ия, необходимо, чтобы сталкивающиеся молекулы обладали нек. Запасом кин.эн., необх. Для ослабления или разрыва связи в этих молекулах. Такие столкновения называют активными.
 2017-11-01
2017-11-01 1855
1855
