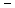В коническую колбу на 250 мл помещают 20 г воздушно-сухой почвы и приливают 50 мл 10 %-ной уксусной кислоты (или 0,1 н HCl), перемешивают в течении 2 – 3 минут и оставляют на 30 минут. Почву отфильтровывают, используя складчатый фильтр. В две мерные колбы на 50 мл вносят пипеткой по 2 мл полученного фильтрата (объем пробы может быть уменьшен до 1 мл или увеличен до 5 мл по указанию преподавателя в зависимости от минерализации почвы). В каждую колбу вносят по 5 мл растворов ванадата аммония, молибдата аммония и азотной кислоты. Доводят объём жидкости в колбах до метки дистиллированной водой, перемешивают и оставляют на 30 мин. Измеряют оптическую плотность растворов при l=440 нм по отношению к дистиллированной воде в кюветах толщиной 10 мм. Получают значения А1 и А2. Находят эти значения на оси ординат калибровочного графика и определяют концентрацию фотометрированных растворов С1 и С2. Для дальнейшего расчёта используют среднее значение:
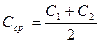 , мг Р/мл.
, мг Р/мл.
Содержание фосфора в почве рассчитывают по формуле:
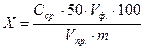 ,мг Р на 100г почвы,
,мг Р на 100г почвы,
где: 50 – объём мерной колбы, мл;
Vпр. – объем пробы фильтрата, взятый для анализа, мл;
Vф. – объём раствора кислоты, взятый для экстракции фосфатов из почвы, мл;
m – масса почвы, г.
(Русин, 1990; Коренман, 1982)
Контрольные вопросы
1. Что называют градуировочным графиком? Каким образом и с какой целью его строят?
2. Какие основные пути поступления и эвакуации фосфора в почвенном покрове?
3. В чем заключается негативный эффект повышенного содержания фосфора в почве?
4. Какие соединения фосфора можно определить фотометрическим методом?
1. Акимова Т.А. Экология: Человек – Экономика – Биота – Среда/ Т.А. Акимова, В.В. Хаскин; учебник для вузов. – 2-е изд., перераб. И доп. – М.: ЮНИТИ – ДАНА, 2000. – 566 с.
2. Амбросова Г.Т., Меркель О.М., Бойко Т.А., Хвостова Е.В.Удаление фосфора из городских сточных вод.// Водоснабжение и водоотведение: качество и эффективность. Труды V Международной научно-практической конференции – Кемерово: ОАО «КемВод», СибГИУ, ЗАО «Экспо-Сибирь», 2002.
3. Алексеев Ю.В. Тяжелые металлы в почвах и растениях.-Л.: Агропромиздат, 1987, 142 с.
4. Андруз Дж., Бримблекумб П., Джикелз Т., Лисс П. Введение в химию окружающей среды. Пер. с англ.- М.: Мир, 1999.- 271 с., ил.
5. Ахмадеев В.В., Волков С.В., Костюченко С.В., Красногуб А.В., Кудрявцев Н.Н., Якименко А.В. Применение метода УФ облучение для обеззараживания сточных вод.// Вода и экология: проблемы и решения: С.-Пб., 2000, №2.
6. Безуглова О.С., Орлов Д.С. Биогеохимия. Учебник для студентов высших учебных заведений. Серия «Учебники, учебные пособия». – Ростов н/Д: «Феникс», 2000.- 320 с.
7. Бернал Дж. Возникновение жизни/ Дж. Бернал; Пер. с англ. И.Б. Бухвалова, Ю.И. Лашкевича, К.А. Любарского; Под ред. А.И. Опарина.-М.: Мир, 1969. – 392 с.
8. Берчфил Б.К. Континентальная кора/ Б.К. Берчфил// В мире науки. – 1983.-№11. – с.60-72.
9. Богданов И. Дым отечества, или Краткая история табакокурения. /Новое литературное обозрение, 2007.
10. Ванюшина А.Я., Кутепов В.В., Данилович Д.А., Козлов М.Н., Мухин В.А., Афанасьев Р.А., Мерзлая Г.Е. Компостирование сброженного осадка Курьяновской станции аэрации.//Водоснабжение и санитарная техника: ООО «Издательство ВСТ», 2002, №12.
11. Вернадский В.И. Биосфера и ноосфера/ В.И. Вернадский. – М.: Айрис-пресс, 2004. – 576 с.
12. Виноградов Л.П. Основные закономерности в распределении микроэлементов между растением и средой.//Микроэлементы в жизни растений и животных, М.:Изд-во АН СССР, 1982, с.7-20.
13. Возная Н.Ф. Химия воды и микробиология: Учебное пособие для вузов. – 2-е изд., перераб. и доп. – М.: Высшая школа, 1979. – 340 с., ил.
14. Войткевич Г.В. Основы теории происхождения Земли/Г.В. Войткевич.-2-е изд., перераб. И доп.-М.:Недра, 1988.-112 с.
15. Войтович Н.В. Плодородие почв Нечерноземной зоны и его моделирование./М., Колос, 1997, с.45.
16. Гадаскина И. Д. Яды – вчера и сегодня: Очерки по истории ядов / И. Д. Гадаскина, Н. А. Толоконцев; Под ред. В. А. Филова. – Л.: Наука, 1988. – 204 с.
17. Гарин В. М. Экология для технических вузов // В. М. Гарин, И. А. Кленова, В. И. Колесников; Под ред. В. И. Колесникова. – Ростов–на–Дону: Феникс, 2001. – 384 с.
18. Герасимов И.П. Научные основы современного мониторинга окружающей среды // Изв. АН СССР. Сер. географ. 1975. №3. С.13-25.
19. Глинка Н.Л. Задачи и упражнения по общей химии: Учебное пособие для вузов/Под ред. В.А.Рабиновича и Х.М.Рубиной. При участии Т.Е. Алексеевой, Н.Б. Платуновой, В.А. Рабиновича, Х.М. Рубинной, Т.Е.Хрипуновой.-М.:Интеграл-Пресс, 2006.-240 с.
20. Глинка Н.Л. Общая химия: Учебное пособие для вузов/ Под ред. А.И. Ермакова.-изд. 30-е, исправленное – М.: Интеграл-Пресс, 2007.- 728 с.
21. Голубовская Э.К. Биологические основы очистки воды. – М.: Высшая школа, 1978.
22. Губанов Л.Н., Филин В.А., Бояркин Д.В., Котов А.В. Особенности использования осадков городских сточных вод в качестве почвоулучшающей добавки. // Вода и экология: проблемы и решения: С.-Пб., 2004, №1.
23. Гумен С.Г., Малышев А.В., Медведев Г.П. Обезвоживание осадков городских сточных вод на центрифугах. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №4.
24. Гюнтер Л.И. Беляева С.Д., Тавризова О.А., Короткова Е.В. Экологически безопасные приёмы обработки и размещения осадков городских сточных вод в окружающей среде.// Чистый город: Академия коммунального хозяйства, 2000, №4(12), октябрь – декабрь.
25. Гусакова Н.В. Химия окружающей среды. Серия «Высшее образование». Ростов-на-Дону: Феникс, 2004.-192 с.
26. Джинлоз Р. Земное ядро/ Р. Джинлоз// В мире науки. – 1983. - № 11. – с.16-27.
27. Ершов Ю.А., Попков В.А., Берлянд А.С. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для вузов; Под ред. Ю.А. Ершова. – 4-е изд., стер.- М.: Высш. шк., 2003.-560 с.: ил.
28. Зилов Е.А. Химия окружающей среды: Учебное пособие / Е. А. Зилов. – Иркутск: Иркут. ун-т, 2006. – 148 с., ил.
29. Иванов В.Г., Хямяйляйнен М.М. Обеззараживание. Альтернатива традиционным методам. // Вода и экология: проблемы и решения: С.-Пб., 2000, №1.
30. Израэль Ю. А. Антропогенная экология океана / Ю. А. Израэль, А. В. Цыбань. – Л.: Гидрометеоиздат, 1989. – 528 с.
31. Ильин В.Б. Тяжелые металлы в системе почва-растение.-Новосибирск, Наука, 1991, 150 с.
32. Ингерсол Э. П. Атмосфера Земли / Э. Ингерсол // В мире науки. – 1983. – № 11. – С. 88–100.
33. Жмур Н.С. Интенсификация процессов удаления соединений азота и фосфора из сточных вод. - М.: АКВАРОС, 2001.-94 с. -ISBN 5-901652-04-5.
34. Жмур Н.С. Методы санитарно-биологического контроля.//Методическое руководство по гидробиологическому контролю нитчатых микроорганизмов активного ила. -М.: АКВАРОС, 1996.
35. Жмур Н.С. Технологические и биохимические процессы очистки сточных вод на сооружениях с аэротенками. - М.: АКВАРОС, 2003.-512 с. -ISBN 5-901652-05-3.
36. Жмур Н.С. Управление процессом и контроль результата очистки сточных вод на сооружениях с аэротенками. - М.: Луч, 1997.-172 с.
37. Журавлёва В.И., Бабкин В.Ф., Журавлев В.Д. Перспективный способ утилизации всех видов осадков станций аэрации в виде товарной продукции.// Водоснабжение и водоотведение: качество и эффективность. Труды V Международной научно-практической конференции – Кемерово: ОАО «КемВод», СибГИУ, ЗАО «Экспо-Сибирь», 2002.
38. Заварзин Г.А. Лекции по природоведческой микробиологии/ Г.А. Заварзин. – М.: Наука, 2003. – 348 с.
39. Заварзин Г.А. Становление биосферы/ Г.А. Заварзин // Вестник РАН. – 2001. – Т. 71, № 11. – с. 988-1001.
40. Заварзин Г.А. Эволюция геосферно-биосферной системы/ Г.А. Заварзин // Природа. – 2003. –№ 1. – с. 27-35.
41. Кабата-Пендиас А. Пендиас Х. Микроэлементы в почвах и растениях./М.: Мир, 1989, 439 с.
42. Клауд П. Биосфера/ П. Клауд // В мире науки. – 1983.- № 11.- с. 102-113.
43. Коренман И.М.. Фотометрический анализ. – М:Химия. 1982.
44. Коростелев П.П.. Лабораторная техника химического анализа. – М:Химия. 1982.
45. Кондратьев К. Я. Экодинамика и геополитика. Т. 1. Глобальные проблемы / К. Я. Кондратьев, В. К. Донченко. – СПб, 1999. – 1032 с.
46. Корте Ф., Бахадир М., Клайн В., Лай Я.П., Парлар Г., Шойнерт И.. Экологическая химия: Пер. С нем./Под ред. Ф, Корте.- М.: Мир, 1996. – 396 с., ил.
47. Крик Ф. Жизнь как она есть. Её зарождение и сущность/ Ф.Крик; Пер. с англ. Е.В. Богатыревой. – М.: Институт компьютерных исследований, 2002.- 158 с.
48. Крупнова Т.Г., Сухарев Ю.И. Химия окружающей среды: Учебное пособие.- Челябинск: Изд. ЮУрГУ, 2005.- Ч.2.-36 с.
49. Кудрявцев Н.Н., Костюченко С.В., Волков С.В, Зайцева С.Г. Опыт и перспективы практического применения обеззараживания сточных вод УФ - излучением. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ», 2004, №1.
50. Кузин А. М. Прикладная радиобиология (теоретические и технические основы) / А. М. Кузин, Д. А. Каушанский. – М.: Энергоиздат, 1981. –
224 с.
51. Кузин А. М. Природный радиоактивный фон и его значение для биосферы Земли / А. М. Кузин. – М.: Наука, 1991. – 117 с.
52. Курьяновская станция аэрации МГП «Мосводоканал». Издательство Прима – Пресс - М, 2004.
53. Лалаян Ю.Г. Экологические аспекты отходов. 2000, 320 с.
54. Лем С. Сумма технологии/ С.Лем; Пер. С польского; Под ред. С. Переслегина и Н. Ютанова. – М.: ООО «Издательство АСТ», 2002. – 668 с.
55. Лурье Ю.Ю. Аналитическая химия промышленных сточных вод. –М:Химия. 1984 – 448 с.
56. Майстренко В.Н., Хамитов Р.З., Будников Г.К. Эколого-аналитический мониторинг суперэкотоксикантов.-М.:Химия, 1996. 319 с.
57. Мазур И. И. Инженерная экология: общий курс. В 2-х т. Т. 2. Справочное пособие / И. И. Мазур, О. И. Молдаванов, В. Н. Шишов; Под. ред. И. И. Мазура. – М.: Высшая школа, 1996. – 655 с.
58. Мак-Кензи Д.П. Мантия Земли/ Д.П. Мак – Кензи// В мире науки.- 1983. - № 11.- с.29-42.
59. Маргелис Л. Роль симбиоза в эволюции клетки/ Л.Маргелис; Пер. с англ. В.Б. Касинова, Е.В. Кунина; Под ред Б. М. Медникова. – М.: Мир, 1983.-352 с.
60. Методика технологического контроля работы очистных сооружений городской канализации. Изд. 3-е, перераб. и доп. М., Стройиздат, 1977.299 с.
61. Методические рекомендации для расчета сооружений биологической очистки сточных вод. - М.: Строительный Университет г. Веймара ГУП «МосводоканалНИИпроект», 2002.
62. Мешалкин А.В., Дмитриева Т.В., Шемель И.Г. Экологическое состояние гидросферы: Учебно-методическое пособие/Под ред. А.П. Коржавого. - Калуга: Издательство научной литературы Н.Ф. Бочкаревой, 2007. – 264 с.
63. Мешалкин А.В., Дмитриева Т.В., Шемель И.Г., Маньшина И.В. Экологическое состояние атмосферы/Под ред. А.П. Коржавого. - Калуга: Издательство научной литературы Н.Ф. Бочкаревой, 2006. – 224 с.
64. Микроэлементы в растениях: поступление, транспотр и физиологические функции./Под ред. Островской Ю.М., Киев: Наук думка, 1987, 181 с.
65. Мингулина Э. И., Масленникова Г. Н., Коровин Н. В., Филиппов Э. Л. Курс общей химии: Учеб. для студ. энергет. спец. вузов./ Под ред. Н. В. Коровина. —2-е изд., перераб. и доп. — М.: Высш. шк., 1990. —446 с., ил.
66. Мишуков Б.Г., Соловьев Е.А. Удаление азота и фосфора на очистных сооружениях городской канализации. Приложение к журналу «Вода и экология», 2004.
67. Муравьев А.Г., Каррыев Б.Б., Ляндзберг А.Р. Оценка экологического состояния почвы. Практическое руководство./Под ред. к.х.н. А.Г.Муравьева. Изд.2-ое, перераб. и дополн.-СПб.: Крисмас+, 2008.-216 с., ил.
68. Мышьяк; Пер. с англ. Ю. Б. Шафирова. – Женева: Всемирная организация здравоохранения, 1985. – 185 с.
69. Небел Б. Наука об окружающей среде: В 2-х т. / Б. Небел; Пер. с англ. М. В. Зубкова, Д. А. Петелина, Т. И. Тарасовой, Н. О. Фоминой. – М.: Мир, 1993. – Т. 2. – 330 с.
70. Озима М. Глобальная эволюция Земли / М. Озима; Пер. с англ. А. В. Шолпо; Под ред. А. А. Маракушева. – М.: Мир, 1990. – 165 с.
71. Опарин А.И. Жизнь. Её происхождение и развитие/ А.И. Опарин. – Изд-во АН СССР, 1960.- 192 с.
72. Орлов В.А. Озонирование воды. - М.: Стройиздат, 1984.-88 с., ил.
73. Перельман А.И. Геохимия биосферы/ А.И. Перельман. – М.: Наука, 1973.-167 с.
74. Петров К. М. Общая экология: взаимодействие общества и природы / К. М. Петров; Учебное пособие для вузов. – 2-е изд., стер. – СПб: Химия, 1998. – 352 с.
75. Практикум по агрохимии. – М:Агрохимиздат. 1987.
76. Пурмаль А.П. Антропогенная токсикация планеты. Часть 1./Соросовский образовательный журнал, №9, 1998.
77. Пурмаль А.П. Антропогенная токсикация планеты. Часть 2./Соросовский образовательный журнал, №9, 1998.
78. Радионуклиды в стеклянной клетке.//Химия и жизнь-2003- №7-8, с.6.
79. Рамад Ф. Основы прикладной экологии: Воздействие человека на биосферу / Ф. Рамад; Пер. с фр. Ю И. Ляхина, А. Г. Попова, А. И. Смирнова; Под ред. Л. Т. Матвеева. – Л.: Гидрометеоиздат, 1981. – 544 с.
80. Реймерс Н. Ф. Экология: Теории, законы, правила, принципы и гипотезы / Н. Ф. Реймерс. – М.: Россия молодая, 1994. – 367 с.
81. Русанова Н.А., Овечкина Г.В. Хлорирование и дехлорирование сточных вод. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2002, №12.
82. Русин Г.Г. Физико-химические методы анализа в агрохимии. – М:Агрохимиздат. 1990.
83. Сивер Р. Динамичная Земля/ Р. Сивер// В мире науки. – 1983. - № 11. с. 4-14.
84. Скиннер Б. Хватит ли человечеству земных ресурсов?/ Б.Скиннер; Пер. с англ. Н.Н. Шатанина; Под ред. А.С. Астахова. – М.: Мир, 1989. – 264 с.
85. Справочник по очистке природных и сточных вод/Л.Л. Пааль, Я.Я. Кару, Х.А. Мельдер, Б.Н. Репин.- М.: Высшая школа, 1994.-336 с. илл.
86. Справочник по современным технологиям очистки природных и сточных вод, и оборудованию. ДАНСЕЕ. Отдел по Датскому сотрудничеству в Области Окружающей Среды в Восточной Европе. В сотрудничестве с Министерством Природных Ресурсов РФ и Федеральным Экологическим Фондом РФ.
87. Сытник К. М. Биосфера. Экология. Охрана природы: Справочное пособие / К. М. Сытник, А. В. Брайон, А. В. Гордецкий; Под ред. К. М. Сытника. – Киев: Наукова думка, 1987. – 524 с.
88. Таубе П.Р., Баранова А.Г. Практикум по химии воды. Учеб. пособие для вузов. – М.: Высшая школа, 1971.
89. Тинсли И. Поведение химических загрязнений в окружающей среде. – М:Мир. 1982.
90. Унифицированные методы анализа вод. – Под ред. Ю.Ю. Лурье. – М.: Химия, 1971.
91. Филенков В.М., Каплан А.Л., Трошинский М.В., Милевский А.С. К вопросу об очистке почвы от нефтепродуктов на основе биоматериалов. Труды Международного Форума по проблемам науки, техники и образования. Том 3./Под редакцией: В.П. Савиных, В.В. Вишневского.-М.: Академия наук о Земле, 2004.-110 с.
92. Франшто Ж. Океаническая кора/ Ж. Франшто// В мире науки. – 1983.- №11. – с.44-59.
93. Хаммер М. Технология обработки природных и сточных вод: Перевод с английского -М.: Стройиздат, 1979.400 с., ил.
94. Хансен Б., Пииртола Л. Использование осадка в качестве источника сырья и энергии. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №4.
95. Черных Н.А., Милащенко Н.З., Ладонин В.Ф. Экотоксикологические аспекты загрязнения почв тяжелыми металлами. М.: Агроконсалт, 1999, 176 с.
96. Чертес К.Л., Стрелков А.К., Быков Д.Е., Седогин М.П., Тараканов Д.И. Утилизация осадков сточных вод в качестве материала для изоляции ТБО. //Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №6.
97. Чертес К.Л.; Стрелков А.К., Быков Д.Е., Шинкевич М.Ю., Бурлака В.А. Новое направление использования избыточного активного ила.//Водоснабжение и санитарная техника: ООО «Издательство ВСТ»,2001, №5.
98. Чибисова Н.В., Долгань Е.К. Экологическая химия: Учебное пособие / Калинингр. ун-т. - Калининград, 1998. - 113 с.
99. Чибисова Н.В. Практикум по экологической химии: Учебное пособие / Калинингр. ун-т. - Калининград 1999. - 94 с.
100. Шустов С.Б., Шустова Л.В. Химические основы экологии: Учеб. пособие для учащихся шк., гимназий с углубл. изуч. химии, биологии и экологии.-М.: Просвещение, 1994.-239 с.
101. Эрхард Ж. П. Планктон. Состав, экология, загрязнение / Ж. П. Эрхард, Ж. Сежен; Пер. с фр. Н. В. Вышкварцевой, А. Г. Попова; Под ред. Г. Н. ужинской. – Л.: Гидрометеоиздат, 1984. – 256 с.
102. Эткинс Л. Молекулы / Л. Эткинс; Пер. с англ. А. А. Кирюшкина. – М.: ир, 1991. – 216 с.
103. Яковлев С.В., Карелин Я.А., Ласков Ю.М., Калицун В.И. Водоотведение и очистка сточных вод: Учебник для вузов.-М.: Стройиздат, 1996.-591 с.: ил.
104. Яковлев С.В., Карюхина Т.А. Биохимические процессы в очистке сточных вод.-М.: Стройиздат, 1980.
105. Яковлев С.В., Ласков Ю.М. Канализация. Изд. 5-е, перераб. и доп. Учебник для техникумов. М., Стройиздат, 1972, 280 с. с илл.
106. Allaby M. Basics of Environmental Science / M. Allaby. – 2nd Ed. – London & New York: Routledge, 2000. – 323 p.
107. Backer A.J. Accumulation and excluders strategies in the response of plant to heavy metals.// J. Plant Nutr., 1981, V.3, N1-4, p.643-651.
108. Climate Change. Research and Policy: Updates. Part I: Scientific Background. – Seville: EC Joint Centre, 1997. – 36 p.
109. Controles de residus dans les dengrees animales. Abeille Fr. Apiculteur, 1992, N769, p.116-118.
110. Davison W. Controlled reversal of lake acidification by treatment with hosphate fertilizers / W. Davison, D. G. George, N. J. A. Edwards // Nature. – 1995. – Vol. 377. – P. 504–507.
111. Deutscher Bundestag: Schutz der Erdatmosphäre. – Bonn: Deutscher Bundestag, 1988. – 583 p.
112. Gamo M. Ranking the risks of 12 major environmental pollutants that occur in Japan / M. Gamo, T. Oka, J. Nakanishi // Chemosphere. – 2003. – Vol. 53. – P. 277-284.
113. Gribbin J. The hole in the sky / J. Gribbin. – Toronto: Bantam, 1988. – 192 p.
114. Gunn J. M. The potential for restoration of acid damaged lake Trout Lakes / J. M. Gunn, K. H. Mills // Restoration Ecology. – 1998. – Vol. 6. – P. 390– 397.
115. Keller W. Lake water quality improvements and recovering aquatic communities / W. Keller, J. M. Gunn // Restoration and Recovery of an Industrial Region: Progress in Restoring the Smelter–damaged Landscape near Sudbury, Canada. – New York: Springer–Verlag, 1995. – P. 80–87.
116. Maliszewska W., Werzbicka N. The influence of lead, zinc and cooper on the development and activity of microorganisms in soil. Agric. Environ. Quality, 1978, v. 8, p.135.
117. Manahan S. E. Fundamentals of Environmental Chemistry / S. E. Manahan. – CRC Press, 2000. – 1024 p.
118. Miller S.L. A production of amino acids under possible primitive earth conditions/ S.L. Miller// Science. – 1953. – Vol. 117.- P. 528-529.
119. Regional precipitation and surface water chemistry trends in Southeastern Canada / J. E. Clair, P. J. Dillon, J. Ion et al. // Can. J. Fish. Aquat. Sci. – 1995. – Vol. 52. – P. 197–212.
120. Regional trends in aquatic recovery from acidification in North America and Europe / J. L. Stoddard, D. S. Jeffries, A. Lükewille // Nature. – 1999. – Vol. 401. – P. 575–578.
121. Retallack S. We’re changing our climate! Who can doubt it? / S. Retallack,P. Bunyard // The Ecologist. – 1999. – Vol. 29, No. 2. – P. 60–63.
122. Reversibility of acidification of mountain lakes after reduction in nitrogen and sulphur emissions in Central Europe / J. Kopacek, J. Hejzlar, E. Stuchlik et al. // Limnol. Oceanogr. – 1998. – Vol. 43. – P. 357–361.
123. The recovery of crustacean zooplankton communities from acidification: Comparing manipulated and reference lakes / N. D. Yan, W. Keller, K. M. Sommers et al. // Can. J. Fish. Aquat. Sci. – 1996. – Vol. 53. – P. 1301–1327.
[1] Элементы, атомы и изотопы. Элементы состоят из атомов — мельчайших частиц элемента, которые могут принимать участие в химических реакциях. Атомы имеют три основные составляющие: протоны, нейтроны и электроны. Протоны заряжены положительно и несут массу, равную массе атома водорода. Нейтроны не заряжены и имеют массу, равную массе протона. Электроны несут отрицательный заряд, равный (положительному) заряду протонов.
Атомы электронейтральны, поскольку имеют одинаковое количество протонов (Z) и электронов. Величина Z. известна как атомный номер, отражающий химические свойства элемента. Атомный вес одного атома определяется его массовым числом; основная масса атома сосредоточена в ядре.
Массовое число = число протонов (Z) + число нейтронов (N).
Из уравнения видно, что масса элемента может меняться в результате изменения числа нейтронов. Это не влияет на химические свойства элемента (которые определяются величиной Z ). Атомы элемента, различающиеся по массе (т. е. N), называются изотопами.
[2]Радиогенные элементы – элементы, возникшие в результате ядерных реакций распада.
[3] Гадейский эон, который начался, когда Земля превратилась в сплошное твердое тело.
[4] Экотоксиканты – ядовитые вещества антропогенного происхождения, вызывающие серьёзные нарушения в структурах экосистем.
Суперэкотоксиканты – вещества, обладающие полифункциональным токсическим действием в чрезвычайно малых дозах.
[5] Хемосфера – совокупность всех веществ биосферы и природных и антропогенных.
[6] Многие элементы не существуют отдельно в виде атомов, а связаны друг с другом и образуют молекулы. Например, основные компоненты воздуха — кислород и азот — присутствуют в нижней части атмосферы в виде молекул O2 и N2. В отличие от них аргон как инертный элемент (или благородный газ) находится в несвязанной форме в виде отдельных атомов.
Связи в молекулах образуются путем электростатических взаимодействий между электронами и ядрами атомов. Существует множество механизмов, приводящих к образованию связи, а тип связи влияет на свойства образовавшегося в результате вещества. В образование связи вовлечены электроны, наиболее удаленные от центра атома. Прототипом химической связи является ковалентная связь, и, вероятно, можно представить ее наилучшим образом как образующуюся из внешних обобщенных электронов двух атомов. Рассмотрим, например, два атома фтора, образующих молекулу фтора:
На этом изображении химической связи электроны обозначены точками. На самом деле электроны связи размазаны по всей молекуле, но с большей вероятностью они располагаются между ядрами. Связь показана в виде двух электронов, находящихся между атомами, т. е. связь образуется двумя электронами, общими для обоих атомов. Следовательно, образование связи можно рассматривать как результат достижения структуры, подобной благородным газам, которые имеют особо устойчивые конфигурации электронов. Условно ковалентная связь обозначается F-F.
Кислород и азот немного отличны:
Здесь для структуры, подобной аргону, требуются по два электрона от каждого атома, и образующаяся двойная связь обозначается как 0=0. Для азота имеем
что обозначается как (тройная связь).
Газы в атмосфере, вода и органические вещества образуются в основном за счет этих типов ковалентных связей (Андруз, 1999).
[7] Для обозначения количества вещества химиками принята единица измерения – моль – это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц сколько содержится атомов в 12 г изотопа углерода 12С. Число структурных единиц, содержащихся в 1 моле вещества – постоянная Авогадро = 6,02 * 1023 моль-1.
[8] Микро (10-6) — микрокомпонент, содержащийся в концентрации 10-6, т. е. ррm (раrtes рго million).
ррm = (мг/м3*Vm)/М (молярная масса);
об%= ррm*10-4.
Аналогично процент 10-2 (рго centum, иначе %) и промилле, например, для солености, 10-3 (рго mille, иначе %о) (Андруз, 1999).
[9] Дисперсные системы — физико-химические системы, состоящие из измельченных частиц (дисперсная фаза), распределенных в окружающей среде (дисперсионная среда) — газе, жидкости или в твердом теле. Частицы дисперсной фазы и дисперсионной среды отделены друг от друга сильно развитой поверхностью раздела между фазами.
Дисперсные системы, состоящие из твердых или жидких частиц, распределенных в газовой фазе, называются аэрозолями. Аэрозоли рассеивают солнечный свет, являются ядрами конденсации для дождевых капель, а также служат поверхностью, на которой протекают гетерогенные газовые реакции.
Размер частиц аэрозолей колеблется в пределах по крайней мере семи порядков — от 1 нм до долей мм. Частицы размером более 10 мкм, видимые невооруженным глазом, считаются грубодисперсными, менее 0,1 мкм — мелкодисперсными', среднедисперсными считаются системы с размерами частиц от 0,1 до 10 мкм. Большинство частиц, находящихся в воздухе, имеет размер не более 0,1 мкм, т.е. относится к высокодисперсным (Андруз, 1999).
[10] Кислотность водных растворов часто описывается с помощью шкалы рН. Кислоты повышают концентрацию водородных ионов (Н+) в растворе и значение рН такого раствора определяется как рН=-lg c (Н+(водн)). Строго говоря, c (Н+(водн) должна означать активность ионов водорода (аН+(водн)), н в данном случае можно представить её подобной концентрации, выраженной в единицах моль*л-1.
Можно записать похожее отношение, определяющее рОН: рОН=-lg c (ОН-(водн)).
Однако величина рН связана с рОН через равновесие, описывающее диссоциацию воды:
Н2О Н+ + ОН-, т.е. Кв=10-14=сН+*с ОН-, таким образом, рН=14-рОН.
Важно отметить, что это логарифмический масштаб и поэтому нельзя усреднять рН растворов (хотя можно усреднить концентрации Н+).
По шкале рН значение 7 считается нейтральным. Существует ряд других важных в отношении окружающей среды значений шкалы (Андруз, 1999).
[11] Кислоты и основания — это важный класс химических соединений, поскольку они осуществляют контроль над реакциями в воде. Традиционно кислотами считались соединения, в результате диссоциации которых в воде появляются ионы водорода:
НСl(водн) Н+(водн) + Сl- (водн)
Определение кислоты, однако, было расширено принятием во внимание переноса электронов и охватывает широкий спектр соединений. Например, борная кислота (Н3ВО3), контролирующая кислотность морской воды, приобретает электроны от гидроксид-иона (ОН-):
Н3ВО3 (водн) + ОН-(водн) В(ОН) -4(водн)
В большинстве случаев достаточно простого определения, и основаниями (или щелочами) можно считать соединения, которые вносят ОН- в водный раствор:
NаОН(водн) Nа+ (водн) + ОН- (водн)
Кислоты и основания вступают в реакции нейтрализации, образуя растворенную соль и воду:
НСl (водн) + NаОН(водн) Сl-(водн) + Nа+ (водн) + Н2O(ж)
Различают два класса кислот и оснований — сильные и слабые. Считается, что соляная кислота (НСl) и гидроксид натрия (NаОН) полностью диссоциируют в растворе с образованием ионов, поэтому их относят к «сильным». Слабые кислоты и основания диссоциируют лишь частично:
НСООН(водн) Н+(водн) + НСОО-(водн)
NН4OН(водн) NН4+ (водн) + ОН-(водн)
Диссоциация — это равновесный процесс, который удобно описать с
помощью констант равновесия для диссоциации кислоты (Ка) и основания (Кb):
с Н+* с НСОО-
Кa = ——————— = 1,77 • 10-1 моль • л-1.
с НСООН
с NН4+* с ОН-
Кb = ——————— = 1,8 • 10-5 моль • л-1(Андруз, 1999).
с NН4OН
[12] Газовые гидраты — типичные решетчатые клатратные соединения, в которых молекулы гидрофобных (или близких к ним) газов включены в полости кристаллического каркаса, построенного посредством водородных связей из молекул воды. Как и все соединения этого типа, газовые гидраты имеют относительно небольшую область термодинамической устойчивости и поэтому чрезвычайно чувствительны к изменениям условий равновесия (Андруз, 1999).
[13] Структура органических молекул (Андруз, 1999).
[14] Радиоактивность – самопроизвольный переход ядер нестабильных атомов в более стабильное состояние. В результате изменений в ядрах атомов выделяется излучение:
α-лучи (ионы гелия);
β-лучи (электроны);
γ-лучи (электромагнитные волны).
Удаление α-частицы из ядра смещает атомный номер в периодической таблице на 2 позиции влево. Массовое число элемента при этом уменьшается на 4 единицы.
При β–распаде массовое число не изменяется. При обычном β-распаде нейтрон превращается в протон с выделением электрона, а атомный номер элемента увеличивается на единицу.
При электронном захвате протон переходит в нейтрон в результате перемещения электрона их К-оболочки атома в ядро. Атомный номер при этом уменьшается на единицу, β-излучение отсутствует, но выделяются Х-лучи.
γ-лучи испускаются при возвращении ядра из возбужденного состояния в обычное состояние.
Все три вида излучения являются ионизирующими и способны наносить повреждения биологическим объектам (лучевая болезнь, мутации, образование злокачественных опухолей). Наибольшей проникающей способностью обладает γ-излучение (Гусакова, 2004).
[15] Период полураспада (Т1/2)– промежуток времени, в течение которого разлагается половина первоначального количества радиоактивного элемента. В конце n-го периода полураспада остается 2-nN0 ядер исходного изотопа. Аналогичное выражение справедливо для массы (m) нераспавшегося изотопа: m=2-n m0, где m0 - исходная масса изотопа (Глинка, 2006).
[16] 1 мЗв эквивалентен разрушению одной молекулы ДНК в одной клетке тела человека. Природно-обусловленное разрушение ДНК имеет скорость порядка 70 млн. год–1 (Зилов, 2006).
[17]В последнее время подход к радиоактивным отходам изменился. Из них стали выделять уран, плутоний, цезий и стронций. А затем оставшийся раствор упаривают и остекловывают. Эту технологию разработали российские ученые, сотрудники ПО «Маяк" и нескольких НИИ: добавляют оксиды фосфора и сильно нагревают. Получаются монолитные блоки из алюмофосфорного стекла, в объеме которого равномерно распределены опасные радионуклиды. Поскольку концентрация трансурановых элементов в радиоактивных исходных отходах невелика, то и в стеклянных кирпичиках их тоже немного, а самих кирпичиков — большое количество.
Ученые из ГЕОХИ им. Вернадского РАН под руководством академика Бориса Мясоедова придумали как уменьшить объем этих стеклянных клеток, а заодно упростить весь процесс. Они предложили объединить два этапа — фракционирования и стеклования.По замыслу авторов, после того как из раствора выделены уран, плутоний, стронций и цезий, раствор следует пропустить через колонки — стеклянные емкости, заполненные специальным носителем. Это мелкие шарики или узкие капилляры из того же самого алюмофосфорного стекла. На него нанесена пленка специального экстрагента — вещества, которое образует с трансурановыми элементами прочные комплексы. В результате все эти радионуклиды остаются внутри колонки, а вытекает из нее безвредная жидкость.Затем остается только прокалить колонки, и получаются все те же стеклянные блоки, в которых навечно замурованы трансурановые элементы. Только концентрация их в каждом кирпичике будет гораздо выше, чем прежде. Значит, все эти опаснейшие радионуклиды вместо огромного бака поместятся всего в нескольких маленьких кубиках. А если их все собрать еще и в контейнер, то хранить их без всякого вреда можно будет очень долго (Радионуклиды в стеклянной…,, 2003).
[18] Биологическая вода - это вода, содержащаяся в живых организмах и растениях, в которых в среднем ее находится 80% (Мешалкин, 2007).
[19] Молекула воды Н2О имеет треугольную форму, где каждый атом водорода (Н) связан с кислородом (О), как показано на рисунке.
Такая форма является следствием расположения электронных орбит, участвующих в связи. Кислород имеет гораздо большую электроотрицательность, чем водород, и притягивает связывающие электроны от атома водорода к себе. Кислород, таким образом, несет частичный отрицательный заряд, обычно обозначаемый как (δ-), а водород — частичный положительный заряд (δ +), создавая диполь (т. е. электрические заряды одинаковой величины и противоположных знаков на небольшом расстоянии друг от друга). В любой момент времени небольшая часть молекул воды полностью диссоциирует, давая ионы Н+ и ОН- согласно реакции
Н2О(ж) Н+ (водн) + ОН- (водн),
для которой константа равновесия равна
К = (а Н+* а ОН-) / аН2О = 10-14 моль2 • л-2
Активность чистой воды по договоренности принята равной единице, и уравнение упрощается до
К=аН+•аОН-
Полярная природа молекулы воды позволяет ионам отдельных молекул воды взаимодействовать с их соседями. Небольшой атом водорода может приближаться и взаимодействовать с кислородом соседней молекулы особенно эффективно. Взаимодействие между, атомом водорода, несущим частичный положительный заряд, и атомами кислорода соседних молекул воды, несущих частичные отрицательные заряды, особенно сильное — согласно стандартам межмолекулярных взаимодействий, хотя и слабее, чем ковалентная связь. Такой тип взаимодействия называют водородными связями. Молекулы в жидкой воде распределены менее беспорядочно, чем в большинстве растворов, из-за водородных связей. Полярность связей делает воду эффективным растворителем для ионов; молекулы воды притягиваются к иону с помощью электростатических сил, образуя во круг него скопление. Более того, соединения, связанные ионными связями, с разделением зарядов между составляющими их ионами легко разрушаются силами притяжения диполя воды. Водородные связи придают воде относительно высокую вязкость и способность к нагреву по сравнению с другими растворителями. Водородные связи позволяют также воде существовать в виде раствора в большом диапазоне температур. Поскольку большинство биологических транспортных систем жидкие, последнее свойство является основополагающим для поддержания жизни (Андруз, 1999).
[20] NаCl является классическим примером твердого ионного вещества: Na. +: С1. Na+: С1-: (точки изображают электроны)/
Теория, лежащая в основе этого поведения, такова, что элементы с электронной структурой, близкой к инертным (благородным) газам, теряют или приобретают электроны, чтобы приобрести стабильную (инертную) структуру. В уравнении натрий (Nа; атомный номер 11) теряет один электрон, достигая структуры неона (Nе; атомный номер 10), тогда как хлор (С1; атомный номер 17) приобретает электрон, добиваясь электронной структуры аргона (Аг; атомный номер 18). Соединение NаCl образуется путем переноса одного электрона от натрия к хлору и образования связи из-за электростатического притяжения с помощью отданного/приобретенного электрона. Соединение электронейтрально.
Твердые кристаллические вещества типа NаCl легко растворимы в таких полярных растворителях, как вода, которые разрушают ионный кристалл до раствора отдельных заряженных ионов.
Положительно заряженные атомы типа Na+ известны как катионы, тогда как отрицательно заряженные ионы типа С1- называют анионами (Андруз, 1999).
[21] Активная концентрация ионов, или активность, становится важным понятием в концентрированных и сложных растворах типа морской воды. Ионы в концентрированном растворе находятся на достаточно близком расстоянии друг от друга. Элетростатические взаимодействия снижают эффективные концетрации способных участвовать в реакции ионов. Чтобы точно предсказать протекание химических реакций в концентрированных растворах, надо принимать в расчет уменьшение эффективной концентрации, что делается с помощью коэффициента активности (γ): а=с* γ, где а-активность (Андруз, 1999).
[22] Концентрация раствора электролита может быть выражена в виде ионной силы (I), определяемой как
I=1/2Σсiz2i
где с, — концентрация ионов (i) в моль • л-1, zi — заряд иона (i).
Ионная сила лучше в качестве меры концентрации сложного раствора электролита, чем простая сумма молярных концентраций, поскольку она учитывает влияние зарядов разновалентных ионов.
Пресные воды обычно имеют значения ионной силы между 10-3 и 10-4 моль • л-1, тогда как морская вода имеет довольно постоянную ионную силу, равную 0,7 моль • л-1(Андруз, 1999).
[23] В физико-химическом понимании коагуляция - процесс соединения коллоидныхчастиц друг с другом в более крупные частицы, которые становятся седиментационно-неустойчивыми и оседают на дно. Коллоидные растворы коагулируют при введении в них электролитов или коллоидов противоположного знака, под действием физических факторов, таких, например, как изменение температуры (Мешалкин, 2007).
[24] В разработку и освоение на отечественных сооружениях различных методов, аппаратов, оборудования и сооружений для уплотнения, сгущения, аэробной стабилизации, механического обезвоживания, термической обработки и утилизации осадков городских и производственных сточных вод большой вклад внесли сотрудники лаборатории обработки осадков НИИ ВОДГЕО (Методические рекомендации…, 2002).
[25] Взвешенные вещества – это вещества, которые остаются на фильтре при использовании того или иного способа фильтрования (Хаммер, 1979).
[26] Септик-комбинированное сооружение, в котором происходит осветление сточной воды и сбраживание выпавшего осадка (Яковлев, 1996).
[27] В отечественной литературе, в отличие от англоязычной, где термин один (eutrophication) существуют варианты термина: эвтрофирование, эвтрофикация,эвтрофизация, эвтрификация, эвтрофия, евтрофирование, евтрификация,евтрофия (Зилов, 2006).
[28] заболевание костной ткани выражающееся в размягчении и деформации кости вследствие нарушения минерального обмена.
[29] разрежение губчатого и кортикального слоев кости вследствие частичного рассасывания костного вещества.
[30] При растворении твердого тела в воде растворение прекращается, когда получается насыщенный раствор, т. е. когда между растворяемым веществом и находящимися в растворе молекулами того же вещества установится равновесие. При растворении электролита, например соли, в раствор переходят не молекулы, а ионы; следовательно, и равновесие в насыщенном растворе устанавливается между твердой солью и перешедшими в раствор ионами. Например, в насыщенном растворе сульфата кальция устанавливается равновесие
CaSO4 Са2++ SO42-
твердая соль ионы в растворе
Константа равновесия для этого процесса выразится уравнением:
[Са2+] [SO42-]
Kc =
[CaSO4]
Знаменатель дроби — концентрация твердой соли — представляет собой постоянную величину, которую можно ввести в константу. Тогда, обозначая Кс [CaSO4] = К'с, получим:
[Са2+] [SO42-] = К'с
Таким образом, в насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться; ее называют произведением растворимости электролита и обозначают буквами ПР.
Заменив величину К'с на ПР(Са804), получим: ПР(CaSO4) = [Са2+] [SO42-]
Численное значение произведения растворимости электролита нетрудно найти, зная его растворимость. Например, растворимость сульфата кальция при 20 °С равна 1,5 • 10-2 моль/л. Это значит, что в насыщенном растворе концентрация каждого из ионов Са2+ и SO42- равна 1,5 • 10-2 моль/л. Следовательно, произведение растворимости этой соли
ПР(CaSO4) = [Са2+] [SO42-] = (1,5 • 10-2)2 = 2,25 • 10-4.
Приведенный расчет, сделанный на основе классической теории электролитической диссоциации, не вполне точен, так как здесь не учтено влияние на растворимость электролита электростатических сил, действующих между ионами. Если учесть это влияние, т. е. если вместо концентраций Са2+ и SO42- перемножить их активности в насыщенном растворе CaSO4, то величина произведения растворимости несколько уменьшится; уточненное значение ПР(CaSO4) равно 1,3 • 10-4.
В случае очень мало растворимых электролитов влияние указанных сил можно не принимать во внимание.
В тех случаях, когда электролит содержит два или несколько одинаковых ионов, концентрации этих ионов при вычислении произведения растворимости должны быть возведены в соответствующие степени. Например:
ПР(РbI2) = [Рb2+][I-]2 (Глинка, 2007).
[31] Когда природная вода протекает через почвенные слои, легко растворимые соли экстрагируются из почвы в воду, обуславливая тем самым жесткость воды. В основном жесткость природных вод характеризует содержание в них ионов Са2+ и Mg2+ (в некоторой степени также Fe2+, Fe3+). Общая жесткость количественно выражается числом миллиграмм-эквивалентов растворимых солей кальция и магния в 1 л воды:
m(Ca2+) m(Mg2+)
Ж0= +, где m-масса катиона в г; Э-молярная масса эквивалентов
Э(Ca2+)*V Э(Mg2+)*V
соответствующего катиона, г/мг-экв, V-объём воды,л.
Таким образом, общая жесткость воды складывается из кальциевой и магниевой жесткости.
Выделяют также карбонатную жесткость, обусловленную содержанием гидрокарбонатов кальция и магния, и некарбонатную, обусловленную содержанием сульфатов, хлоридов и т.д. кальция и магния. При нагревании воды нарушается карбрнатное равновесие (уменьшается содержание СО2), вследствие чего гидрокарбонаты переходят в карбонаты:
Са(НСО3)2СаСО3 + СО2 + Н2О
Растворимость карбонатов кальция и магния значительно меньше, чем гидрокарбонатов, поэтому при нагревании жесткость воды снижается. Этим процессом пользуются при умягчении воды кипячением. Отметим, что при кипячении удаляется не вся карбонатная жесткость воды, поскольку карбонаты, хотя и незначительно, но все же растворимы в воде. Жесткость, удаляемая кипячением называется временной. Разность между карбонатной и временной жесткостью называется остаточной. Постоянная жесткость- жесткость не устранимая кипячением. Сумма временной и постоянной жесткости представляет собой общую жесткость воды (Крупнова, 2005).
Мягкую воду также можно получить, добавляя к жесткой воде соду и гашеную известь для одновременного устранения временной и постоянной жесткости:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
Mg(НСО3)2 + Са(ОН)2 = MgСО3 + СаСО3 + 2Н2О
CaCl2 + Na2CO3 = СаСО3 + 2NaCl
MgCl2 + Na2CO3 = MgСО3 + 2NaCl
Также для устранения жесткости используют метод ионного обмена или катионирования воду пропускают через слой катионита. При этом катионы Ca2+ и Mg2+, находящиеся в воде, обмениваются на катионы Na+, содержащиеся в применяемом катионите. В некоторых случаях требуется удалить из воды не только катионы Ca2+ и Mg2+, но и другие катионы и анионы. В таких случаях воду пропускают последовательно через катионит, содержащий в обменной форме водородные ионы (Н-катионит), и анионит, содержащий гидроксид-ионы (ОН-анионит). В итоге вода освобождается как от катионов, так и от анионов солей. Такая обработка воды называется ее обессоливанием.
Для умягчения воды применяются также методы, основанные на физических явлениях. К ним относятся метод электродиализа, магнитно-ионизационный метод, магнитная обработка, ультразвуковая обработка.
Метод электродиализа основан на явлении направленного движения ионов электролита к электродам, подключенным к сети постоянного тока. Таким образом, ионы металлов, обуславливающие жесткость воды, задерживаются у электродов и отделяются от воды, выходящей из аппарата водоочистки.
Магнитно-ионизационный метод так же, как и метод электродиализа, использует явление направленного движения ионов, но уже под действием магнитного поля. Для увеличения в воде количества ионов ее предварительно облучают ионизирующим излучением.
Магнитная обработка воды заключается в пропускании воды через систему магнитных полей противоположной направленности. В результате этого происходит уменьшение степени гидратации растворенных веществ и их объединение в более крупные частицы, которые выпадают в осадок.
Ультразвуковая обработка воды, так же, как и магнитная, приводит к образованию более крупных частиц растворенных веществ с образованием осадка (Глинка, 2007).
[32] Окислительные или восстановительные реакции осуществляются посредством переноса электронов. Так, реакцию окисления железа кислородом
4Fе(мет) + 3О2(г) 2Fе2O3(тв) (1)
можно рассматривать как состоящую из двух полуреакций:
4Fе - 12е- 4Fез+, (2)
3O2+12е- 6O2-, (3)
где е- соответствует одному электрону.
При окислении происходит потеря электронов, а при восстановлении — приобретение электронов. В уравнениях (1)-(3) кислород—окислитель (часто называемый акцептором электронов) — восстанавливается, поскольку приобретает электроны.
Уравнение (1) показывает, что элементы типа кислорода при заданных температуре и давлении могут существовать в разных состояниях, т. е. в виде газа или оксида. Окислительное состояние элемента в соединении определяется с помощью следующих правил: степени окисления всех элементов равны нулю; степень окисления одноатомного иона равна его заряду, например: Nа+ = Nа(+1), Аl3+=Аl(+3), С1-=С1(-1); кислород имеет степень окисления -2 во всех соединениях, за исключением О2, перекисей; водород имеет степень окисления +1 во всех соединениях, кроме гидридов; сумма степеней окисления элементов в соединении или ионе равна его заряду; степень окисления элементов в ковалентном соединении можно установить, считая обобщенные электроны относящимися только к более электроотрицательному атому*. Если оба атома имеют одинаковую электроотрицательность, принято считать, что электроны поделены равномерно. Таким образом, степени окисления углерода и хлора в ССl4 равны +4 и -1 соответственно, а степень окисления хлора в С12 равна 0.
Окислительные состояния важны для предсказания поведения элементов или соединений. Например, хром нерастворим и не токсичен в виде хрома (III), тогда как хром (VI) образует растворимый токсичный анион СгО42-. Как все простые правила, определение окислительных состояний применимо для большинства, но не для всех соединений.
Поскольку окислительно-восстановительные полуреакции включают перенос электронов, они могут быть измерены электрохимически с помощью электродных потенциалов, являющихся мерой переноса энергии. Международным соглашением реакции
1/2Н2-е-Н+
приписан электродный потенциал (Е°), равный 0 (при стандартных температуре и давлении). Все остальные электродные потенциалы измеряются относительно этого значения. Положительное значение Е° показывает, что реакция протекает самопроизвольно [например, восстановление газообразного фтора (степень окисления 0) до фтора F-, степень окисления -1)]. Отрицательное значение Е° показывает, что реакция протекает самопроизвольно в обратном направлении (например, окисление Li до Li+.
Чтобы рассчитать общее значение Е°, нужно объединить соответствующие полуреакции (обращая внимание на их стехиометрию). Например, реакция раствора Sn2+ с раствором Fe3+ состоит из двух полуреакций:
Fe3+ + е- Fe2+ E°=0,77B,
Sn4+ + 2е- Sn2+ E°=0,15В.
Их объединение дает положительное значение Е°, что говорит о протекании прямой реакции:
2 Fe3+ + Sn2+ 2Fe2+ + Sn4+.
Для этой реакции Е° =0,77 - 0,15=0,62B.
Способность любой природной среды осуществлять процессы окисления или восстановления количественно измеряется его окислигель-но-восстановительным потенциалом, или Еh.
* Электроотрицательность является мерой стремления атома притягивать дополнительный электрон. Она используется как указатель ковалентной или ионной природы связи между двумя атомами. Атомы с одинаковой электроотрицательностью, или такие молекулы, как азот (N2), состоящие из двух одинаковых атомов, делят свои электроны связи поровну и поэтому образуют чистые ковалентные связи. Когда атомы, из которых состоит соединение, разнородны, связи становятся прогрессивно полярными. Например, в хлористом водороде (НС1) атомы хлора (С1) обладают сильным сродством к электронам, которые в небольшой степени притягиваются от водорода (Н) к хлору. Электроны связи остаются все еще поделенными, но не поровну, как в N2.
Следовательно, атом хлора несет небольшой отрицательный заряд, а атом водорода — небольшой положительный заряд. Крайняя степень поляризации означает, что связь становится ионной по характеру. Связь считается ионной, если она больше чем на 50% ионная по характеру.
Элементы, которые скорее отдают электроны (например, магний, кальций, натрий и калий), чем притягивают их, называются электроположительными (Андруз, 1999).
[33]Некоторые восстановленные соединения могут быть устойчивыми в температурных условиях поверхности Земли, несмотря на присутствие атмосферного кислорода. Например, графит является восстановленной формой углерода, и можно ожидать, что он будет реагировать с кислородом, т. е.:
Сграфит + О2(г) СО2(г).
Хотя реакция кислорода с графитом энергетически выгодна, графит тем не менее существует, поскольку эта реакция протекает очень медленно кинетически. Многие природные соединения находятся вне равновесия с их окружающей средой и вступают в реакции крайне медленно. Эти вещества метастабильны. Метастабильность можно проиллюстрировать, используя энергетический график химической системы, в которой вещества А и В взаимодействуют с образованием веществ С и Д (рис.). Для осуществления реакции А и В должны войти в тесный контакт, что обычно требует притока энергии (энергия активации). В холодных условиях (низкая энергия) лишь у небольшого числа молекул А и В случайно окажется энергия, достаточная для преодоления энергии активации, но это редкое явление, и реакция будет протекать медленно. Если повысить энергию реагентов (например, повысив температуру), реакция сможет протекать быстрее, поскольку большее число молекул А и В будут иметь требуемую энергию активации.
Альтернативным способом повышения скорости реакции является снижение энергии активации. Это можно осуществить с помощью катализатора, т. е. вещества, которое изменяет скорость реакции, само при этом не изменяясь. В нашей гипотетической реакции катализатор позволит молекулам А и В соединиться быстрее. В природной среде бактерии и их ферментативные системы часто катализируют реакции, которые иначе не смогли бы протекать спонтанно из-за кинетических ограничений. Вода может также выполнять роль катализатора, способствуя более тесному контакту ионов (Андруз, 1999).
[34] Общее количество обменных катионов в почве, согласно Международной системе единиц СИ, измеряют в смол(+)/кг (сантимоли положительных зарядов в 1 кг почвы) и называют емкостью катионного обмена (сокращенно ЕКО). Абсолютные величины ЕКО колеблются от единиц до нескольких десятков смол(+)/кг. Эти реакции очень важны, поскольку от состава обменных катионов и их количества зависят почвенное плодородие, многие физические и химические свойства почв и способность почв противостоять химическому загрязнению (Гусакова, 2004).
[35] Впервые гуминовые кислоты выделил из торфа немецкий ученый Ф. Ахард в 1786 г., но до сих пор их строение остается неясным (Гусакова, 2004).
[36] Растения, произрастающие в условиях избытка химических элементов, в том числе и тяжелых металлов в зависимости от характера их накопления и распределения разделяют на 3 группы: накопители, исключители и индикаторы (Backer, 1981). Накопители отличаются повышенным содержанием металла в растительных органах независимо от его концентрации в почве. По мнению А.П. Виноградова (1982), такие виды обладают генетически закрепленной потребностью поглощать большое количество поллютантов. Поступление тяжелых металлов в растения стимулируют вещества (например, этилендиаминтетрауксусная кислота), образующие с металлами в почвенном растворе устойчивые, но растворимые комплексные соединения. У исключителей поступление токсикантов в надземную массу задерживается и остается на низком уровне в широком диапазоне концентраций этих элементов во внешней среде. И только при содержании выше критического уровня начинается неограниченное поступление загрязнителей в растение - когда его защитные механизмы нарушаются. Растения имеют три защитных «барьера» против поступления тяжелых металлов: на границах почва-корень, корень-стебель, стебель - репродуктивные органы. Тяжелые металлы распределяются по органам растений в следующем порядке: корни>стебли>листья>плоды (семена) (Ильин В.Б., 1991). У индикаторов поглощение и транспорт ТМ в надземную часть пропорциональны их концентрации в почве (Микроэлементы в растениях..., 1987).
[37] 1Кu = 3,700- 1010 Бк.
[38] При соприкосновении с жидкостью газ в ней растворяется. Содержание газов в жидкости в насыщенном растворе колеблется в широких пределах и зависит от природы газа, растворителя, давления и температуры. При наличии химического взаимодействия газа с водой (НС1, NН3, Н2S, Сl2, CO2) их растворимость значительна; при обычном механическом смешении молекул газа с водой растворимость мала (N2, O2, Н2, инертные газы, СН4). По мере повышения температуры растворимость газов понижается.
Растворимость газа в жидкости характеризует коэффициент абсорбции (Бунзена), который показывает число объемов газа (н.у.), поглощенного одним объемом жидкости при давлении 1 атм.
Количество растворенного газа в жидкости прямо пропорционально его давлению над раствором (закон Генри): С=Кр,
где С - концентрация газа в растворе; р - давление газа над раствором; К - константа Генри, которая зависит от природы газа, растворителя и температуры, но не зависит от давления.
При растворении смеси газов закон Генри остается справедливым для каждой ее составной части, когда каждый компонент газовой смеси растворяется пропорционально своему парциальному давлению и растворимости.
Парциальным давлением называется та часть общего давления газовой смеси, которая обусловлена данным газом или паром. Парциальное давление газа в смеси равно тому давлению газа, которым он обладал бы один, занимая такой же объем, какой занимает смесь при той же температуре. При отсутствии химических реакций общее давление газовой смеси (Р) равно сумме парциальных давлений всех входящих в него газов (закон Дальтона):
Р=р1+р2+р3+…pn.
Присутствие в воде растворенных газов не всегда желательно. Растворенные в воде О2 и СО2 вызывают коррозию оборудования водоподготовки; вода, содержащая О2, вызывает «старение» анионитов, а наличие СО2 в воде вызывает нецелесообразное уменьшение обменной емкости высокоосновных анионитов по силикат-анионам.
Для удаления растворенных газов из воды применяют дегазацию, которая может быть осуществлена десорбционными (деаэрация), термическими или химическими методами.
 2015-03-27
2015-03-27 1367
1367