| Объем вмешательства | Характер повреждения | |
| ранение | разрыв | |
| Холедохостомия через рану общего желчного протока | ||
| Ушивание раны общего желчного протока, холедохостомия по Холстеду — Пиковскому | ||
| Перевязка общего желчного протока, холецистоеюноанастомоз с отключенной по Ру петлей | ||
| Панкреатодуоденальная резекция | ||
| Прецизионный холангиоеюноанастомоз с отключенной по Ру петлей |
Обсуждение
По нашим данным, повреждения желчного пузыря при закрытой травме живота составили 1,2%, ранениях — 1,6%, а повреждения внепеченочных желчных протоков — соответственно 0,2 и 0,3%.
Применяемая нами лечебная тактика при травме желчного пузыря была обусловлена прежде всего характером повреждения органа. При проникающих в просвет пузыря ножевых ранениях считали допустимым ограничить объем вмешательства ушиванием ран — 18 из 30 оперированных. Холецистэктомия обоснованна при ранении желчного пузыря со стороны печени, пропитывании желчью его стенки и (или) окружающих тканей. После удаления пузыря холедох дренировали по Холстеду — Пиковскому. Холецистэктомию выполнили всем пяти пострадавшим с огнестрельным ранением пузыря, учитывая большую, в сравнении с ножевым ранением, тяжесть повреждения органа. Предпочтение отдавали холецистэктомии и при закрытой травме желчного пузыря, из-за опасности развития посттравматического деструктивного холецистита даже при ушибе стенки пузыря с учетом сложности распознавания этого грозного осложнения в раннем послеоперационном периоде; такое осложнение мы наблюдали у 4 больных. Желчный пузырь сохранен только у 3 из 16 пострадавших — при частичном отрыве пузыря.
Объем оперативного вмешательства при травме внепеченочных желчных путей зависел от уровня их повреждения, степени тяжести, а также от наличия повреждения других органов панкреатодуоденальной зоны. При краевом ранении гепатикохоледоха ограничивались дренированием протока через имеющуюся рану. При пересечении гепатикохоледоха В. А. Вишневский (1996) считает показанным билиобилиарный анастомоз, а при значительном де-
фекте протока — билиодигестивный на отключенной по Ру петле, причем без использования каркаса. Бескаркасные билиодигестивные анастомозы накладывают М. Е. Ничитайло и А. В. Скумс (1999). Э. И. Гальперин и Н. Ф. Кузовлев (1996) при пересечении протока отдают предпочтение билиодигестивному анастомозу на транспеченочном дренаже, так как после наложения билиобилиарного соустья на дренаже Кера, который удаляли через 6 мес, в последующем развивалась стриктура анастомоза. Мы полностью разделяем точку зрения исследователей, утверждающих, что при узких протоках даже применение прецизионной техники не исключает вероятности стриктуры бескаркасных билиодигестивных анастомозов (А. С. Ермолов, 1996; А. А. Шалимов, 1996; А. Е. Борисов и соавт., 2000; М. Mercado et al., 2000). Это обусловлено не только технической сложностью обеспечить достаточную ширину анастомоза, но и тем обстоятельством, что процесс регенерации ведет к частичному его «сморщиванию» (В. С. Савельев, 1996). Поэтому при панкреатодуоденальной резекции, которую считали показанной при одновременном повреждении общего желчного протока, головки поджелудочной железы и двенадцатиперстной кишки, холедохоеюноанастомоз мы накладывали на погружном дренаже, играющем роль каркаса. Это упрощало технику вмешательства, предупреждало опасность при формировании передней губы анастомоза прошивания задней стенки протока. При полном поперечном разрыве общего желчного протока можно его перевязать и наложить холецистоеюноанастомоз, предварительно убедившись, что при перевязке центрального конца холедоха не лигирован также и пузырный проток; такая тактика применена одному из наших больных. В случае перерыва общего печеночного протока, если у хирурга нет достаточного опыта в реконструктивной хирургии желчевыводящих путей, то следует ограничиться наложением концевой гепатикостомы и после стабилизации состояния пострадавшего желательно не позже чем через сутки транспортировать его в специализированное отделение, где и будет решен вопрос о сроках реконструктивного вмешательства с учетом тяжести состояния пострадавшего. Концевая гепатикостома как первый этап вмешательства целесообразна и в ситуации, когда оперативное вмешательство производится на фоне общего перитонита. При восстановлении пассажа желчи в кишку в поздние сроки с момента травмы безопаснее, надежнее и технически проще накладывать билиодигестивный анастомоз на транспеченочных дренажах; смену дренажей проводим через 2,5—3 мес, а удаляем спустя 18—20 мес.
Таким образом, наши немногочисленные наблюдения свидетельствуют о сложности распознавания повреждений внепеченочных желчных путей даже во время оперативного вмешательства.
При травме желчного пузыря показанием к холецистэктомии являются разрыв пузыря, пропитывание его стенки желчью, внебрюшинное ножевое ранение, посттравматический холецистит, огнестрельное ранение.
Выбор объема операции при травме внепеченочных желчных протоков зависит от характера, уровня, протяженности их повреждения, наличия и тяжести травмы других органов панкреатодуоденальной зоны, сроков вмешательства, опыта хирурга. При полном перерыве гепатикохоледоха и своевременности операции формированию полного наружного желчного свища следует предпочесть первичное восстановление пассажа желчи в кишку путем билиодигестивного анастомоза с отключенной по Ру петлей тонкой кишки на погружном дренаже; при реконструктивном вмешательстве в поздние сроки более надежны билиодигестивные анастомозы на сменных транспеченочных дренажах.
СПИСОК ЛИТЕРАТУРЫ
Гальперин Э. И. Что должен делать хирург при повреждении желчных протоков?// 50 лекций по хирургии/Под ред. В. С. Савельева.— М.: Медиа Медика, 2003.— С. 228-234.
Гальперин Э. И., Дедерер Ю. М. Нестандартные ситуации при операциях на печени и желчных путях.— М: Медицина, 1987.— 332 с.
Ничитайло М. Е., Скумс А. В. Лечение больных с повреждениями желчных протоков при традиционной и лапароскопической холецистэктомии // Анналы хирургической гепатологии — 1999.— Т. 4.— № 1.— С. 49—55.
Раренко А. С. Закрытые повреждения желчного пузыря и внепеченочных желчных путей // Хирургия.- 1978.- № 7.- С. 55-58.
«Свежие» повреждения и рубцовые стриктуры желчных протоков // Анналы хирургической гепатологии: Матер. VIII Междунар. конф. хирургов-гепатологов стран СНГ.- 2000.- Т. 5.- № 2.- С 90-154.
Ятрогенные повреждения в хирургии желчных путей // Анналы хирургической гепатологии: Матер IV конф. хирургов-гепатологов — Тула, 1996.— Т. 1.— С. 266—314. (Приложение)
Cavaliere P., Camera S., Panero D. et al. Traumatisme ferme de l'abdomen: rapture isolee du cholidoque // Lyon. Med - 1987,- Vol. 83.- № 1.- P. 33-35.
Fartmann E., Kirchner R. Die Versorgung von Gallenwegsund Pankresverletzungen // Chirurg.— 1985.— Vol 56 - № 11.— P 688—694.
ГЛАВА 3 ПОВРЕЖДЕНИЯ СЕЛЕЗЕНКИ
Несмотря на то что селезенка хорошо защищена грудной клеткой и окружающими органами, по частоте повреждений при закрытой травме живота она занимает второе (В. М. Шеляховский, В. И. Пашкевич, 1983), третье (М. И. Кузин и соавт., 1985), а у детей — даже первое место (Г. А. Баиров и соавт., 1982; А. П. Пилипенко-Шапкина, 1987). Селезенка травмируется при ударе о ребра, позвоночник, почку; подвижность органа благоприятствует отрыву связочного аппарата от капсулы селезенки и даже всей сосудистой ножки. Резко возросшая частота транспортной травмы в генезе разрыва селезенки — 7% в 1950 г. и 66% в 1980 г. (D. Bergvist et al, 1980) — является причиной превалирования у пострадавших сочетанных повреждений, сопровождающихся высокой летальностью — от 36 до 57% (Д. В. Усов и соавт., 1983; М. Г. Маноле, И. X. Куцаров, 1988; D. Fry et al., 1980). Частота послеоперационных осложнений также высока — от 18 до 45% (М. П. Павловский, С. Н. Чуклин, 1992; Ю. Г. Шапкин и соавт., 2000; A. Encke, R. Seufert, 1986). Селезенка — один из часто повреждаемых органов при левосторонних торакоабдоминальных ранениях.
Во время оперативных вмешательств на органах брюшной полости частота повреждения селезенки составляет 1,8—3,4% (В. В. Уткин и соавт., 1988). Чаще селезенка травмируется при гастрэктомии, резекции желудка, селективной проксимальной ваготомии, когда при тракции за желудок возникают разрывы в области ворот органа. Такой же характер повреждения селезенки наблюдается при вмешательстве на левом фланге ободочной кишки, поджелудочной железе и даже при ревизии и осушивании левого поддиафрагмального пространства (В. П. Петров, Ф. Г. Романенко, 1986; С. А. Афендулов, 1995; I. Nielsen et al., 1984).
Проблема диагностики актуальна преимущественно для повреждений селезенки при закрытой травме. У 11,5—27% пострадавших, получивших сочетанную закрытую травму живота, при жизни разрыв селезенки не распознается (Г. А. Баиров и соавт., 1983; М. В. Шеляховский, В. И. Пашкевич, 1983). Симптомов, патогно-
моничных повреждению селезенки, нет. Диагностика основывается на клинической картине и данных физикального исследования; большим подспорьем в ней служит информация о механизме травмы (К. Zucker et al., 1984).
Клиническая картина закрытой травмы селезенки весьма разнообразна и зависит от тяжести повреждения органа (ушиб, субкапсулярный, чрескапсулярный или фрагментирующий разрыв, отрыв органа от сосудистой ножки), времени с момента травмы, наличия повреждений других органов брюшной полости, а также смежных анатомических областей — прежде всего груди.
Боль является наиболее частым симптомом. При изолированном повреждении селезенки боль обычно локальная — в левом подреберье или в верхней половине живота. Многие пострадавшие отмечают иррадиацию боли в левое плечо (симптом Кера) или в левую лопатку (симптом Элекера), а для разрыва селезенки считается характерным симптом «Ванька-встанька», описанный Б. С. Розановым (1936). Больной лежит на левом боку, прижав согнутые колени к животу. Если его попросить повернуться на спину или на правый бок, то из-за усилившейся боли он тотчас принимает исходное положение. Иногда больной сидит, и его невозможно заставить принять горизонтальное положение, так как при этом он испытывает боли, «стреляющие» в область левой лопатки и плеча. Подобная иррадиация болей объясняется раздражением кровью окончаний диафрагмального нерва и последующим замыканием рефлекторной дуги на проводниках левого плечевого сплетения (М. Э. Комахидзе, 1971; Г. Л. Александрович и соавт., 1986).
Картина внутрибрюшного кровотечения при чрескапсулярных разрывах селезенки является ведущей. Следует учесть, что если это не фрагментирующий разрыв и тем более не отрыв селезенки от сосудистой ножки, то кровотечение имеет тенденции периодически самопроизвольно останавливаться из-за тромбирования разрыва. Поэтому возможна тяжелая кровопотеря при относительно удовлетворительных показателях гемодинамики за счет «запуска» компенсаторных механизмов (А. П. Пилипенко-Шапкина и соавт., 1987). При физикальном исследовании у каждого второго пострадавшего определяется напряжение мышц в левом подреберье, которое имеет тенденцию распространяться на всю левую половину живота. С такой же частотой встречается симптом Блюмберга — Щеткина. Для паренхиматозного кровотечения характерен симптом Куленкампфа — несоответствие между резкой болезненностью живота при пальпации и незначительным напряжением мышц передней брюшной стенки. Перкуссия позволяет распознать увеличение размеров селезенки при субкапсулярном разрыве органа, наличие периспленальной гематомы, а также внутрибрюшное кровотечение.
Распознать субкапсулярный разрыв селезенки и периспленальную гематому удается и при контрастном исследовании желудка; о травме селезенки свидетельствует вдавление по большой кривизне желудка, ее «зазубренность», смещение желудка вправо. Отмечается
также смещение книзу селезеночного изгиба ободочной кишки, высокое стояние левого купола диафрагмы и ограничение его подвижности, а иногда и реактивный плеврит с соответствующей стороны (И. 3. Козлов и соавт., 1988; В. Н. Бордуновский, 1997; S. Schorr, I. Danon, 1967; L. Rosoff et al., 1972).
Тяжесть повреждения селезенки достоверно отражают ультразвуковое исследование и компьютерная томография. Однако компьютерная томография приемлема только для пострадавших со стабильными показателями гемодинамики (О. Bosc et al., 1984; R. Andersson et al., 1986; J. Hager, 1986; E. Wilke et al., 1987; M. McMahon, 1988; I. Chollet, P. Testas, 1989).
Широко используется лапароцентез, хотя лапароскопия, несомненно, более информативна (С. 3. Горшков, В. С. Волков, 1976; М. М. Абакумов и соавт., 1989). Для диагностики субкапсулярного разрыва селезенки применяется также ангиография; в процессе исследования при необходимости выполняется рентгеноэндоваскулярная окклюзия (Л. С. Зингерман, Т. А. Ахадов, 1986; В. С. Шапкин, В. П. Эсауленко, 1988).
До недавнего времени спленэктомия была единственным методом лечения разрывов и ранений селезенки; основные аргументы для удаления селезенки — обеспечение быстрого и надежного гемостаза, абсолютная безопасность ее потери для организма. И лишь за последние 15—20 лет, в связи в расширением знаний о значении селезенки для организма, коренным образом изменилась лечебная тактика при повреждении этого органа. Функции селезенки действительно многогранны: защитная, гемолизирующая, гемопоэтическая, гемостатическая, гемодинамическая, метаболическая.
Защитная функция селезенки заключается в фильтрации крови, фагоцитозе и образовании антител.
Особенно велико значение селезенки в противомикробной защите. Она содержит около 30% макрофагов (И. Барта, 1976) и играет роль своеобразного фильтра, обеспечивающего захват и обезвреживание микроорганизмов (P. Reinhard, 1982; A. Sibilly et al., 1985; P. Vichard et al., 1985). С помощью этого же механизма селезенка освобождает кровь не только от бактерий, но и от изношенных, состарившихся эритроцитов, тромбоцитов, лейкоцитов; фагоцитоз осуществляется в пульпе (М. Э. Комахидзе, 1971).
Продукция антител — одна из важнейших функций селезенки. Будучи одним из ведущих органов иммунитета, селезенка также активно участвует в образовании специфических иммуноглобулинов и биологически активных пептидов (тафсин, опсонины), стимулирующих фагоцитарную активность лейкоцитов и макрофагов (М. В. Гринев, 1986; В. С. Шапкин, В. П. Эсауленко, 1988; М. Я. Малахова, 2000; Н. Polk, L. Flint, 1983; F. Padova et al., 1985; 1. Seifert et al., 1986). После спленэктомии уменьшается содержание фибронектина, резко падает продукция Т-супрессоров, что ведет к изменению соотношения Т- и В-лимфоцитов, угнетению системы фагоцитоза; снижается иммунный ответ лимфоцитов и синтез антител (С. А. Сам60
сыгин и соавт., 1985; I. Seifert et al., 1986). Поэтому спленэктомия не проходит для организма бесследно — развивается иммунный дефицит (W. Bell et al., 1982), что предрасполагает к генерализации инфекции и возникновению сепсиса у 0,5—2% взрослых пострадавших и у 4—5% детей (A. Traub, J. Perry, Jr, 1982; G. O'Connor et al., 1986). Сепсис может развиться через любой интервал времени после спленэктомии и сопровождается высокой летальностью — 50—80% (М. Durig, F. Harder, 1986; G. Luna, E. Dellinger, 1987). Велика опасность ранних осложнений: поддиафрагмальный абсцесс, панкреатит, пневмония, плеврит, нагноение раны (L. Rosoff et al., 1982; G. Carazza et al., 1984; A. Encke, R. Seufert, 1986). Пострадавшие, перенесшие спленэктомию, из-за снижения резистентности организма к инфекции часто болеют респираторными вирусными заболеваниями, повторными пневмониями, бронхитами, синуситами, ангиной, чему благоприятствует гипертрофия лимфоглоточного кольца и миндалин. Характерны жалобы на общий упадок сил, снижение работоспособности, жизненного тонуса, головную боль, головокружение, предрасположенность к аллергическим заболеваниям. Описанная клиническая картина получила в литературе название постспленэктомический синдром (Р. М. Гланц, М. М. Рожинский, 1973; Н. Л. Кущ и соавт., 1987). Крайне опасно удаление селезенки в детском возрасте, так как несформировавшийся организм лишается существенного звена иммунного ответа, на что впервые обратили внимание Н. King и Н. Schumacker, Jr (1952).
Неблагоприятные последствия спленэктомии для клеточного и гуморального звеньев иммунитета подтверждают не все ученые (Г. А. Баиров и соавт., 1981; В. В. Горячев, 1983; А. П. Пилипенко-Шапкина и соавт., 1987). Это отчасти связано с наличием резидуальной ткани селезенки, которая обнаруживается при сцинтиграфии у 31,2—52% пострадавших, перенесших спленэктомию (S. Alvarez et al., 1987; G. Trombi et al., 1987); реальна положительная роль спленоимплантационного спленоза (В. Ф. Королев, 1981; М. Я. Юдин и соавт., 1989). Последний вдвое чаще выявляется у пострадавших, которым спленэктомия выполнена в связи с тяжелой травмой селезенки, причем иммунофункциональная активность спленоза зависит от критической массы имплантированной ткани (L. Papastamation et al., 1989). Кроме того, в компенсаторном восстановлении иммунологических реакций принимает участие весь лимфоидный аппарат организма — прежде всего путем гипертрофии миндалин, лимфоузлов брыжейки кишечника (В. Г. Горячев, 1983). Следует также учесть, что аденопатия брыжеечных лимфоузлов после спленэктомии может быть причиной болей в животе (Н. Л. Кущ и соавт., 1986).
Помимо дисфункции иммунной системы, спленэктомия иногда ведет к тяжелым нарушениям гемостаза. Развивающийся после нее тромбоцитоз способствует возникновению в раннем послеоперационном периоде тромбозов вен нижних конечностей и даже воротной вены, тромбоэмболии легочной артерии (Н. Д. Скуба, М. Д. Дуды-
рев, 1984; L. Rosoff et al., 1972). В отдаленные сроки эти же осложнения обусловливаются изменениями не количества, а состояния тромбоцитов (М. Durig, 1985). Желудочно-кишечные кровотечения также могут быть следствием тромбоза портальной системы и геморрагического диатеза (J. Ziemski et al., 1987).
Известна роль селезенки в кроветворении: белая пульпа продуцирует лимфоциты, красная — мононуклеары, лейкоциты, моноциты, тромбоциты. В эмбриональном периоде селезенка участвует и в эритропоэза, и эта способность возвращается к ней уже после рождения в случаях недостаточной функции костного мозга (М. Э. Ко-махидзе, 1971). Доказана и гормональная активность селезенки, влияющая на функциональную полноценность желудочно-кишечного тракта, печени, костного мозга, желез внутренней секреции и даже головного мозга.
Селезенка участвует в портальном венозном кровообращении, играя роль «амортизатора» портального давления — аналогично функции желчного пузыря в системе желчных путей (Д. Л. Пиковский, 2000). Спленэктомия отягощает течение и исход лучевой болезни (Л. М. Гольбер, 1977), ослабляет процессы детоксикации в гепатоцитах и их энергоснабжение (М. Э. Краковский, 1986). После спленэктомии отмечается большая частота злокачественных новообразований (М. Durig, 1985). Поэтому хирург, удаляя селезенку, никогда не может быть уверен в будущем полноценном здоровье пострадавшего (А. П. Сорокин и соавт., 1989).
Углубление знаний о функциях селезенки привело к пересмотру лечебных установок при повреждениях органа. Все большее число хирургов стали отдавать предпочтение органосохраняющей тактике. Оказалось, что не любая степень тяжести травмы селезенки предполагает оперативное вмешательство. При поверхностных разрывах, небольшой субкапсулярной гематоме допустима консервативная терапия, особенно у детей (Г. К. Бугулов, 1980; Н. Л. Кущ и соавт., 1988; A. Messinger, P. Schreiber, 1985; R. Andersson, 1986; М. Nallathambi et al., 1988). Тяжесть повреждения селезенки уточняется с помощью ультразвукового исследования и компьютерной томографии. Если среди взрослых консервативное лечение возможно у 43—70% пострадавших (W. Longo et al., 1989; Н. Pachter et al., 1998; К. Cathey et al., 1998), то в детском возрасте — у 63—90% (Th. Baesl, К. Filler, 1985; G. Luna, E. Dellinger, 1987). Ограничение консервативной терапией обязывает к соблюдению постельного режима от 4 суток до 2 недель, причем в первые дни необходима активная аспирация из желудка через назогастральный зонд (L. Morgenstern, 1985; W. Longo et al., 1989). По показаниям проводят гемотрансфузии в объеме до 30% ОЦК (G. O'Connor, G. Geelhoed, 1986). Если в течение первых двух дней наблюдения не удается восстановить кровопотерю или возникают эпизоды неустойчивой гемодинамики, то больного оперируют (К. Zucker et al., 1984; Е. Wiebke et al., 1987). Тяжесть повреждения селезенки отражает прежде всего клиническая картина. Критерием для отбора больных, подлежащих консервативной терапии, яв-
ляются устойчивая гемодинамика, отсутствие анемии, стихающая абдоминальная симптоматика, а также данные ультразвукового исследования или лапароскопии. Согласно сообщению В. М. Розинова и соавт. (2000), из 164 детей с закрытой травмой селезенки органосохраняющее лечение было показано 158 (96,2%), причем консервативной терапией ограничились при лечении 57 детей (36,1%), применение эндоскопической техники с использованием клеевых композиций оказалось эффективно при лечении 94 детей (59,5%), оперативное вмешательство потребовалось только 7 (4,4%) пострадавшим.
Оперативный метод лечения повреждений селезенки остается основным для взрослых. Если во время лапаротомии выявляется легкая степень тяжести повреждения селезенки, то при остановившемся кровотечении ограничиваются дренированием поддиафрагмального пространства, а при продолжающемся незначительном кровотечении гемостаз достигается аппликацией раны гемостатической губкой «Тахокомб». Для остановки кровотечения используют также коагуляцию — инфракрасную или горячим воздухом (P. Klaue, 1985), СО2-лазером (В. Н. Кошелев, Ю. В. Чалык, 1996).
Ушивание раны селезенки является наиболее часто применяемым органосохраняющим вмешательством (D. Kreis et al., 1987), хотя известно, что добиться остановки кровотечения даже при небольшой травме селезенки сложно, так как из-за слабого соединительнотканного остова швы могут «прорезываться», что сопровождается усилением кровотечения (М. Э. Комахидзе, 1971; А. В. Мелешкевич, 1984). Прошивают рану на всю ее глубину. Чтобы уменьшить опасность «прорезывания» швов и усилить гемостатический эффект, предварительно на рану укладывают сальник (Е. Г. Григорьев и соавт., 1988), свободный лоскут брюшины (Б. Е. Стрельников, 1975; Е. М. Шушпанов, 1977) или лоскут брюшины на ножке выкраивают из переднебоковой поверхности брюшной стенки — «вколачивание» селезенки (Д. В. Усов и соавт., 1983); используют также консервированную ксеногенную брюшину (В. Н. Бордуновский, 1992). В этих же целях используются крупнопетлистая створчатая сетка, изготовленная из нитей для сосудистого шва (А. В. Мелешкевич, 1984), целлюлоза (D. Kamran, 1983), тефлоновая или коллагеновая прокладка (F. Moore et al., 1984), полимерная пленка (А. Н. Смирнов и соавт., 1984). Спленорафия показана при поверхностных ранах, краевых отрывках, а также при глубоких, но с ровными краями ранах, не проникающих до ворот органа (М. В. Шеляховский, В. И. Пашкевич, 1983; М. Н. Орлов, 1987).
Имеются сообщения об успешном применении клея при повреждениях селезенки — как самостоятельном методе или дополнительном к спленорафии при глубоких ранах; предварительно осуществляется временный гемостаз пережатием всей сосудистой ножки (В. Т. Апоян и соавт., 1981; Э. А. Степанов и соавт., 1984; J. Scheele et al., 1984; W. Simma et al., 1987). С целью гемостаза используется также лазерокоагуляция (Ю. Г. Шапкин и соавт., 2000).
Поскольку при повреждениях селезенки кровотечение преимущественно артериальное, некоторые хирурги с целью гемостаза, особенно при множественных разрывах или разрывах, проходящих через ворота органа, лигируют сегментарную артерию или основной ствол селезеночной артерии (W. Buntain et al., 1979; P. Klaue, 1985; М. McMahon, 1988). Однако перевязка артерии в области сосудистой ножки не относится к категории простых манипуляций; не всегда удается отпрепарировать артерию от вены, а одновременная их перевязка иногда приводит к некрозу селезенки (М. Э. Комахидзе, 1971). Перевязка же основного ствола селезеночной артерии на протяжении чревата опасностью некроза хвоста поджелудочной железы (Г. С. Топровер, 1964).
Сегментарный способ резекции селезенки основан на автономном кровоснабжении сегментов (J. Dixon et al, 1980; A. Traub et al, 1982). Показанием к сегментарному способу резекции служат обширные разрывы (ранения) селезенки, отрывы полюсов, повреждение сегментарного сосуда. Чтобы обеспечить доступ к воротам селезенки, предварительно рассекают желудочно-ободочную связку, а затем последовательно выделяют и лигируют сегментарную артерию, идущую к месту повреждения, и вены. Ишемизированную часть селезенки иссекают. Края раны обшивают кетгутом; иногда приходится обеспечить временный гемостаз пережатием основного ствола селезеночной артерии (F. Moore et al., 1984). Однако сегментарный способ резекции селезенки технически сложен, прежде всего из-за топографоанатомических особенностей расположения органа, вариабельности уровня деления селезеночной артерии, количества конечных ее ветвей (М. Э. Комахидзе, 1971; Б. Е. Стрельников, 1975; Е. М. Шушпанов, 1977; Г. К. Бугулов, 1980; В. Н. Бордуновский, 1992; F. Bengard, R. Lim, 1985). Селезеночная артерия в воротах селезенки делится на две (80%) или три (15%) сегментарные артерии первого порядка, которые, в свою очередь, делятся на 2—4 ветви второго порядка; у 60% людей дополнительно к сегментарным артериям первого порядка имеется еще верхняя полюсная, а у 80% — нижняя полюсная артерия (К. Frede, 1985; С. Duff et al., 1987). Кроме того, следует еще учесть данные А. П. Сорокина и соавт. (1989), согласно которым у 23% исследуемых селезеночная артерия разветвлялась уже внутриорганно.
Выделение сегментарных артерий, их лигирование и последующая резекция селезенки практически невыполнимы при гематоме в области хвоста поджелудочной железы и тем более на фоне продолжающегося кровотечения из поврежденного органа или его сосудистой ножки, т. е. в наиболее часто встречающихся ситуациях (С. Duff et al., 1987; М. McMahon, 1988). Поэтому заслуживает внимания методика атипичной резекции селезенки, описанная В. В. Дибижевым (1957), которая предполагает удаление части органа с нарушенным вследствие травмы кровообращением. Актуальным остается вопрос: сколько ткани селезенки нужно оставить, чтобы обеспечить ее функциональную полноценность? С. Duff et al. (1987) считают необходимым сохранить не менее '/3, а К. Frede (1985) — '/4 массы органа; однако у них нет
убежденности в том, что оставшаяся масса — «критическая». Возможно, допустима еще большая по объему резекция.
От сберегательной тактики при повреждениях селезенки приходится отказываться при общем тяжелом состоянии пострадавшего, обусловленном сочетанной травмой, тяжелой кровопотерей, а также при фрагментирующих разрывах селезенки, повреждении ее сосудистой ножки или ткани в области ворот, продолжающемся профузном кровотечении из раны органа; относительным противопоказанием к органосохраняющей операции считается наличие раневого перитонита и разрыв патологически измененной селезенки (Н. С. Епифанов, 1992; F. Bengard, R. Lim, 1985; Н. Roth, 1986; В. Vogt, 1986; S. Olivero et al., 1987).
Целесообразность органосохраняющих операций при травме селезенки признана большинством хирургов, однако их широкому внедрению в практику препятствует техническая сложность вмешательства, из-за чего ее удается выполнить не более чем у 25% пострадавших (С. А. Афендулов, 1995; М. Nallathambi et al., 1988). Немногие хирурги применили сберегательную тактику большему числу больных, как правило, это было ушивание раны.
Сегментарная резекция производится в единичных случаях (В. Н. Бордуновский, 1992; F. Bengard, 1985). Лишь F. Moore et al. (1984) сообщили о 19 сегментарных резекциях, причем они не считали наличие раневого перитонита противопоказанием к органосохраняющим вмешательствам.
В настоящее время для ситуаций, когда сохранить селезенку невозможно, как альтернатива спленэктомии предлагается аутотрансплантация. С этой целью используют гомогенизированную ткань (R. Seufert, 1986) или фрагменты селезенки (М. А. Сапожникова и соавт., 1987; В. Д. Тихомирова и соавт., 1988; J. Nielsen et al., 1984), которые помещают в сформированный карман большого сальника (В. И. Пашкевич и соавт., 1990; A. Sibilly et al., 1985), забрюшинно (М. И. Кузин и соавт., 1985) в прямую мышцу живота или подкожную клетчатку (A. Tricarico et al., 1987), на разволокненую поперечную мышцу (И. И. Бачев и соавт., 1990). Учитывая, что, по данным экспериментальных исследований, выживают только периферические клетки аутотрансплантата, питающиеся путем диффузии, осмоса и последующего прорастания сосудов из окружающих тканей (С. Ю. Сафаров и соавт., 1983), следует признать аргументированным мнение хирургов, утверждающих, что гомогенизированная ткань более пригодна для реимплантации (А. С. Зверкова и соавт., 1986; М. McMahon, 1988). Вместе с тем есть сообщения (О. Н. Мироненко, М. X. Абакаров, 1985) о том, что при пересадке селезенки в виде тканевой взвеси процессы структурной перестройки хотя и протекают быстрее, но объем новообразованной ткани незначителен и даже отмечается тенденция к уменьшению ее в последующем. Многие исследователи утверждают, что пересадка ткани селезенки не восполняет полностью функции органа, прежде всего иммунологические (М. П. Павловский и соавт., 1986; R. Andersson et al., 1986).
Кроме того, с возрастом клетки селезенки теряют способность к имплантации (К. Lautering et al., 1987). Существуют и теневые стороны трансплантации. Осложнения, непосредственно обусловленные аутотрансплантацией селезенки, встречаются в 2—3% случаев (W. Bottcher, R. Seufert, 1985). К ним относится нагноение или асептический некроз ткани. Имплантация ткани селезенки между петлями кишок с образованием спленоидов может явиться причиной непроходимости кишечника (В. Ф. Королев, 1981).
Несомненно преимущество органосохраняющих оперативных вмешательств, при которых не нарушаются кровоснабжение и иннервация поврежденной селезенки. С этих позиций резекция селезенки обеспечивает более высокий уровень иммунологической защиты организма по сравнению с аутотрансплантацией ткани селезенки. Следует, однако, отметить, что регенераторная способность селезенки у человека изучена недостаточно. Имеются лишь единичные сообщения, свидетельствующие о такой возможности (L. Morgenstern, 1965, P. Gynzzetta et al., 1987), причем у детей регенераторная активность ткани селезенки оказалась значительно выше, чем у взрослых (М. McMahon, 1988). Разноречивы сведения о регенераторной способности селезенки у животных. Так, по данным М. В. Амиранидзе (1981), после резекции у крыс 50% ткани органа за последующие 30 дней не происходит увеличения оставшейся его части в длину, а в ширину и толщину она даже уменьшается. L. Morgenstern (1965) у собак также не обнаружил регенерации селезенки после ее резекции. Напротив, Т. Б. Тимашкевич (1972) утверждает, что селезенка крыс, мышей, морских свинок, собак способна к регенерации, причем с возрастанием объема резекции ослабевает способность органа к регенерации. Согласно данным А. Г. Бабаевой и Е. А. Зотикова (1987), репаративная регенерация селезенки неоднозначна у разных животных: у кроликов она отсутствует, у мышей и крыс протекает медленно; в то же время исследователи отмечают, что у отдельных подопытных животных через 3 мес после субтотальной резекции селезенки оставшийся участок достигал 90% массы селезенки контрольной группы животных.
В регенерировавшей селезенке сохраняется характерное для интактного органа соотношение массы белой и красной пульп, увеличивается число мальпигиевых телец и наблюдается их гипертрофия, т. е основным способом восстановления массы органа является регенерационная гипертрофия (Т. Б. Тимашкевич, 1972). Существенное значение имеет также заселение регенерата клетками из периферической крови (А. Г. Бабаева, Е. А. Зотикова, 1987). Восстановлению нормальной морфологической структуры селезенки предшествуют тяжелые нарушения микроциркуляции с вторичными некробиотическими изменениями с лизисом лимфоцитов и ретикулярных клеток (М. В. Амиранидзе и соавт., 1986; М. А. Сапожникова и соавт., 1987).
Таким образом, большинство клиницистов, учитывая многогранные функции селезенки, убеждены в необходимости сохранения
поврежденного органа. Однако широкому внедрению органосохраняющей тактики в практику препятствует техническая сложность выполнения сберегательных операций.
Наша клиника располагает 331 наблюдением травмы селезенки разрыв селезенки — у 267 человек, ранения — 64 случая (ножевые — 58, огнестрельные — 6). У 142 (53,2%) пострадавших с разрывом селезенки травма была сочетанной. О тяжести их состояния свидетельствует тот факт, что в среднем на одного больного приходилось по 3 поврежденных анатомических области; чаще травмировались грудь (102) и голова (74). Кроме того, при сочетанной закрытой травме живота множественные повреждения органов встречались в 4 раза чаще, чем при изолированной,— соответственно 40,1 и 11,7%. Если при сочетанной травме превалирующей причиной разрыва селезенки являлись транспортные происшествия (66,4%) и падение с высоты (14,9%), то при изолированной — избиение (67,1%). Ранения у 52 (81,2%) больных носили торакоабдоминальный характер
Распознавание разрыва селезенки основывалось прежде всего на особенностях клинической картины. Особое значение придавали установлению факта внутрибрюшного кровотечения, которое при повреждениях селезенки имеет отличительные особенности, а именно, даже при значительной травме органа периоды кровотечения и гемостаза в ране чередуются. Это обусловлено тампонадой раны сгустками крови, вследствие чего и большая потеря крови не сопровождается тяжелыми нарушениями гемодинамики. Так, только у 15% пострадавших с изолированным разрывом селезенки, у которых объем кровопотери превышал 1 л, выявлены расстройства гемодинамики. Напротив, повреждения сосудистой ножки селезенки или прорыв субкапсулярной гематомы сопровождались яркой клиникой геморрагического шока. Двухмоментный разрыв селезенки мы наблюдали у 15 (5,6%) больных, причем у 10 пострадавших он возник в течение недели с момента повреждения, у 4 — спустя 8—21 день, а у 1 больного — через месяц Непостоянны и другие симптомы кровотечения в свободную брюшную полость. Так, при кровопотере более 1 л притупление перкуторного звука в боковых каналах живота определялось только у 61% больных. Еще реже (27%) при таком же объеме кровопотери в первые часы после травмы развивалась анемия. Относительно редко мы наблюдали симптомы Кера (11,5%) и Элекера (6,8%), что, очевидно, связано с наличием большого контингента пострадавших с сочетанной травмой, поступивших в тяжелом состоянии, когда реакция на боль снижена.
Отсутствие отчетливой клиники внутрибрюшного кровотечения было показанием к использованию инструментальных методов диагностики, среди которых наиболее доступным, простым и в то же время достаточно информативным является лапароцентез. Не-
обходимость в лапароцентезе возникла у 41 (32,8%) пострадавшего с изолированной и у 56 (39,4%) — с сочетанной закрытой травмой селезенки. Лапароскопию провели 15 больным. Для распознавания субкапсулярного разрыва селезенки 7 пострадавшим применена ангиография.
По нашим данным, в течение 6 ч с момента травмы оперированы 74,9% пострадавших с ранениями селезенки и только 45,5% пострадавших с разрывом органа из-за поздней обращаемости последних за медицинской помощью. В первые 3 ч пребывания в стационаре оперативная активность в обеих группах пострадавших была примерно равной — 80,2 и 68,4%, несмотря на значительно большие диагностические сложности распознавания разрыва селезенки. Следует еще принять во внимание, что у 15 пострадавших с субкапсулярным разрывом селезенки клиника внутрибрюшного кровотечения развилась в срок от 2 суток до 1 месяца пребывания в стационаре. Проблем в установлении показаний к операции при ранениях селезенки не возникало, так как 52 человека из 64 пострадавших имели торакоабдоминальное ранение, распознав которое, хирург обязан произвести оперативное вмешательство. У 10 больных клиника внутрибрюшной катастрофы не вызывала сомнений, а у 3 стала отчетливой после кратковременного наблюдения.
Вопрос о необходимости предоперационной подготовки решался индивидуально, с учетом ведущего патогенетического механизма, обусловливающего тяжесть состояния пострадавшего, и проведенной на догоспитальном этапе терапии. При клинике продолжающегося внутрибрюшного кровотечения время на противошоковую терапию не затрачивалось. До вскрытия брюшной полости осуществлялась инфузия кровезаменителей, обладающих гемодинамическим действием, и изотонических растворов кристаллоидов. При лечении острой кровопотери у 179 (67%) пострадавших с разрывом и у 25 (39,1%) — с ранением селезенки использовалась излившаяся в свободную брюшную и плевральную полости кровь. При интенсивном кровотечении к сбору крови приступали и при повреждении полых органов, а целесообразность реинфузии решалась с учетом тяжести кровопотери. Средняя кровопотеря при повреждениях селезенки составляет 2 л, а объем реинфузии — 1,55 л. Однако реинфузия крови еще не решает всех проблем лечения острой кровопотери. Безвозвратная утрата крови неизбежна при массивном внутрибрюшном кровотечении у пострадавших с сочетанной закрытой травмой, при наружной кровопотере — у раненых. Кроме того, переливание больших количеств аутокрови провоцирует развитие гипокоагуляционного синдрома, для профилактики и лечения которого применяли препараты крови, содержащие факторы сгустка.
Оптимальным доступом при повреждениях селезенки считаем срединную лапаротомию. У 10 пострадавших с торакоабдоминальными ранениями с доминирующей клиникой грудного слагаемого травмы корригирующее вмешательство на селезенке произведено при
торакотомии — после расширения раны диафрагмы по типу трансдиафрагмальной лапаротомии.
Органосохраняющие операции удалось выполнить 92 из 267 (34,5%) пострадавших с разрывом и 44 из 64 (68,7%) — с ранением селезенки (табл. 6).
Таблица 6 Объем оперативных вмешательств при повреждениях селезенки
| Характер и тяжесть травмы | Спленэктомия | Органосохраняющие вмешательства | |||
| Шов раны | Резекция органа | Аппликация раны гемостатической губкой | |||
| Закрытая травма | Изолированный разрыв органа | ||||
| Сочетанная травма и множественные повреждения органов | |||||
| Ранение | Изолированное ранение органа | ||||
| ТАР и множественные повреждения органов | |||||
| Всего больных |
У 26 пострадавших при ревизии брюшной полости установлено, что кровотечение из раны селезенки уже остановилось, а количество излившейся крови не превышало 400 мл. В такой ситуации ограничивались аппликацией раны селезенки гемостатической губкой, санацией брюшной полости и дренированием левого поддиафрагмального пространства силиконовой трубкой; рецидива кровотечения не наблюдали.
Ушивание раны поврежденной селезенки произведено у 98 больных. Обычно использовали П-образный или узловой шов. Для профилактики «прорезывания» швов в качестве пластического материала 25 (25,5%) больным применена прядь сальника на питающей ножке.
Крайне сложны для ушивания разрывы в области ворот селезенки. Как уже указывалось, такие повреждения возможны не только при закрытой травме живота, но и во время оперативного вмешательства по поводу разнообразной патологии органов брюшной полости. Эти разрывы сопровождаются упорным кровотечением, которое редко удается остановить консервативными мероприятиями, а ушивание раны обычно осложняется «прорезыванием» швов или повреждением сосудистой ножки, что ведет к усилению кровотечения. Поэтому после длительных безуспешных попыток добиться
гемостаза, когда уже потеряно значительное количество крови, хирург все же вынужден предпринять спленэктомию. Так, по данным С. А. Афендулова (1995), сохранить селезенку при интраоперационном ее повреждении удается лишь у 43,9% больных. Более того, некоторые хирурги считают, что если при мобилизации желудка повреждена селезенка, то нужно ее удалить, не надеясь на гемостатические швы (Н. П. Батян и соавт., 1976). Между тем вынужденная спленэктомия повышает травматичность операции, в связи с чем частота послеоперационных осложнений, преимущественно гнойных, возрастает до 64%, а летальность достигает 25,6% (М. Durig, U. Neff, 1985).
Последствия удаления селезенки при резекции желудка непредсказуемы, так как после перевязки левой и правой желудочной, а также левой желудочно-сальниковой артерий культя желудка кровоснабжается главным образом за счет коротких желудочных артерий, отходящих от селезеночной артерии в области сосудистой ножки селезенки. После лигирования еще и селезеночной артерии культя желудка кровоснабжается только из мелких ветвей нижней пищеводной и нижней диафрагмальной артерий, а это может оказаться недостаточным для питания культи, тем более что нижняя диафрагмальная артерия в 25% случаев отсутствует или начинается от левой желудочной артерии (S. Fell et al., 1983). Поэтому при сочетании резекции желудка со спленэктомией возможен некроз культи желудка (А. С. Лурье, 1971; N. Thompson et al, 1963; S. Fell et al., 1983). В нашей клинике возникло два таких осложнения; оба больных погибли. Вот почему чрезвычайно важно, особенно при резекции желудка, сохранить поврежденную селезенку. В дальнейшем у 14 больных с повреждением селезенки в области ее ворот гемостаз был достигнут с помощью разработанной нами методики шва (рис. 17).
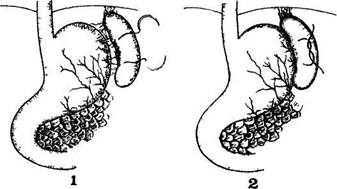
Рис 17 Схема ушивания разрыва в области ворот селезенки 1 — поврежденная
вследствие отрыва желудочно-селезеночной связки селезенка Наложены
серо-серозные швы по большой кривизне желудка, оба конца нити проведены
сквозь селезенку по краям разрыва; 2 — окончательный вид селезенки после
завязывания шва
Методика шва. Накладывается серо-серозный шов по большой кривизне желудка — на расстоянии, соответствующем протяженности кровоточащей раны. Затем оба конца нити сквозным проколом селезенки выводятся на ее диафрагмальную поверхность и завязывается узел — рана селезенки тампонируется стенкой желудка и желудочно-селезеночной связкой. Если игла припаяна только к одному концу нити, то первоначально производится сквозной прокол селезенки с ее диафрагмальной поверхности на внутреннюю, затем следует серо-серозный шов по большой кривизне желудка и вновь сквозной прокол селезенки.
При тяжелой травме селезенки желательно сохранить хотя бы часть органа, однако выполнить это сложно, особенно на фоне продолжающегося кровотечения. Обычно хирург решается на резекцию селезенки при повреждении ее полюса, когда, временно пережав сосудистую ножку, отсекает в одной плоскости поврежденную часть органа, а гемостаз достигается П-образными швами (В. В. Дибижев, 1957; С. А. Афендулов, 1995). По такой методике мы оперировали 5 пострадавших.
Нами разработан технически легко осуществимый способ резекции селезенки, что позволяет расширить показания к его применению (рис. 18).
Способ резекции селезенки. Сосудистая ножка селезенки пережимается кровоостанавливающим зажимом, пересекается и лигируется максимально близко к воротам селезенки, чтобы не повредить верхнюю полярную артерию (задняя полюсная, по А. П. Сорокину и соавт., 1989), которая дает ветви ко дну желудка и верхнему полюсу селезенки (М. Э. Комахидзе, 1971). Клиновидно иссекается
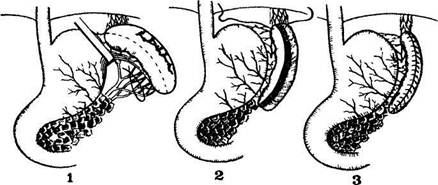
Рис. 18. Схема резекции селезенки 1 — поврежденная вследствие закрытой травмы живота селезенка Для наглядности уровня лигирования сосудистой ножки желудочно-селезеночная связка оттянута крючком Фарабефа, пунктиром намечен объем предполагаемой резекции, 2 — оставшаяся после резекции часть селезенки,
раневая поверхность которой имеет вид усеченного конуса, наложение непрерывного шва; 3 — окончательный вид сохраненной части селезенки
поврежденная часть селезенки с оставлением ткани вдоль прикрепления желудочно-селезеночной связки. Сохраненная часть селезенки хорошо кровоснабжается, о чем свидетельствуют обычный ее цвет и пульсирующее кровотечение из раневой поверхности. Гемостаз обеспечиваем наложением непрерывного обвивного шва атравматичной иглой, что позволяет легко сблизить края селезенки, раневая поверхность полностью закрывается и дополнительной ее перитонизации не требуется. Разработанная нами техника резекции селезенки применена 7 пострадавшим с разрывом селезенки на фоне продолжающегося кровотечения Послеоперационный период у всех больных протекал благоприятно Приводим наблюдение.
Больной С, 16 лет, поступил в отделение сочетанной травмы 29 01 88 г через 15 ч с момента травмы упал, катаясь с ледяной горки В течение ночи беспокоили боли в животе, утром боли усилились, наблюдался кратковременный коллапс Состояние средней тяжести, бледен Пульс 120 уд /мин, АД 120/70 мм рт ст Живот обычной конфигурации, болезненный в левой половине Перитонеальных симптомов нет В левом подреберье пальпируется образование без четких границ Выявляется притупление над отлогими местами живота Анализ крови эритр — 3,7х1012, Hb — 113 г/л, Ht — 35%, лейк — 24,6x109 Диагноз закрытая травма живота, разрыв селезенки, внутрибрюшное кровотечение Оперирован
Верхняя срединная лапаротомия В свободной брюшной полости 1600 мл жидкой крови и 300 г сгустков Установлено, что имеются субкапсулярная гематома селезенки, поперечный разрыв органа по внутренней поверхности с переходом на ворота, продолжающееся кровотечение Пережата, пересечена и лигирована ножка селезенки Клиновидно иссечена поврежденная ткань с оставлением участка вдоль прикрепления желудочно-селезеночной связки 7,0x2,0 см Из раневой поверхности сохраненной части селезенки наблюдалось артериальное кровотечение, которое остановлено наложением обвивного кетгутового шва на атравматической игле Дренировано поддиафрагмальное пространство За время операции реинфузировано 1600 мл крови, донорская кровь не переливалась Послеоперационный период протекал благоприятно Выписан из клиники через 12 дней Проведенные с помощью ультразвукового метода и сцинтиграфии исследования показали, что резецированная селезенка хорошо регенерирует (рис 19 и 20), изучение иммунологического фона подтвердило восстановление функциональной полноценности органа
А В
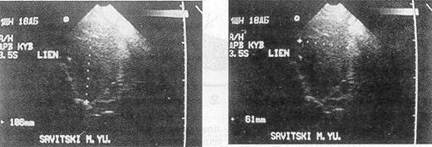
Рис. 19. Эхограмма селезенки больного С через 2 года после субтотальной резекции А — продольный скан, В — поперечный скан Селезенка 10,6x6,1 см, ткань органа гомогенная, мелкозернистая, средней эхогенности
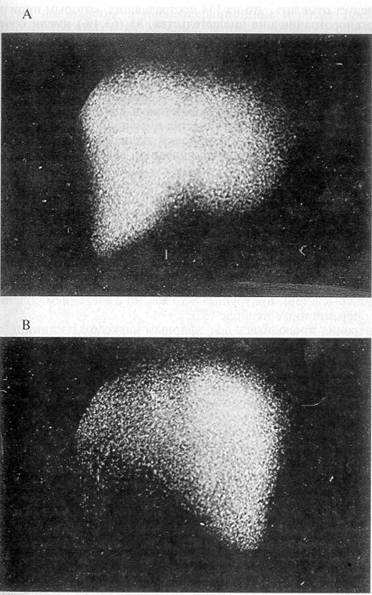
Рис 20 Гепатолиеносцинтиграмма того же больного через 2 года после резекции селезенки А — передняя проекция, В — задняя проекция На передней поверхности изображение печени, положение ее обычное, размер 16x12x19 см, контуры нечеткие, контрастна Распределение радиофармпрепарата диффузно-неравномерное На задней проекции изображение печени и селезенки, селезенка расположена обычно, размер 11x6 см, контуры нечеткие, форма бобовидная, распределение радиофармпрепарата неравномерное
Следует отметить, что из 134 пострадавших, которым произведены органосохраняющие вмешательства, 85 (63,4%) имели сочетанную травму или множественные повреждения органов брюшной полости, причем у 11 из них была нарушена целостность желудочно-кишечного тракта, а у больных, перенесших резекцию селезенки по разработанному нами способу, исходная кровопотеря составляла в среднем 1450 мл.
Отсутствие возможности проведения в клинике морфологических, а также достаточного количества иммунологических исследований стало основанием для постановки эксперимента, тем более что репаративная регенерация резецированной селезенки изучена недостаточно.
Регенераторная и функциональная способность селезенки, направленная на поддержание иммунологического гомеостаза, изучена нами на 150 крысах-самцах смешанной популяции, массой 180— 200г, содержащихся в виварии на обычном рационе. Животные разделены на 6 групп: 1-я группа — интактные крысы (9); 2-я — крысы после лапаротомии и пальпации селезенки (23); 3-я — крысы, перенесшие резекцию 3/4 селезенки (38); 4-я — то же, но с введением спленина в послеоперационном периоде (10); 5-я — спленэктомированные крысы (38); 6-я группа — то же, но с введением спленина в послеоперационном периоде (32).
Операция проводилась под эфирным наркозом срединной лапаротомией. Сохранялась проксимальная часть селезенки с питающими ее сосудами, проходящими в желудочно- и диафрагмально-селезеночной связках.
Крыс «забивали» декапитацией через 2 недели, 1,5 и 3 мес после операции (с полным забором крови). Изучались масса животных и оставшейся части селезенки, морфология селезенки и тесты, отражающие состояние иммунологического статуса, а именно: число антителообразующих клеток (АОК) в селезенке, синтезирующих IgM,— по методу К. Jerne, A. Nordin (1983), гемагглютинирующие антитела по реакции гемагглютинации (К. Мальберг, 1987), фагоцитарная активность нейтрофилов (Д-фагоцитоз), фагоцитарное число и фагоцитарный индекс (Р. В. Петров, 1984), проводился анализ лейкограммы. Для морфологических исследований материал фиксировали в 10% растворе нейтрального формалина, заливали в парафин; срезы окрашивали гемотоксилином и эозином.
Спленин применяли из расчета 0,25 мг/кг внутримышечно, 2 инъекции в сутки в течение 6 дней после операции (М. Э. Краковский, 1986).
Спленэктомия у лабораторных животных сопровождалась высокой летальностью. Из 70 крыс, подвергнутых спленэктомии, погибли 48 (68,6%), причем у 34 смерть наступила на 4—7-й день после операции, что исключает роль шока и анестезии как причины смерти; еще 8 животных погибли на протяжении второй недели, 6 — в более отдаленные сроки. Нами не выявлена терапевтическая эффективность спленина у спленэктомированных животных: из 38
крыс, не получавших в послеоперационном периоде препарат, погибло 26 (68,4%), а из 32 крыс, которым вводился спленин,— 22 (68,7%). Из 23 крыс, которым выполнена только лапаротомия, погибли 2 (8,6%), а из 48 животных после субтотальной резекции селезенки — 3 (6,2%), т. е. летальность в этих двух группах животных оказалась практически равной и значительно ниже, чем у крыс с удаленной селезенкой.
Через 2 недели после резекции селезенки масса оставшейся ее части уже возросла вдвое: у крыс, которым не вводился спленин,— на 193,3%, а у получавших препарат — на 210,4%. Морфологические исследования показали, что это связано с выраженным полнокровием, отеком и «разрыхлением» стромы органа в раннем послеоперационном периоде (рис. 21).
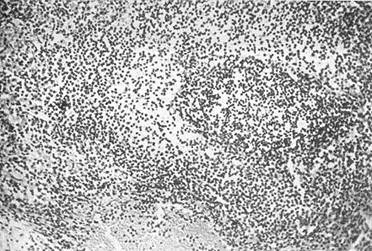
Рис. 21. Селезенка крысы через 2 недели после резекции: окраска гемотоксилином и эозином х 160; отек, полнокровие, «разрыхление» стромы, красной пульпы
Встречались лимфоидные фолликулы разных размеров: крупные гипертрофированные с широкими центрами размножения, средние, а также очень много мелких (рис. 22). Характерным для этого срока было «разрыхление» маргинальных и расширение парафолликулярных зон, выраженное полнокровие красной пульпы (рис. 23).
Имеет место оживленная макрофагальная реакция — макрофаги содержат крупные глыбки бурого пигмента, наряду с макрофагами встречаются лейкоциты; в красной пульпе — обилие незрелых и зрелых плазматических клеток. Синусы нередко оказывались расширенными и в них обнаруживались различные клетки: лимфоциты, лейкоциты, макрофаги (рис. 24).
Инфильтрация лейкоцитами отмечалась и в капсуле селезенки. В последующий месяц масса селезенки не только не увеличилась, но
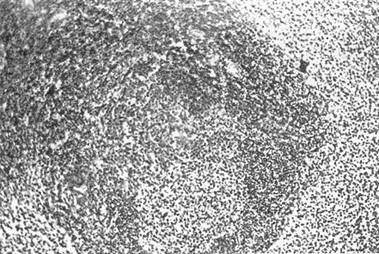
Рис. 22. Селезенка крысы через 2 недели после резекции: окраска гемотоксили-ном и эозином х240; гипертрофия фолликула, широкий центр размножения
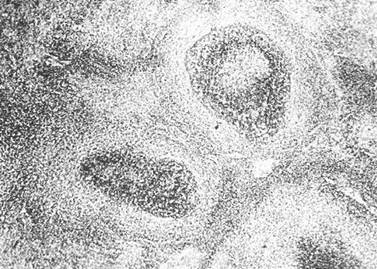
Рис. 23. Селезенка крысы через 2 недели после резекции: окраска гемотоксилином и эозином х160; скопление лейкоцитов и макрофагов в синусах и красной пульпе
даже несколько уменьшилась. В ткани селезенки уже преобладали крупные фолликулы с отчетливо сформированной структурой, а в красной пульпе — зрелые плазмоциты и макрофаги. Парафолликулярные зоны оставались широкими и обильно инфильтрированными лейкоцитами, лимфобластами, плазмобластами (рис. 25). Через
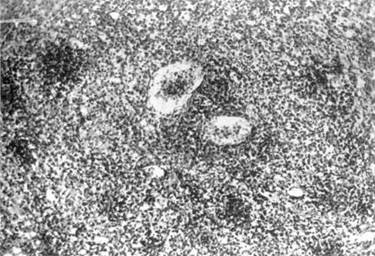
Рис. 24. Селезенка крысы через 2 недели после резекции: окраска
гемотоксилином и эозином х160; расширение парафолликулярных зон вокруг
крупных и средних фолликулов (В-зоны)
Рис. 25. Селезенка крысы через 1,5 мес после резекции: окраска гемотоксилином и эозином х160; крупный фолликул, расширение В-зоны, содержащей лимфоциты,
плазмоциты
3 мес масса субтотально резецированной селезенки увеличилась с 146,2±19,5 до 362,6+17,0 мг, т. е. более чем в 2 раза (рис. 26). Структура селезенки к этому времени полностью восстановилась: фолликулы сформированы по типу зрелых, отчетливо различимы центральная артериола, а также В- и Т-зоны (рис. 27). У крыс, которым
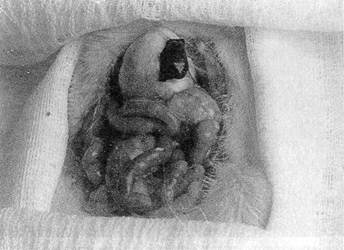
Рис 26 Селезенка крысы через 3 мес после резекции
Р и с 27 Селезенка крысы через 3 мес после резекции окраска гемотоксилином и эозином х160, зрелый фолликул
после резекции селезенки вводился спленин, динамика морфологических изменений регенерата была без существенных особенностей.
У крыс контрольной группы, перенесших лапаротомию и пальпацию селезенки, по прошествии 2 недель обнаружено умеренно выраженное полнокровие пульпы — в большей степени синусов. Для красной пульпы было характерно равномерное распределение макрофагов, нагруженных бурым пигментом; количество плазмоцитов умеренное. Встречались фолликулы различных размеров с отчетливой структурой. Капсула несколько утолщена и инфильтрирована небольшим количеством лейкоцитов и макрофагов, под капсулой видны тяжи вытянутых клеток — созревающих фибробластов. Через 1,5 мес фолликулы имели свойственную им структуру, а клеточный состав красной пульпы был обычный: лимфоциты, макрофаги, зрелые плазмоциты; отмечалось огрубение стромы и утолщение трабекул. Исследование селезенки с интервалом в 3 мес после операции выявило нормальное ее строение; сохранялось небольшое утолщение капсулы и трабекул. Красная пульпа содержала активные макрофаги, лимфоциты, обилие плазмоцитов с характерной для этих клеток структурой.
Наиболее информативными тестами, отражающими защитную функцию селезенки, являются определение содержания антител в крови и определение антителообразующих клеток непосредственно в ткани органа. Уже только лапаротомия и пальпация селезенки способствовали увеличению содержания антител — через 1,5 мес после вмешательства с 4,88±1,01 до 8,04+0,34 (Р<0,05). Последующее незначительное уменьшение количества антител — до 7,40±0,96 — не выходит за допустимые границы вариабельности их концентраций. Особый интерес представляет динамика содержания антител после резекции селезенки. Если их нормальную концентрацию через 2 недели после резекции можно объяснить циркуляцией в крови антител, выработанных еще до операции, а также вследствие реакции всей макрофагальной системы, включая и оставшуюся часть органа, то возросший уровень антител спустя 3 мес свидетельствует о восстановившейся функциональной активности регенерировавшей ткани селезенки. Правомочность такого заключения подтверждается сравнительными исследованиями, проведенными у крыс с удаленной селезенкой. В этой группе животных через 3 мес после спленэктомии отмечено резкое уменьшение содержания антител — с 4,88+1,01 до 3,25+1,17(Р<0,05). Это свидетельствует о том, что полностью возместить утраченную функцию селезенки в поддержании иммунологического гомеостаза макрофагальная система животного не в состоянии.
Количество антителообразующих клеток на 1 млн. ядросодержащих клеток ткани резецированной селезенки через 2 недели после операции соответствовало их содержанию у животных контрольной группы; в более отдаленные сроки количество антителообразующих клеток оставалось в пределах нормы, что возможно только при адекватном кровоснабжении регенерата, благодаря чему пульпа не замещалась рубцовой тканью.
Об активном участии регенерата селезенки в поддержании иммунологического статуса животных свидетельствовал и тот факт, что резекция селезенки не повлекла за собой нарушения фагоцитарной функции нейтрофилов, тогда как у крыс, перенесших спленэктомию, она достоверно снижалась уже через 2 недели и не восстанавливалась полностью к 3 мес. После резекции селезенки существенно не изменилась и лейкограмма, а спленэктомия повлекла за собой нейтропению, моноцитоз и эозинофилию. Снижение количества эритроцитов мы отмечали только у крыс с удаленной селезенкой. Спленин не повышал функциональную и регенераторную активность резецированной селезенки и не стимулировал работу макрофагальной системы у животных, перенесших спленэктомию.
Послеоперационный период протекал с осложнениями у 63 (19%) больных: у 48 (18%) — с разрывом и у 15 (23,4%) — с ранениями селезенки Несомненно, частота возникновения осложнений была обусловлена тяжестью травмы Так, после спленэктомии по поводу изолированного разрыва селезенки осложнения наблюдались у 13 (16,7%) из 78 оперированных, а среди пострадавших с сочетанной закрытой травмой и множественными повреждениями органов брюшной полости — у 35 (36,1%) из 97, т. е. в 2 раза чаще. Осложнения после органосохраняющих вмешательств развились лишь у 2 (4,3%) из 46 больных с изолированным разрывом селезенки и у 14 (31,1%) из 45 пострадавших с сочетанными повреждениями. При ранениях селезенки послеоперационные осложнения также отмечены только среди пострадавших с торакоабдоминальными ранениями и множественными повреждениями органов, причем из 20 перенесших спленэктомию они развились у 10 (50%), а после органосохраняющих операций — у 8 (20,5%) из 39. Частота гнойных осложнений после спленэктомии и органосохраняющих вмешательств оказалась равной, соответственно, 16,2 и 19,4%.
У 30 (9,1%) пострадавших в связи с развившимися внутрибрюшными осложнениями потребовалась релапаротомия. Наиболее частым показанием к релапаротомии являлась ранняя спаечная непроходимость кишечника (8 наблюдений), основной причиной которой была недостаточно тщательная санация брюшной полости. Внутрибрюшное кровотечение (у 7 больных) чаще являлось следствием перевязки всей желудочно-селезеночной связки одной лигатурой, которая вскоре «соскальзывала» У одной пострадавшей первичное вмешательство выполнено по поводу прорыва субкапсулярной гематомы селезенки, что сопровождалось массивным кровотечением; разрыв ушит. В связи с тем, что рана селезенки не была прошита на всю глубину, в послеоперационном периоде возобновилось кровотечение Во время релапаротомии произведена резекция селезенки по разработанной нами методике. Еще у 1 больного мы наблюдали кровотечение из культи сосудистой ножки. У 5 человек с разрывом селезенки из-за недостаточной ревизии брюшной полости и забрюшинного пространства не выявлены повреждения еще и других органов: отрыв сегмента подвздошной кишки от брыжейки — на фоне спаечного процесса; ушиб
желчного пузыря с последующим развитием посттравматического деструктивного холецистита; внебрюшинный разрыв мочевого пузыря, отрыв прилоханочного отдела мочеточника; разрыв левой почки Поддиафрагмальный абсцесс у 3 больных явился следствием неполноценного гемостаза и у 2 — травмы хвоста поджелудочной железы В клинику из районов области поступили 4 больных с желудочно-плевральными свищами, развившимися после спленэктомии. Поэтому после удаления селезенки необходимо убедиться в целостности большой кривизны желудка, показана перитонизация большой кривизны по линии прикрепления желудочно-селезеночной связки
Погибли 43 (13%) пострадавших: при разрыве селезенки — 36 (13,5%), ранениях — 7 (10,9%). Все умершие имели сочетанную травму или множественные повреждения органов. Об исходной тяжести состояния этого контингента пострадавших свидетельствует тот факт, что 2 умерли вскоре после госпитализации и диагноз у них при жизни не был верифицирован, 9 человек умерли во время операции, 12 — в ближайшие часы после вмешательства. Непосредственной причиной смерти 20 пострадавших были травматический шок и массивная кровопотеря, 9 — тяжелая травма головы, 3 — груди, a 11 — послеоперационные осложнения, перитонит — 4, пневмония — 4, печеночно-почечная недостаточность — 3.
Тяжесть состояния пострадавших в значительной мере определялась объемом кровопотери, которая несомненно значительно выше при сочетанной травме — не только вследствие большего разрушения селезенки и возможного повреждения других паренхиматозных органов, а следовательно, и более тяжелого кровотечения в брюшную полость, но также и в плевральную, забрюшинное пространство, мягкие ткани конечностей. Летальность при кровопотере до 1 л составила 1,8%, от 1 до 3 л — 13,5%, свыше 3 л — 50%. Именно объемом и интенсивностью кровотечения объясняется такой, казалось бы, парадоксальный факт, что летальность среди оперированных в первые 6 ч с момента травмы выше (23,7%) в сравнении с оперированными в более поздние сроки (7,3%), т. е. при профузном кровотечении пострадавшие редко живут дольше 6 ч, и только ранняя операция является реальным шансом на благоприятный исход.
По нашим данным, при закрытой травме селезенки летальность после спленэктомии составила 19,5%, органосохраняющих вмешательств — 5,7%, при ранениях — соответственно 36,4 и 6,2%. Однако утверждать, что благодаря только органосохраняющим операциям удалось в несколько раз снизить послеоперационную летальность, невозможно, так как это не сравнимый по тяжести травмы контингент больных.
 2015-03-08
2015-03-08 1341
1341








