1. Гормональная регуляция. Глюкокортикоиды проникают в клетку, усиливают биосинтез ферментов глюконеогенеза, способствуют повышению уровня сахара в крови.
2. Метаболическая регуляция. Ацетил-КоА стимулирует пируваткарбоксилазу, осуществляющую реакцию превращения пирувата в ЩУК и далее в глюкозу. АТФ участвует в процессах карбоксилирования, стимулирует глюкозо-6-фосфатазу и фруктозо-1,6-бисфосфатазу, усиливает процессы глюконеогенеза. Витамин Н (биотин) – кофермент пируваткарбоксилазы. Фруктозо-2,6- дифосфат ингибирует фруктозо-1,6-бисфосфатазу.
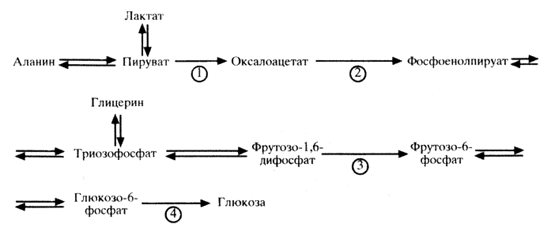
Цикл Кори. В процессе анаэробного гликолиза в скелетных мышцах образуется лактат, который выходит из клеток в кровь, доставляется в печень, где включается в реакции глюконеогенеза с образованием глюкозы. Глюкоза выходит в кровь, доставляется к тканям, где используется как источник энергии. Цикл Кори выполняет две важные функции: 1) обеспечивает утилизацию лактата в реакциях глюконеогеназа; 2) предотвращает накопление лактата и развитие лактоацидоза (смещение рН в кислую сторону)
56. Глюконеогенез у детей. Лабильность этого процесса у ребенка.
57. Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена, мобилизация гликогена. Регуляция обмена гликогена гормонами и аллостерическая регуляция. Особенности распада гликогена в печени и мышцах. Гликогенозы и агликогенозы
Гликоген – высокомолекулярный полимер, построенный из остатков глюкозы, связанных α-1,4- и α-1,6-гликозидными связями. В большом количестве содержится в печени и мышцах. Гликоген упакован в гранулы, размер которых 100 – 400 А. В гранулах находятся ферменты синтеза и распада гликогена. Распад гликогена происходит в интервалах между приемами пищи; этот процесс ускоряется при физических нагрузках. Гликогенолиз происходит за счет отщепления остатков глюкозы в виде глюкозо-1-фосфата. Фермент гликогенфосфорилаза расщепляет α-1,4-гликозидные связи в гликогене в результате остаются 4 остатка глюкозы до места ветвления (α-1,6-гликозидная связь). Олигосахаридтрансфераза переносит фрагмент гликогена (состоящий из трех остатков глюкозы) на неразветвленный участок цепи, остается один остаток глюкозы, связанный α-1,6-гликозидной связью. Фермент α-1,6-глюкозидаза отщепляют мономерный остаток глюкозы. Суммарная реакция: Глюкозо-1-фосфат изомеризуется в глюкозо-6-фосфат под действием фосфоглюкомутазы. Образующийся глюкозо-6-фосфат вступает в реакции гликолиза (или пентозного цикла) клеток мышц и мозга, а в клетках печени, почек и кишечника происходит дефосфорилирование глюкозо-6-фосфата с образованием глюкозы и фосфорной кислоты (под действием фермента глюкозо-6-фосфатазы). Далее глюкоза поступает в кровь и разносится с кровью к тканям. Гормональная регуляция обмена гликогена осуществляется адреналином, глюкагоном и инсулином. Адреналин и глюкагон активируют распад гликогена и тормозят его синтез. Гормональная регуляция опосредуется общими механизмами через ц-АМФ, который активирует цитозольные ферменты протеинкиназу, киназу фосфорилазы и киназу гликогенсинтазы. Киназы при участии АТФ фосфорилируют ферменты гликогенфосфорилазу и гликогенсинтазу. Фосфорилаза активна в фосфорилированном состоянии, поэтому под действием адреналина и глюкагона активируется распад гликогена, а гликогенсинтаза, напротив, в фосфорилированном состоянии становится неактивной, поэтому синтез гликогена под действием адреналина и глюкагона тормозится. Под действием инсулина активируются ферменты фосфодиэстераза и фосфопротеинфосфатазы. Фосфодиэстераза разрушает ц-АМФ; фосфопротеинфосфатазы катализируют дефосфорилирование ферментов гликогенфосфорилазы и гликогенсинтазы. Фосфорилаза в дефосфорилированном состоянии становится неактивной и процесс распада гликогена прекращается, а гликогенсинтаза, напротив, активируется, поэтому под действием инсулина активируется синтез гликогена.
Заболевания, связанные с обменом гликогена: гликогенозы и агликогенозы.
1. Болезнь Гирке (недостаток глюкозо-6-фосфатазы печени). Клиническая картина: увеличение печени уже в период новорожденности, гипогликемия между приемами пищи, гипогликемия, сохраняющаяся при действии адреналина и глюкагона, нарушение жирового обмена (усиливается отложение жира в подкожной клетчатке и внутренних органах).
2. Болезнь Форбса-Кори (дефицит фермента амило-1,6-глюкозидазы печени): неполное расщепление гликогена, гепатомегалия, мышечная слабость, гипогликемия. Эта болезнь не угрожает жизни ребенка, хотя может привести к задержке физического развития и полового созревания. У некоторых больных в подростковом возрасте отмечается умеренная миопатия, т.к. понижена мышечная утилизация гликогена.
3. Болезнь Андерсена (недостаток активности «ветвящего» фермента в печени): гепатоспленомегалия, цирроз печени, прогрессирующая печеночная недостаточность - длинные неразветвленные цепи плохо разрушаются; развивается цирроз печени. Эта болезнь встречается крайне редко и всегда приводит к ранней смерти.
4. Болезнь Херса (недостаток активности печеночной фосфорилазы): гепатомегалия, умеренная гипергликемия, ацидоз. Данная патология встречается крайне редко и только у мальчиков.
5. Болезнь Мак-Ардля (недостаток мышечной фосфорилазы): спазмы мышц при нагрузке, преходящая миоглобинурия. Агликогенозы – наследственное заболевание, вызванное дефектом гликогенсинтазы. В печени почти или полностью отсутствует гликоген, выражена гипогликемия (0,39 – 0,67 ммоль/л). Характерный симптом – у детей судороги обычно по утрам. Их можно предупредить частым кормлением ночью. Гипогликемия новорожденных. Наблюдается у всех новорожденных из-за прекращения поступления крови через плаценту (преходящая гипогликемия). Коррекция происходит быстро и самостоятельно. У новорожденных, матери которых страдают сахарным диабетом, может быть тяжелая гипогликемия – проявление функционального гиперинсулинизма, устраняемое только введением глюкозы
58. Своеобразие метаболизма гликогена в печени у ребенка. Патология обмена гликогена (гликогенозы).
Биосинтез гликогена. При голодании гликоген распадается до небольшого фрагмента, содержащего 4-6 остатков глюкозы, связанных α-1,4-гликозидными связями. Этот фрагмент гликогена называется «затравкой» (или праймером); на нем начинается процесс биосинтеза гликогена. Глюкоза вступает в синтез гликогена в «активной» форме УДФ-глюкозы. В период пищеварения глюкоза поступает в клетку и фосфорилируется с образованием глюкозо-6-фосфата под действием фермента гексокиназы (или глюкокиназы в печени), затем изомеризуется в глюкозо-1-фосфат под действием фосфоглюкомутазы. Глюкозо-1-фосфат превращается в УДФ-глюкозу под действием фермента УДФ-глюкуронилтрансферазы. Реакция, катализируемая гликогенсинтазой, возможна лишь в том случае, когда в цепи «затравки» гликогена содержится более 4-6 остатков глюкозы:
УДФ-глюкоза + гликоген (n) → гликоген (n+1) + УДФ, где n ≥ 4-6.
УДФ-глюкоза взаимодействует с нередуцированным остатком цепи. Ветвление гликогена осуществляется ферментом амило-1,4-1,6-глюкозилтрансферазой («гликогенветвящий» фермент). Этот фермент присоединяет полисахаридную цепочку (n ≥7) с помощью α-1,6-гликозидной связи (точка ветвления). В месте ветвления находится 10-12 остатков глюкозы, от ближайшего места ветвления не менее 4 остатков глюкозы.
Значение ветвления: увеличивается растворимость, ускоряется рост полисахаридной цепи.
59. Регуляция углеводного обмена: саморегуляция, нейрогуморальная регуляция. Механизм действия глюкозы, адреналина, инсулина и глюкокортикоидов на обмен углеводов. Уровень глюкозы крови в норме. Гипергликемия и гипогликемия. Нарушения обмена углеводов при сахарном диабете. Биохимическая диагностика сахарного диабета
В регуляции постоянства концентрации сахара в крови главную роль выполняет печень. При избыточном поступлении углеводов в организм в печени происходит накопление гликогена, а при недостаточном поступлении, наоборот, гликоген, в ней распадается до глюкозы. Таким образом поддерживается нормальное количество сахара. Постоянство содержания глюкозы в крови, гликогена в печени регулируется нервной системой. На обмен углеводов оказывает влияние кора больших полушарий головного мозга. Доказательством этого является повышение сахара в моче у студентов после трудного экзамена. Центр углеводного обмена находится в гипотоламусе и продолговатом мозге. Влияние гипоталамуса и коры больших полушарий на углеводный обмен осуществляется преимущественно посредством симпатической нервной системы, которая вызывает усиленную секрецию адреналина надпочечниками. Большое значение в углеводном обмене имеют железы внутренней секреции — поджелудочная, щитовидная, надпочечники, гипофиз и др., которые под действием ЦНС регулируют ассимиляцию и диссимиляцию углеводов. Гормон поджелудочной железы инсулин переводит глюкозу в гликоген и тем самым уменьшает количество сахара в крови. Адреналин и гликогон увеличивают расщепление гликогена в печени, в мышцах, вследствие чего увеличивается содержание сахара в крови. Следовательно, инсулин — это сахаропонижающий гормон, гликогон — сахароповышающий. При снижении концентрации сахара в крови возбуждается центр углеводного обмена в гипоталамусе, который дает импульсы поджелудочной железе, и она увеличивает выработку глюкагона до тех пор, пока содержание глюкозы за счет распада гликогена не увеличится до нормального уровня.
60. Лабильность уровня глюкозы в крови у детей раннего возраста. Наклонность к гипогликемии. Своеобразие учета результатов нагрузной пробой сахара у детей.
Нарушение углеводного обмена. Сахарный диабет. Важным показателем гомеостаза является концентрация глюкозы в крови. В норме концентрация глюкозы в крови 3,3 – 5,5 ммоль/л. Больше 5,5 ммоль/л – гипергликемия. В норме сахар в моче отсутствует. Почечный порог для глюкозы – 10 ммоль/л или 180 мг% в крови. Для уточнения диагноза сахарный диабет проводят тест на толерантность к глюкозе. Тест на толерантность к глюкозе (метод сахарной нагрузки). Перед проведением теста в течение 3-х дней рекомендуется низкоуглеводная диета. В день анализа пациенту натощак дают выпить раствор 100 г глюкозы/100 мл воды. Концентрацию глюкозы определяют в трех пробах крови: натощак, через 60 и через 120 минут после «Сахарной нагрузки». Результат на фоне здоровья: натощак менее 5,55 ммоль/л, через 60 мин. – менее 8,88 ммоль/л, через 120 мин. – менее 6,66 ммоль/л. На основе полученных данных строят «сахарные кривые»: Особенности сахарной нагрузки у детей. До 6 лет дают 1,5 г/кг веса, от 6 до 12 – 2 г/кг веса, после 13 лет по 2,5 г/кг веса. Наличие гипергликемии через 2 часа после начала исследования, глюкозурия и обнаружение кетоновых тел в моче – триада симптомов для постановки диагноза сахарный диабет. Содержание глюкозы в моче определяют пробой Бенедикта.
61. Пищевые жиры, их гидролиз. Всасывание продуктов переваривания. Роль желчных пигментов в переваривании и всасывании липидов. Транспорт ресинтезированных в кишечнике жиров. Использование жиров, включенных в транспортные липопротеины: липопротеинлипазы. Гиперлипопротеинемия.
Жиры, или триглицериды — природные органические соединения, полные сложные эфиры глицерина и одноосновных жирных кислот; входят в класс липидов. В живых организмах выполняют структурную, энергетическую и др. функции. Наряду с углеводами и белками, жиры — один из главных компонентов питания. Жидкие жиры растительного происхождения обычно называют маслами.
Гидролиз жиров. Расщепление жиров на глицерин и жирные кислоты проводится обработкой их щёлочью — (едким натром), перегретым паром, иногда — минеральными кислотами. Этот процесс называется омылением.
Липопротеинлипаза — фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе.
Гиперлипидемия (гиперлипопротеинемия) — аномально повышенный уровень липидов и/или липопротеинов в крови человека. Нарушение обмена липидов и липопротеинов встречается довольно часто в общей популяции. Гиперлипидемия является важным фактором риска развития сердечно-сосудистых заболеваний в основном в связи со значительным влиянием холестерина на развитие атеросклероза. Кроме этого, некоторые гиперлипидемии влияют на развитие острого панкреатита.
62. Особенности переваривания и всасывания жиров в организме ребенка.
Расщепление триглицеридов в пищеварительном тракте. Слюна не содержит расщепляющих жиры ферментов. Следовательно, в полости рта жиры не подвергаются никаким изменениям. У взрослых людей жиры проходят через желудок также без особых изменений. В желудочном соке содержится липаза, получившая название желудочной, однако роль ее в гидролизе пищевых триглицеридов у взрослых людей невелика. Во-первых, в желудочном соке взрослого человека и других млекопитающих содержание липазы крайне низкое. Во-вторых, рН желудочного сока далек от оптимума действия этого фермента (оптимальное значение рН для желудочной липазы 5,5–7,5). Напомним, что значение рН желудочного сока около 1,5. В-третьих, в желудке отсутствуют условия для эмульгирования триглицеридов, а липаза может активно действовать только на триглицериды, находящиеся в форме эмульсии. Поэтому у взрослых неэмульгированные триглицериды, составляющие основную массу пищевого жира, проходят через желудок без особых изменений. Вместе с тем расщепление триглицеридов в желудке играет важную роль в пищеварении у детей, особенно грудного возраста. Слизистая оболочка корня языка и примыкающей к нему области глотки ребенка грудного возраста секретирует собственную липазу в ответ на сосательные и глотательные движения (при кормлении грудью). Эта липаза получила название лингвальной. Активность лингвальной липазы не успевает ≪проявиться≫ в полости рта, и основным местом ее воздействия является желудок. Оптимум рН лингвальной липазы в пределах 4,0–4,5; он близок к величине рН желудочного сока у таких детей. Лингвальная липаза наиболее активно действует на триглицериды, содержащие жирные кислоты с короткой и средней длиной цепи, что характерно для триглицеридов молока. Иными словами, жир молока – самый подходящий субстрат для этого энзима. У взрослых активность лингвальной липазы крайне низкая. Расщепление триглицеридов в желудке взрослого человека невелико, но оно в определенной степени облегчает последующее переваривание их в кишечнике. Даже незначительное по объему расщепление триглицеридов в желудке приводит к появлению свободных жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и способствуют там эмульгированию жиров, облегчая таким образом воздействие на них липазы панкреатического сока. После того как химус попадает в двенадцатиперстную кишку, прежде всего происходит нейтрализация попавшей в кишечник с пищей соляной кислоты желудочного сока бикарбонатами, содержащимися в панкреатическом и кишечном соках. Выделяющиеся при разложении бикарбонатов пузырьки углекислого газа способствуют хорошему перемешиванию пищевой кашицы с пищеварительными соками. Одновременно начинается эмульгирование жира. Наиболее мощное эмульгирующее действие на жиры оказывают соли желчных кислот, попадающие в двенадцатиперстную кишку с желчью в виде натриевых солей. Большая часть желчных кислот конъюгирована с глицином или таурином. Желчные кислоты представляют собой основной конечный продукт метаболизма холестерина. В желчи человека в основном содержатся холевая (3,7,12-триоксихолановая), дезоксихолевая (3,12-диоксихолановая) и хенодезоксихолевая (3,7-диоксихолановая) кислоты (все гидроксильные группы имеют α-конфигурацию и поэтому обозначены пунктирной линией). Кроме того, в желчи человека в малых количествах содержатся литохолевая (3α-оксихолановая) кислота, а также аллохолевая и уреодезоксихолевая кислоты – стереоизомеры холевой и хенодезоксихолевой кислот. Как отмечалось, желчные кислоты присутствуют в желчи в конъюгированной форме, т.е. в виде гликохолевой, гликодезоксихолевой, гли- кохенодезоксихолевой (около 2/3 – 4/5 всех желчных кислот) или таурохолевой, тауродезоксихолевой и таурохенодезоксихолевой (около 1/5 – 1/3 всех желчных кислот) кислот. Эти соединения иногда называют парными желчными кислотами, так как они состоят из двух компонентов – желчной кислоты и глицина или таурина. Соотношения между конъюгатами обоих видов могут меняться в зависимости от характера пищи: в случае преобладания в ней углеводов увеличивается относительное содержание глициновых конъюгатов, а при высокобелковой диете – тауриновых конъюгатов. Считают, что только комбинация соль желчной кислоты + ненасыщенная жирная кислота + моноглицерид придает необходимую степень эмульгирования жира. Соли желчных кислот резко уменьшают поверхностное натяжение на поверхности раздела жир/вода, благодаря чему они не только облегчают эмульгирование, но и стабилизируют уже образовавшуюся эмульсию.
63. Химизм окисления жирных кислот, его связь с митохондриальным окислением. Энергетика окисления жирных кислот. Значение этого процесса для организма. Нарушение окисления жирных кислот при авитаминозах.
Окисление жирных кислот протекает в печени, почках, скелетных и сердечной мышцах, в жировой ткани. В мозговой ткани скорость окисления жирных кислот весьма незначительна; основным источником энергии в мозговой ткани служит глюкоза. Жирные кислоты, входящие в состав естественных жиров животных и растений, имеют четное число углеродных атомов. Любая такая кислота, от которой отщепляется по паре углеродных атомов, в конце концов проходит через стадию масляной кислоты. После очередного β-окисления масляная кислота становится ацетоуксусной. Последняя затем гидролизуется до двух молекул уксусной кислоты. Доставка жирных кислот к месту их окисления – к митохондриям – происходит сложным путем: при участии альбумина осуществляется транспорт жирной кислоты в клетку; при участии специальных белков – транспорт в пределах цитозоля; при участии карнитина – транспорт жирной кислоты из цитозоля в митохондрии. Процесс окисления жирных кислот складывается из следующих основных этапов.
Активация жирных кислот. Свободная жирная кислота независимо от длины углеводородной цепи является метаболически инертной и не может подвергаться никаким биохимическим превращениям, в том числе окислению, пока не будет активирована. Активация жирной кислоты протекает на наружной поверхности мембраны митохондрий при участии АТФ, коэнзима A (HS-KoA) и ионов Mg2+. Реакция катализируется ферментом ацил-КоА- синтетазой:
R—COOH + HS-KoA + АТФ + R—CO—S-KoA + АМФ + РРi.
Жирная кислота Ацил-КоА-синтетаза
Транспорт жирных кислот внутрь митохондрий. Коэнзимная форма жирной кислоты, в равной мере как и свободные жирные кислоты, не обладает способностью проникать внутрь митохондрий, где, собственно, и протекает их окисление. Переносчиком активированных жирных кислотс длинной цепью через внутреннюю митохондриальную мембрану служит карнитин. Ацильная группа переносится с атома серы КоА на гидроксильную группу карнитина с образованием ацилкарнитина, который диффундирует через внутреннюю митохондриальную мембрану:
Нарушение переноса жирных кислот в митохондрии. Скорость переноса жирных кислот внутрь митохондрий, а следовательно и скорбеть процесса р-окисления, зависит от доступности карнитина и скорости работы фермента карнитинацилтрансферазы I. р-Окисление могут нарушать следующие факторы:
- длительный гемодиализ, в ходе которого организм теряет карнитин;
- длительная ацидурия, при которой карнитин выводится как основание с органическими кислотами;
- лечение больных сахарным диабетом препаратами сульфонилмочевины, ингибирующими карнитинацилтрансферазу I;
- низкая активность ферментов, синтезирующих карнитин;
Невозможность использовать жирные кислоты как источники энергии приводит к увеличению скорости окисления глюкозы. В результате у детей развивается гипогликемия - причина внезапной детской смертности (10% от общего числа умерших новорождённых). Если такие дети выживают, то после голодания в течение 6-8 ч у них развиваются гипогликемические приступы (слабость, головокружение, рвота, потеря сознания). Введение глюкозы приводит к исчезновению симптомов. Во всех случаях, когда нарушается β-окисление, жирные кислоты накапливаются в клетках и распадаются по пути ω-окисления, которое в норме идёт с очень низкой скоростью. Окисление происходит по метильному ω-атому углерода, и в результате образуются дикарбоновые кислоты, выделяющиеся с мочой. Определение этих кислот в моче может служить диагностическим признаком нарушения β-окисления.
64-65. Биосинтез и окисление глицерина в тканях, их этапы. Энергетика окисления глицерина. Взаимосвязь глицерина с углеводным обменом. Синтез жирных кислот, этапы этого процесса. Строение и функция синтетазы жирных кислот. Взаимосвязь синтеза жирных кислот с обменом углеводов и аминокислот. Образование ненасыщенных жирных кислот. Незаменимые жирных кислоты, их роль в метаболизм
Окисление жирных кислот и глицерина. Катаболизм липидов. В организме человека (70 кг) находится около 12-15 кг жира. Этот запас ТАГ обеспечивает поддержание основного обмена в течении нескольких недель. Жировая ткань очень метаболически активна и реагирует на изменения в обмене веществ. Особенно тесно связана с печенью, сердечной и скелетными мышцами (50% энергии получают при окислении липидов), т.к. в молекуле ТАГ основная доля – высшие жирные кислоты. Окисление происходит в матриксе митохондрий. Сначала жирная кислота активируется: 1.В цитоплазме каждой кислота активируется с использованием КоА-SH и энергии АТФ. 2.Активная жирная кислота- ацил-КоА – из цитозоля транспортируется в матрикс митохондрий (МХ). КоА-SH остается в цитозоле, а остаток жирной кислоты - ацил- соединяется с карнитином - карнитин выделен из мышечной ткани) с образованием ацил-карнитина, который поступает в межмембранное пространство МХ. Их межмембранного пространства митохондрий комплекс ацил-карнитин переносится в матрикс МХ. При этом карнитин остается в межмембранном пространстве. В матриксе ацил соединяется с КоА-SH.
Окисление. В матриксе МХ образуется активная жирная кислота, которая в дальнейшем подвергается реакциям окисления до конечных продуктов. При бета- окислении окисляется группа-СН2- в бета- положении жирной кислоты до группы-С-. При этом на двух стадиях происходит дегидрирование: при участии ацилдегидрогеназы (флавиновый фермент, водород переносится на убихинон) и бета-оксиацилдегидрогеназа (акцептор водорода НАД+). Затем бета кетоацил-КоА при действии фермента тиолазы, распадается на ацетил КоА и ацил-КоА, укороченный на 2 углеродных атома по сравнению с исходным. Этот ацил-КоА вновь подвергается бета-окислению. Многократное повторение этого процесса приводит к полному распаду жирной кислоты до ацил-КоА.
Окисление жирных кислот. Включает 2 этапа: 1.последовательное отщепление от С-конца эжкислоты двухуглеродного фрагмента в виде ацетил-КоА; 2.окисление ацетил-КоА в цикле Кребса до СО2 и Н2О. Энергетическая ценность окисления жирных кислот. Стеариновая кислота(С18) проходит 8 циклов окисления с образованием 9 ацетил-КоА.В каждом цикле окисления образуется 8*5 АТФ=40 АТФ, ацетил-КоА дает 9*12 АТФ=108 АТФ. Итого:148 АТФ, но 1 АТФ расходуется на активацию жирной кислоты в цитозоле, поэтому итог 147 АТФ. Особенности окисления ненасыщенных жирных кислот. Окисление ненасыщенных жирных кислот происходит также по двойной связи. В случае, когда двойная связь имеет цис-конфигурацию, действует специальный фермент цис-транс-изомераза, который переводит двойную связь в транс-форму. Транс-еноил-КоА подвергается окислению как описано выше. Особенности окисления жирных кислот с нечетным количеством углеродных атомов. В этом случае образуется 3-х углеродный продукт пропионил-КоА. Таким образом, окисление высших жирных кислот - очень важный источник большого количества энергии для клетки, но жирные кислоты становятся альтернативным энергетическим
топливом, а на первом месте – глюкоза,т.к. их окисление зависит от окисления глюкозы (1. для
активации жирной кислоты требуется АТФ, которая образуется в цитозоле в ходе гликолиза; 2.
для реакции ЦТК требуется ЩУК, которая образуется из глюкозы). Глицерин – продукт метаболизма жировой ткани, глицерин не используется адипоцитами. Глицерин утилизируют ткани, содержащие фермент глицеролкиназу (печень, почки, слизистая кишечника, молочная железа). Глицерол-3-фосфат в клетках этих органов может использоваться по трем направлениям: 1. окисление до конечных продуктов; 2. глюконеогенез; 3. синтез жиров и фосфолипидов.
66. Биосинтез жиров в организме: ресинтез жира в эндотелии кишечника, синтез жиров в печени и подкожно-жировой клетчатке. Транспорт жиров липопротеинами крови. Резервирование жиров. Физиологическое значение жиров для организма человека. Нарушение процесса синтеза жиров: ожирение, жировое перерождение печени.
Жировой обмен — совокупность процессов переваривания и всасывания нейтральных жиров (триглицеридов) и продуктов их распада в желудочно-кишечном тракте, промежуточного обмена жиров и жирных кислот и выведение жиров, а также продуктов их обмена из организма. Понятия «жировой обмен» и «липидный обмен» часто используются как синонимы, т.к. входящие в состав тканей животных и растений входят нейтральные жиры и жироподобные соединения, объединяются под общим названием липиды. Нарушения Ж. о. служат причиной или являются следствием многих патологических состояний. В организм взрослого человека с пищей ежесуточно поступает в среднем 70 г жиров животного и растительного происхождения. В ротовой полости жиры не подвергаются никаким изменениям, т.к. слюна не содержит расщепляющих жиры ферментов. Частичное расщепление жиров на глицерин или моно-, диглицериды и жирные кислоты начинается в желудке. Однако оно протекает с небольшой скоростью, поскольку в желудочном соке взрослого человека и млекопитающих активность фермента липазы, катализирующего гидролитическое расщепление жиров, крайне невысока, а величина рН желудочного сока далека от оптимальной для действия этого фермента (оптимальное значение рН для желудочной липазы находится в пределах 5,5—7,5 единиц рН). Кроме того, в желудке отсутствуют условия для эмульгирования жиров, а липаза может активно гидролизовать только жир, находящийся в форме жировой эмульсии. Поэтому у взрослых людей жиры, составляющие основную массу пищевого жира, в желудке особых изменений не претерпевают. Однако в целом желудочное пищеварение значительно облегчает последующее переваривание жира в кишечнике. В желудке происходит частичное разрушение липопротеиновых комплексов мембран клеток пищи, что делает жиры более доступными для последующего воздействия на них липазы панкреатического сока. Кроме того, даже незначительное по объему расщепление жиров в желудке приводит к появлению свободных жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и там способствуют эмульгированию жира. Наиболее сильным эмульгирующим действием обладают желчные кислоты, попадающие в двенадцатиперстную кишку с желчью. В двенадцатиперстную кишку вместе с пищевой массой заносится некоторое количество желудочного сока, содержащего соляную кислоту, которая в двенадцатиперстной кишке нейтрализуется в основном бикарбонатами, содержащимися в панкреатическом и кишечном соке и желчи. Образующиеся при реакции бикарбонатов с соляной кислотой пузырьки углекислого газа разрыхляют пищевую кашицу и способствуют более полному перемешиванию ее с пищеварительными соками. Одновременно начинается эмульгирование жира. Соли желчных кислот адсорбируются в присутствии небольших количеств свободных жирных кислот и моноглицеридов на поверхности капелек жира в виде тончайшей пленки, препятствующей слиянию этих капелек.
Нарушения жирового обмена. Одной из причин недостаточного всасывания жиров в тонкой кишке может быть их неполное расщепление вследствие либо пониженной секреции сока поджелудочной железы (недостаток панкреатической липазы), либо вследствие пониженного выделения желчи (недостаток желчных кислот, необходимых для эмульгирования жира и образования жировых мицелл). Другой, наиболее частой причиной недостаточного всасывания жира в кишечнике является нарушение функции кишечного эпителия, наблюдаемое при энтеритах, гиповитаминозах, гипокортицизме и некоторых других патологических состояниях. В этом случае моноглицериды и жирные кислоты не могут нормально всасываться в кишечнике из-за повреждения его эпителия. Нарушение всасывания жиров наблюдается также при панкреатитах, механической желтухе, после субтотальной резекции тонкой кишки, а также ваготомии, приводящей к понижению тонуса желчного пузыря и замедленному поступлению желчи в кишечник.Нарушение всасывания жира в тонкой кишке приводит к появлению большого количества жира и жирных кислот в кале — стеаторее. При длительном нарушении всасывания жира организм получает также недостаточное количество жирорастворимых витаминов. Особенности жирового обмена у детей. Гидролитическое расщепление жиров в желудке играет важную роль в процессе пищеварения у детей, особенно у детей грудного возраста, умеренная кислотность желудочного сока у которых (рН около 5,0) способствует перевариванию эмульгированного жира грудного молока желудочной липазой. Кроме того, при длительном употреблении молока в качестве основного продукта питания у детей грудного возраста возможно адаптивное усиление синтеза желудочной липазы. Слизистая оболочка верхней части пищевода грудного ребенка секретирует свою собственную липазу в ответ на сосательные движения при кормлении ребенка грудью (возможно, что именно эта липаза и проявляет свое действие в желудке детей грудного возраста). У новорожденных желудочная липаза расщепляет только те жиры, в состав молекулы которых входят жирные кислоты с короткой углеродной цепью. Вследствие относительной незрелости внешнесекреторной функции печени и низкой активности панкреатической липазы у детей (особенно у новорожденных и у детей первых 3-х лет жизни) усвоение жира (в основном триглицеридов, содержащих жирные кислоты с длинной углеродной цепью) ниже, чем у взрослых. У доношенных новорожденных усваивается около 85—90% поступающего в организм жира, у недоношенных — 60—79%. У новорожденных вследствие низкого коэффициента усвоения жира нередко отмечается стеаторея. Выделение липидов с калом у 3-месячного ребенка составляет 3 г, а в последующем уменьшается до 1 г в сутки.
67. Обмен глицерофосфолипидов. Переваривание фосфолипидов в желудочно-кишечном тракте. Внутриклеточный гидролиз фосфолипидов. Ферменты этих процессов. Биосинтез глицерофосфолипидов. Этапы этого процесса. Транспорт фосфолипидов липопротеинами крови. Регуляция обмена фосфолипидов: липотропные факторы. Значение фосфолипидов для организма человека.
Обмен глицерофосфолипидов. Начальные этапы синтеза глицерофосфолипидов и жиров происходят одинаково до образования фосфатидной кислоты. Фосфатидная кислота может синтезироваться двумя разными путями: через глицеральдегид-3-фосфат и через дигидроксиацетонфосфат. На следующем этапе фосфатидаза отщепляет от фосфатидной кислоты фосфатный остаток, в результате чего образуется диацилглицерол. Дальнейшие превращения диацилглицерола также могут идти разными путями. Один из вариантов - образование активной формы "полярной головки" фосфолипида: холин, серии или этаноламин превращаются в ЦДФ-холин, ЦДФ-серин или ЦДФ-этаноламин. Далее диацилглицерол взаимодействует с ЦМФ-производными, при этом выделяется ЦМФ, и образуется соответствующий фосфолигщц, например фосфатидилхолин. Между глицерофосфолипидами возможны различные взаимопревращения. Фосфатидилхолин может образовываться и другим путём: из фосфатидилэтаноламина, получая последовательно 3 метальные группы от SAM. Фосфатидилсерин может превращаться в фосфа-тидилэтаноламин путём декарбоксилирования. Фосфатидилэтаноламин может превращаться в фосфатидилсерин путём обмена этаноламина на серии. Катаболизм глицерофосфолипидов. Различные типы фосфолипаз, локализованных в клеточных мембранах или в лизосомах, катализируют гидролиз глицерофосфолипидов. Гидролиз некоторых глицерофосфолипидов под действием фосфолипаз имеет значение не только как путь катаболизма, но и как путь образования вторичных посредников или предшественников в синтезе биологически активных веществ - эйкозаноидов. Кроме того, фосфолипазы А1 и А2 участвуют в изменении состава жирных кислот в глицерофосфолипидах, например при синтезе в эмбриональном периоде развития дипальмитоилфосфатидилхолина - компонента сурфактанта.
68. Обмен ацетоуксусной кислоты в организме. Синтез ацетоуксусной кислоты и использование ее в тканях. Образование кетоновых тел. Нарушение этого процесса при патологии: сахарном диабете, кахексии, острой гипоксии. Биохимические механизмы развития диабетической комы.
В печени часть жирных кислот превращается в так называемые кетоновые тела – ацетоуксусную и β-гидроксимасляную кислоты. Эти вещества затем поступают в кровь и используются как источники энергии в других органах и тканях. Непосредственным предшественником кетоновых тел служит ацетил-КоА, который может образоваться как из жирных кислот так из углеводов. Однако для синтеза кетоновых тел используется преимущественно ацетил-КоА, образующийся из жирных кислот. Это происходит в результате действия специальных регуляторных механизмов. Содержание кетоновых тел в крови увеличивается в таких состояниях когда основным источником энергии для организма служат жирные кислоты –при длительной мышечной работе, при голодании, при некоторых болезнях. Через двое суток голодания концентрация кетоновых тел в крови достигает 5-8мг/дл через неделю 40-50мг/дл. При сахарном диабете концентрация кетоновых тел может повышаться до 300-400мг/дл, что приводит к метаболическому ацидозу. Кетонемия и кетонурия. Вследствие недостаточности инсулина уменьшается отношение инсулина/глюкагон, т.е. имеется относительное избыточность глюкагона. Однако скорость синтеза кетоновых тел может превышать даже увеличенное в этих условиях их потребление тканями (концентрация кетоновых тел в крови в норме меньше 2мг/дл, при голодании до 30 мг/дл). При диабете кетонемия часто бывает 100 мг/дл, а может достигать и 350 мг/дл. При такой кетонемии возникает и кетонурия - с мочой выделяется до 5г кетовых тел в сутки. В тканях происходит декарбоксилирование ацетоуксусной кислоты: от больных исходит запах ацетона, который ощущается даже на расстоянии). Кетовые теля, являясь кислотами, снижают буферную емкость крови, а при высоких концентрациях снижают и рН крови - возникает ацидоз. В норме рН крови равна 7,4+0,04. При содержании кетовых тел 100мг/дл и больше рН крови может быть близко к 7,0. Ацидоз такой степени резко нарушает функции мозга, вплоть до потери сознания.
69. Холестерин, его химическое строение, роль в организме, экзогенный и эндогенный холестерин. Биосинтез холестерина, основные этапы этого процесса. Метаболизм холестерина, его транспорт, пути выведения. Понятие о гиперхолестеринемии. Биохимические основы формирования камней желчного пузыря.
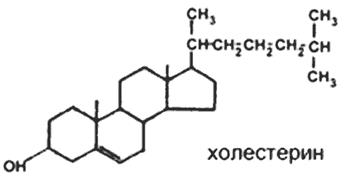
Синтез холестерина. Многоэтапный процесс синтеза холестерина (ХЛ) подразделяется на 3 стадии: 1. Образование мевалоновой кислоты из ацетил-КоА, 2. Образование «активного изопрена» и реакции конденсации с образованием сквалена, 3. Реакции циклизации сквалена с образованием стеранового скелета. Начальные реакции синтеза ХЛ сходны с начальными реакциями синтеза кетоновых тел (до образования ОМГ-КоА). Отличием является локализации процессов: синтез кетоновых тел происходит в МХ, а синтез ХЛ-ЦЗ. 1) 2 ацетил-КоА → ацетил-КоА → ОМГ-КоА тиолаза ОМГ-синтаза 2) ОМГ-редуктаза – регуляторный фермент, лимитирующий скорость биосинтеза ХЛ в целом. Её активность подавляется избытком пищевого холестерина.
І стадия. Активация мевалоновой кислоты.
ІІ стадия. Мевалонат---сквален. Через образование различных эфиров с Р-кислотой(5-фосфорный эфир,5-пирофосфорный эфир). Декарбоксилирование и дефосфорилирование активной мевалоновой кислоты (фермент декарбоксилаза и фосфорилаза). Активный изопрен (изопентинилпирофосфат и димитилаллилпирофосфат) является предшественником не только ХЛ. В клетках растений и бактерий из него образуются каротиноиды, убихинон, хлорофилл, каучук. Оба изомерных изопентилпирофосфата конденсируются с высвобождением пирофосфата и образованием геранилпирофосфата С10. К геранилпирофосфату вновь присоединяется изопентил пирофосфат, образуя в результате этой реакции фарнезилпирофосфат С15 В заключительной реакции данной стадии в результате НАДФН2- зависимой восстановительной конденсации 2 молекул фарнезилпирофосфата образуется сквален С30
ІІІ стадия. Реакции конденсации изопрена: Сквален (С30) → ланостерин → холестерин. Реакции конденсации и циклизации углеродного скелета требуют большого количества энергии в форме АТФ. Гидроксилирование стеранового кольца предшественника ХЛ протекает с участием монооксигеназной цепи мембран ЭПС. Эфиры ХЛ образуются путем переноса активной жирной кислоты на гидроксильную группу ХЛ. Перенос осуществляют ферменты либо холестерол-ацил- трансфераза(ХАТ) либо лецитин-ХАТ (ЛХАТ). а сутки у здорового человека синтезируется около 2 г ХЛ (с пищей поступает 0,4-0,5 г экзогенного ХЛ). Транспорт ХЛ от печени и кишечника к органам. ХЛ синтезируется в печени как для собственных нужд, так и на «экспорт». Вновь образованный ХЛ и его эфиры включаются вместе с ТАГ в ЛПОНП и поступают в плазму крови. После освобождения ЛПОНП от ТАГ, происходящего на поверхности адипоцитов, из них образуется ЛПНП с высоким содержанием в них ХЛ. На поверхности клеток внутренних органов ЛПНП соединяются с специфическими рецепторами и поглощаются этими клетками. В лизосомах клеток происходит гидролитический распад ЛП. Освободившиеся ХЛ встраивается в клеточные мембраны. Изменение соотношения в плазме фракций ЛП- одна из причин нарушения обмена ХЛ. Пищевой (экзогенный) ХЛ транспортируется ХМ от кишечного эпителия к печени. Избыток ХЛ с желчью выводится в кишечник, где восстанавливается ферментами микрофлоры до копростерина и вместе с небольшим количеством не измененного ХЛ выделяется с калом. Выведению избытка ХЛ из кишечника в значительной мере способствует клетчатка, содержащаяся в пище.
Желчнокаменная болезнь. У здорового человека ХЛ в желчи находится в определенном соотношении с ФЛ и желчными кислотами, образую с ними растворимые мицеллы. При увеличении концентрации ХЛ в составе мицелл или снижении содержания желчных кислот и ФЛ, ХЛ выпадает в осадок кристаллизируется и формирует холестериновые камни. Этому способствует застой желчи.
70. Биохимические основы развития атеросклероза. Основные фактоыр риска, гипохолестериноз, нарушение обмена липопротеинов, состояние сосудистой стенки. Добавочные факторы – повышение уровня триацилглицеринов, ожирение, физическая активность. Генетическая предрасположенность – одна из предпосылок развития гиперхолестеринемии. Нормализация гиперхолестеринемии – одно из основных условий лечения атеросклероза
Факторы риска развития атеросклероза. Основное биохимическое проявление АС – отложение ХЛ в стенках артерий. Болезнь является результатом нарушения любого звена сложной метаболической системы, включающей:
1. синтез ХЛ
2. транспорт и выведение ХЛ
3. рецепция ЛПНП клетками тканей, в т.ч. сосудистой стенки
4. состояние клеточных мембран эндотелия сосудов
5. соотношение ЛПНП и ЛПВП в плазме.
Следствием нарушения путей системы является гиперхолестеринемия, преобладание в плазме ЛПНП, которые на фоне поврежденного эпителия сосудов сопровождается увеличением его проницаемости для ХЛ и накопление последнего в сосудистой стенке. Это приводит к нарушению клеток, выведение ХЛ в межклеточное пространство, разрастанию и кальцификации соединительной ткани и образованием атеросклеротических бляшек. ЛПНП (бета-ЛП), вводящие ХЛ в клетки, вызываются атерогенными. ЛПВП (альфа-ЛП) удаляют ХЛ из тканей и поэтому являются антиатерогенными. Вероятность развития атеросклероза прогнозируется «индексом атерогенности», который представляет собой отношение ХЛ в ЛПНП к ХЛ в составе ЛПВП.
У взрослых людей до 30 лет индекс 2-2,8; у лиц старше 30 лет 3-3,5. При АС индекс 4-6 и выше. Факторы риска развития АС:
1. Гиподинамия. Следствием её является накопление АТФ, ослабление реакции биологического окисления, торможение реакций ЦТК, усиление свободнорадикального окисления мембранных липидов, гиперхолестеринемия.
2. Гипоксия, следствием которой является ослабление реакций биологического окисления и ЦТК, накопление ацетил-КоА, гиперхолестеринемия.
3. Избыточное УВ питание, способствующие интенсивному синтезу ТАГ и ХЛ.
4. Стресс, следствием которого является мобилизация гликогена, усиленный синтез ТАГ и ХЛ
5. Избыток жиров в рационе.
71. Повышенная концентрация фосфолипидов в крови и тканях в раннем возрасте. Роль фосфатидилхолина и сфингомиелина. Врожденная патология обмена фосфолипидов (болезнь Гоше).
Фосфатидилхолины ― группа фосфолипидов, содержащих холин. Также входят в группу лецитинов. Фосфатидилхолины одни из самых распространенных молекул клеточных мембран. Сфингомиелин — это тип сфинголипида, который находится в клеточной мембране животных. Сфингомиелин локализуется на внешнем слое липидного бислоя клеточной мембраны и может. Структура и функции. Лецитины, как и простые жиры, содержат структурные остатки глицерина и жирных кислот, но в их состав ещё входят фосфорная кислота и холин. Лецитины широко представлены в клетках различных тканей, они выполняют как метаболические, так и структурные функции в мембранах. Болезнь Гоше (глюкозилцерамидный липид) - это самая распространенная из озлизосомных болезней накопления, которая развивается в результате недостаточности фермента глюкоцереброзидазы, что приводит к накоплению глюкоцереброзида во многих тканях, включая селезенку, печень, почки, легкие, мозг и костный мозг. Симптомы болезни Гоше:
· Увеличение печени и значительное увеличение селезенки, что может стать причиной болей в животе, преждевременного ложного насыщения и общего дискомфорта
· Изменения в селезенке могут привести к анемии и проявлениям усталости, слабости, бледности кожных покровов.
72. Повышенная активность биосинтеза и распада нейтральных жиров в тканях ребенка. Бурый жир, его значение.
Бурые жировые клетки участвуют в образовании бурой жировой ткани. Эти клетки имеют полигональную форму и содержат небольшие капельки жира, рассеянные по цитоплазме. Ядро клетки расположено эксцентрично. Клетка буквально напичкана митохондриями, из-за них жировая ткань приобретает бурый цвет. Этот жир участвует в теплопродукции, а новорождённым помогает адаптироваться к новым условиям жизни уже без связи с материнским организмом. Бурый жир участвует в теплопродукции, во-первых, благодаря большому количеству митохондрий, а, во-вторых, присутствию в них особого белка термогенина. Этот белок разобщает окислительное фосфорилирование и дыхательную цепь: ток протонов через белки мембраны обеспечивает не синтез АТФ, как это происходит в других тканях, а выделение тепла. Недавние исследования показали, что физические упражнения влекут за собой выделение неизвестного ранее гормона ирисина, который заставляет белый жир становиться бурым и препятствует ожирению.
73. Неустойчивость липидного обмена, связанная с недостаточно сформированной нейроэндокринной регуляцией. Кетонемия и ацетонемия у детей. Факторы, способствующие их развитию.
Целый ряд заболеваний обусловлен нарушением липидного обмена. Важнейшими среди них следует назвать атеросклероз и ожирение. Одно из самых распространенных проявлений атеросклероза - поражение коронарных сосудов сердца. Аккумуляция холестерина в стенках сосудов приводит к образованию атеросклеротических бляшек. Они, увеличиваясь со временем в размере, могут перекрывать просвет сосуда и препятствовать нормальному кровотоку. Если вследствие этого кровоток нарушается в коронарных артериях, то возникает стенокардия или инфаркт миокарда. Предрасположенность к атеросклерозу зависит от концентрации транспортных форм липидов крови альфа-липопротеинов плазмы. Факторы, влияющие на повышенный уровень ЛПНП у человека:
- Пол - у мужчин выше, чем у женщин в пременопаузе, и ниже, чем у женщин в постменопаузе
- Старение
- Насыщенные жиры в диете
- Высокое потребление холестерина
- Диета с низким содержанием грубых волокнистых продуктов.
Нарушения липидного обмена (дислипидемии), характеризующиеся в первую очередь повышенным содержанием в крови холестерина и триглицеридов, являются важнейшими факторами риска атеросклероза и связанных с ним заболеваний сердечно-сосудистой системы. Первичное нарушение липидного обмена детерминировано единичными или множественными мутациями соответствующих генов, в результате которых наблюдается гиперпродукция или нарушение утилизации триглицеридов и холестерина ЛПНП или гиперпродукция и нарушения клиренса ЛПВП. Другими причинами вторичного нарушения липидного обмена могут быть:
1. Сахарный диабет.
2. Злоупотребление алкоголя.
3. Хроническая почечная недостаточность.
4. Гипертиреоидизм.
5. Первичный билиарный цирроз.
6. Прием некоторых препаратов (бета-блокаторы, антиретровирусные препараты, эстрогены, прогестины, глюкокортикоиды).
Кетонемия - повышенное содержание в крови кетоновых тел. Возникает такое состояние при тяжёлой форме сахарного диабета или голодании. При голодании в крови падает концентрация глюкозы, а при диабете глюкоза не поступает в клетку с необходимой скоростью. В результате начинается усиленный липолиз для высвобождения необходимой энергии. Мобилизованные жировые кислоты направляются из жировых депо в печень, где и образуются кетоновые тела. Выявить кетонемию можно по результатам анализов мочи и крови. Ацетонемия — содержание в крови ацетоновых (кетоновых) тел: ацетоуксусной, оксимасляной кислот, ацетона. Ацетоновые тела образуются преимущественно в печени из жирных кислот. В физиологических условиях скорость образования кетоновых тел соответствует их распаду, в норме их содержание в крови составляет 0,7—0,8 мг %.
74. Мобилизация жиров в жировой ткани, ферменты этого процесса. Гормональная регуляция: роль инсулина, глюкагона, адреналина. Значение внутриклеточного липолиза, нарушение его при ожирении.
Адипоциты (место депонирования жиров) располагаются в основном под кожей, образуя подкожный жировой слой, и в брюшной полости, образуя большой и.малый сальники. Мобилизация жиров, т.е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный период, при голодании и активной физической работе. Гидролиз внутриклеточного жира осуществляется под действием фермента гормончувствительной липазы - ТАГ-липазы. Этот фермент отщепляет одну жирную кислоту у первого углеродного атома глицерола с образованием диацилглицерола, а затем другие липазы гидролизуют его до глицерола и жирных кислот, которые поступают в кровь. Глицерол как водорастворимое вещество транспортируется кровью в свободном виде, а жирные кислоты (гидрофобные молекулы) в комплексе с белком плазмы - альбумином.
 2015-04-30
2015-04-30 5510
5510








