Этап I – инициация биосинтеза ДНК – является началом синтеза дочерних нуклеотидных цепей; в инициации участвует минимум восемь хорошо изученных и разных ферментов и белков. Первая фаза – это ферментативный биосинтез на матрице ДНК необычного затравочного олигорибонуклеотида (праймера) со свободной гидроксильной группой у С-3' рибозы. При инициации к цепям ДНК последовательно присоединяются ДНК-раскручивающие и ДНК-связывающие белки, а затем комплексы ДНК-полимераз и праймаз.
Этап II – элонгация синтеза ДНК – включает два кажущихся одинаковыми, но резко различающихся по механизму синтеза лидирующей и отстающей цепей на обеих материнских цепях ДНК. Синтез лидирующей цепи начинается с синтеза праймера (при участии праймазы) у точки начала репликации, затем к праймеру присоединяются дезоксирибонуклеотиды под действием ДНК-полимеразы III; далее синтез протекает непрерывно, следуя шагу репликационной вилки. Синтез отстающей цепи, напротив, протекает в направлении, обратном движению репликационной вилки и начинается фрагментарно.
Этап III – терминация синтеза ДНК – наступает, скорее всего, когда исчерпана ДНК-матрица и трансферазные реакции прекращаются. Точность репликации ДНК чрезвычайно высока, возможна одна ошибка на 1010 трансферазных реакций, однако подобная ошибка обычно легко исправляется за счет процессов репарации.
93. Биосинтез РНК (транскрипция): РНК-полимераза, стехиометрия реакции, ДНК как матрица. Регуляция транскрипции. Посттранскрипционная достройка РНК. Молекулярные мутации. Наследственные болезни.
Субстратами реакции служат трифосфаты рибонуклеозидов. Реакция идет только в присутствии ДНК, выполняющей роль матрицы. Матрицей служит одна из цепей ДНК, называемая матричной (а также кодирующей, значащей) цепью. Все синтезированные молекулы РНК имеют структуру, комплементарную матрице, т. е. одной из цепей ДНК. Поскольку РНК представляет собой одноцепочечную молекулу (спирализованные участки составляют лишь часть молекулы), стехиомет-рические коэффициенты для всех четырех субстратов различны. Транскрипцию катализируют РНК-полимеразы I, II и III. Первый из этих ферментов участвует в синтезе рибосомных РНК, второй — матричных и третий — транспортных РНК. В процессе транскрипции различают стадии инициации, элонгации и терминации. В результате транскрипции образуются предшественники тРНК, рРНК и мРНК — первичные транскрипты. Затем в ядре и в цитоплазме происходит посттранскрипционная доработка (созревание) этих предшественников, и получаются функционально активные рибонуклеиновые кислоты. Промотор содержит последовательность, обогащенную нуклеотидами Т и А (ТАТА-последовательность), узнаваемую белком ТАТА-фактором. РНК-полимера-за присоединяется к промотору, если ТАТА-последовательность связана с ТАТА-фактором. Матрицей для синтеза РНК служит одна из цепей ДНК; промотор с ТАТА-фактором обеспечивают узнавание РНК-полимеразой транскрибируемой цепи ДНК и первого нуклеотида транскрибируемого гена. Связывание РНК-поли-меразы с промотором и вызванные этим конформационные изменения повышают сродство РНК-полимеразы к факторам инициации. Присоединение этих факторов приводит к локальному расхождению нуклеотидных цепей ДНК; расхождение включает около 10 нуклеотидных пар, т. е. примерно один виток спирали.
Элонгация. Наращивание молекулы РНК происходит путем присоединения очередного рибонуклеотида, комплементарного тому дезоксирибонуклеотиду ДНК, который в данный момент находится в области активного центра РНК-полимеразы. В активном центре фермента находится З'-конец растущей цепи РНК, и к нему присоединяется очередной нуклеотид.
94. Биосинтез белков (трансляция). Стадии биосинтеза белка на рибосоме. Универсальность биологического кода и механизма биосинтеза белков. Посттрансляционные изменения белков. Антибиотики-ингибиторы синтеза белков.
Трансляция — процесс синтеза белка из аминокислот на матрице информационной (матричной) РНК (иРНК, мРНК), осуществляемый рибосомой.
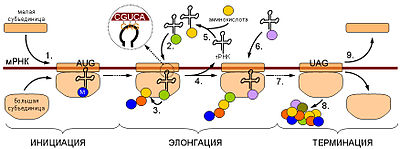 Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК. Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин). Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих. Процесс трансляции разделяют на
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК. Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон CCA, а к этой тРНК будет присоединяться только аминокислота глицин). Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих. Процесс трансляции разделяют на
· инициацию — узнавание рибосомой стартового кодона и начало синтеза.
· элонгацию — собственно синтез белка.
· терминацию — узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
95. Гем, основные этапы биосинтеза. Возможные нарушения обмена порфинов, приводящие к ослаблению синтеза гема. Гемоглобин, его структура. Гетерогенность гемоглобинов (3 типа гемоглобинов у человека). Свойства гемоглобина: кооперативное взаимодействие субъединиц. Виды гемоглобина (P, F, A). Формы гемоглобина: оксигемоглобин, карбгемоглобин, метгемоглобин, карбоксигемоглобин. Функции гемоглобина. Влияние 2,3-дифосфоглицерата эритроцита на процесс оксигенации. Патологии гемоглобина – гемоглобинозы.
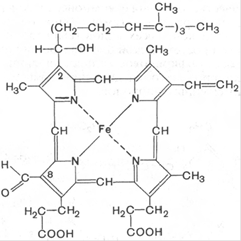 Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма. Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА, промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-
Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков и различных коферментов оксидоредуктаз. Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма. Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА, промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5- 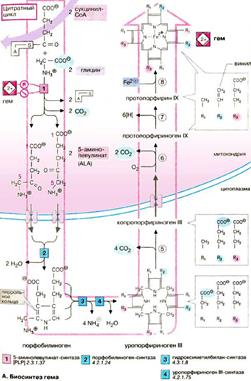 аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо. Порфобилиноген-синтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината. На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп. Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные. Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов. В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно. Гемоглобин — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У человека содержится в эритроцитах. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови. Виды гемоглобина:
аминолевулинат-синтаза (ALA-синтаза) является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи. После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо. Порфобилиноген-синтаза ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината. На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I. Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп. Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные. Модификация боковых цепей заканчивается образованием протопорфириногена IX. На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов. В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа. Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин, где он связан нековалентно, или в цитохром С, с которым связывается ковалентно. Гемоглобин — сложный железосодержащий белок кровосодержащих животных, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. У человека содержится в эритроцитах. Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130—170 г/л (нижний предел — 120, верхний предел — 180 г/л), у женщин 120—150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1—3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145—225 г/л, а к 3—6 месяцам снижается до минимального уровня 95—135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови. Виды гемоглобина:
· Гемоглобин A, или ΗbA — нормальный гемоглобин взрослого человека.
· Гемоглобин С (Hemoglobin C), или ΗbC — один из мутантных гемоглобинов
· Гемоглобин E (HbE, эмбриональный гемоглобин) — эмбриональный тип гемоглобина человека.
· Гемоглобин S (HbS) — это особая мутантная форма гемоглобина, образующаяся у больных с серповидно-клеточной анемией и склонная к кристаллизации вместо образования нормальной четвертичной структуры и растворения в цитоплазме эритроцита.
· Гемоглобин F (HbF) — фетальный, плодный тип гемоглобина человека.
96. Распад гема. Билирубин как продукт распада гема. Метаболизм билирубина. Нарушение его обмена. Желтухи и их биологическая диагностика.
Продолжительность жизни эритроцитов составляет 120 дней, затем они разрушаются (состарившиеся эритроциты фагоцитируются макрофагами, главным образом в селезенке, а также в печени и костном мозге; в микросомальной фракции ретикуло-эндотелиальной системы клеток) и освобождается гемоглобин. В организме человека в течение 1 ч разрушается примерно 100-200 млн эритроцитов. Гем повторно не используется: он распадается с образованием железа и желчных пигментов; железо реутилизируется, а желчные пигменты выводятся из организма. Распад гемоглобина в печени начинается с разрыва a-метиновой связи между I и II кольцами порфиринового кольца, т.е окисляется один из метеновых мостиков тетрапиррольной структуры гемма, углерод метеновой группы превращается в оксид углерода СО. Этот процесс катализируется НАДФ-содержащей оксидазой ЭПР (гем-оксигеназой) с помощью кислорода и НАДФН и приводит к образованию зеленого пигмента вердоглобина (холеглобина). Интенсивный цвет гема и других порфиринов является результатом сопряжения многочисленных двойных связей, которые образуют две резонансно стабилизированные (мезомерные) системы. Основное место образования билирубина − печень, селезенка и, по-видимому, эритроциты (при распаде их иногда разрывается одна из метановых связей в протопорфирине). Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе с желчью попадает в желчный пузырь. Билирубин, образовавшийся в клетках системы макрофагов, называется свободным, или непрямым, билирубином, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови и для его определения в крови необходимо предварительное осаждение белков спиртом и только после этого билирубин вступает во взаимодействие с диазореактивом. Так как билирубин нерастворим в воде, плохо растворим в плазме, его транспорт в крови осуществляется в комплексе с альбумином. Повышенный уровень билирубина (>10 мг/л) называется гипербилирубинемией. Билирубин диффундирует из крови в периферические ткани и окрашивает их в желтый цвет. Это особенно легко заметить на белой конъюктиве глаза, в таком случае говорят о желтухе.
97. Физиологическая желтуха новорожденных, ее причины.
Физиологическая желтуха новорождённых — не болезнь, а состояние в периоде адаптации, связанное с заменой фетального гемоглобина(HbF) на гемоглобин А (HbA), незрелостью ферментных систем и приспособлением детского организма к новым условиям окружающей среды. У взрослого человека эритроциты постоянно обновляются, стареющие клетки метаболизируются с образованием билирубина, который выводится печенью. У младенца печень ещё не функционирует в полной мере, поэтому образовавшийся в ходе замены фетального гемоглобина билирубин, придаёт коже и слизистым оболочкам желтоватый оттенок, начиная с третьих суток жизни. По мере того как ферментные системы организма начнут работу в полном объёме, цвет кожи малыша становится бледно-розовым. Наиболее выраженный жёлтый цвет кожа приобретает примерно на 3-4 день, поэтому, если мама и малыш находятся дома, паниковать не стоит, но понаблюдать за течением процесса необходимо. Полностью желтуха у новорожденных исчезает к 7-8 дню жизни. Если цвет кожи не пришёл в норму, необходимо обратиться к врачу, чтобы избежать возможных осложнений и выяснить причину такой патологии.
98. Обмен гемоглобина у детей. Типы и виды гемоглобина. Его возрастная эволюция. Возрастные особенности 2,3-ДФГ эритроцита. Гемоглобинопатии.
Пониженный уровень гемоглобина у детей встречается довольно таки часто. Именно поэтому врачи рекомендуют регулярно проводить общий анализ крови у детей от 7 месяцев до 4-5 лет. Это необходимо делать потому, что низкий уровень гемоглобина в раннем возрасте может привести к неправильному развитию ребенка в психологических и интеллектуальных направлениях. Именно по этой причине важно не только устранять низкий уровень гемоглобина, но также и предотвращать его. Для того, что бы уровень гемоглобина у Вашего ребенка всегда был в норме, необходимо включить в рацион его питания продукты, которые в нужном количестве содержат такие вещества как: медь, марганец и железо. Особенно внимание стоит уделить продуктам содержащим железо, так как именно железо является основным компонентом гемоглобина, обеспечивающим его образование, а также химическое превращение. Марганец и медь также очень важны, так как они непосредственно влияют на баланс и обмен железа. При недостатки этих элементов будет развиваться дефицит железа, который повлечет за собой все вытекающие отсюда последствия. Также одной из причин появления у детей пониженной нормы гемоглобина является тот факт, что ребенок, находясь ещё в утробе, не получает от матери нужного количества необходимых микроэлементов, так как в период беременность у самых матерей нередко встречается низкий уровень гемоглобина. По этому женщинам в период беременности для профилактики тоже нужно употреблять железосодержащую пищу или специальные препараты. Нормальный уровень гемоглобина у новорожденных детей довольно высокий – от 140 до 225г\л. Со временем уровень понижается и в 1-2 месяц это показатель располагается на отметке 95-140г\л. Потом, через некоторое время, когда организм ребенка стает более активным и уже сам синтезирует необходимое количество гемоглобина, норма эго содержания в крови опять повышается и составляет 100-140г\л. Норма гемоглобина у детей до двух лет находится на отметке 100-145г\л. И все последующее года уровень только повышается, к 6 годам достигая отметки в 110-155г\л. У детей возрастом до 15 лет нормальный уровень находится на отметке 115-160г\л и к подростковому возрасту увеличивается до 120-160г\л.
Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов. К наиболее часто встречающимся и известным гемоглобинопатиям относятся серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина. Гемоглобинопатии классифицируются на качественные и количественные. Качественные обусловлены заменой аминокислот в полипептидных цепях. Замена аминокислоты глутамина 6 на валин в β-цепи приводит к образованию аномального гемоглобина S, что лежит в основе развития серповидно-клеточной анемии. Аномальных гемоглобинов более 300, но не все аномалии проявляются. Количественные гемоглобинопатии связаны со скоростью синтеза α- или β-полипептидных цепей глобина. Угнетение скорости синтеза α-цепи приводит к развитию α-талассемии, угнетение синтеза β-цепи лежит в основе заболевания β-талассемии. Гемоглобинопатии —наследственные заболевания. Диагностика гемоглобинопатий основывается, кроме клинических данных, на обязательном специальном исследовании электрофорезе гемоглобина. Это исследование проводится не только для больного, но и для ближайших родственников. Данные электрофореза гемоглобина позволяют поставить диагноз талассемии. Для альфа-талассемии характерно обнаружение гемоглобинов-гомотетрамеров Нв-Н и Нв-Bart.Для бета-талассемии характерно повышенное содержание гемоглобина Α2.
99. Биохимия железа. Соединения железа, находящегося в клетке: гемопротеины, металлофлавопротеины, неферментное железо. Белки, переносящие железо: трансферрин. Белки, связывающие железо в клетке: феррин, гемосидерин. Участие железа в обмене веществ. Нарушение обмена железа (дефицит железа). Железодефицитные анемии.
В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонук-леотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа. В организме взрослого человека содержится 3 - 4 г железа, из которых только около 3,5 мг находится в плазме крови. Гемоглобин имеет примерно 68% железа всего организма, ферритин - 27%, миоглобин - 4%, трансферрин - 0,1%, На долю всех содержащих железо ферментов приходится всего 0,6% железа, имеющегося в организме. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки. В нейтральной или щелочной среде железо находится в окисленном состоянии - Fe3+, образуя крупные, легко агрегирующие комплексы с ОН-, другими анионами и водой. При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям и образуют с ними хелатные комплексы, изменяя свойства и функции этих соединений, поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин. В пище железо в основном находится в окисленном состоянии (Fe3+) и входит в состав белков или солей органических кислот. Освобождению железа из солей органических кислот способствует кислая среда желудочного сока. Наибольшее количество железа всасывается в двенадцатиперстной кишке. Аскорбиновая кислота, содержащаяся в пище, восстанавливает железо и улучшает его всасывание, так как в клетки слизистой оболочки кишечника поступает только Fe2+. В суточном количестве пищи обычно содержится 15 - 20 мг железа, а всасывается только около 10% этого количества. Организм взрослого человека теряет около 1 мг железа в сутки. Количество железа, которое всасывается в клетки слизистой оболочки кишечника, как правило, превышает потребности организма. Поступление железа из энтероцитов в кровь зависит от скорости синтеза в них белка апоферритина. Апоферритин "улавливает" железо в энтероцитах и превращается в ферритин, который остаётся в энтероцитах. Таким способом снижается поступление железа в капилляры крови из клеток кишечника. Когда потребность в железе невелика, скорость синтеза апоферритина повышается (см. ниже "Регуляция поступления железа в клетки"). Постоянное слущивание клеток слизистой оболочки в просвет кишечника освобождает организм от излишков железа. При недостатке железа в организме апоферритин в энтероцитах почти не синтезируется. елезо, поступающее из энтероцитов в кровь, транспортирует белок плазмы крови трансферрин. В плазме крови железо транспортирует белок трансферрин. Трансферрин - гликопротеин, который синтезируется в печени и связывает только окисленное железо (Fe3+). Поступающее в кровь железо окисляет фермент ферроксидаза, известный как медьсодержащий белок плазмы крови церулоплазмин. Одна молекула трансферрина может связать один или два иона Fe3+, но одновременно с анионом СО32- с образованием комплекса трансферрин-2 (Fe3+-CO32-). В норме трансферрин крови насыщен железом приблизительно на 33%.
Нарушения метаболизма железа. Железодефицитная анемия может наблюдаться при повторяющихся кровотечениях, беременности, частых родах, язвах и опухолях ЖКТ, после операций на ЖКТ. При железодефицитной анемии уменьшается размер эритроцитов и их пигментация (гипохромные эритроциты малых размеров). В эритроцитах уменьшается содержание гемоглобина, понижается насыщение железом трансферрина, а в тканях и плазме крови снижается концентрация ферритина. Причина этих изменений - недостаток железа в организме, вследствие чего снижается синтез гема и ферритина в неэритроидных тканях и гемоглобина в эритроидных клетках.
Гемохроматоз. Когда количество железа в клетках превышает объём ферритинового депо, железо откладывается в белковой части молекулы ферритина. В результате образования таких аморфных тложений избыточного железа ферритии превращается в гемосидерин. Гемосидерин плохо растворим в воде и содержит до 37% железа Накопление гранул гемосидерина в печени, поджелудочной железе, селезёнке и печени приводит к повреждению этих органов - гемохроматозу.
100.Понятие о белках крови. Белки крови как гетерогенная система. Отдельные функции белков, их функциональная роль. Физиологические и патологические белки. Качественные и количественные изменения белков крови. Понятие о гипер-, гипо-, парапротеинемии. Белковый коэффициент.
Из 9–10% сухого остатка плазмы крови на долю белков приходится 6,5–8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40–50 г/л, глобулинов – 20–30 г/л, фибриногена – 2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой. Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна. 1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше, чем в тканевой жидкости. Белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла. Несмотря на то что онкотическое давление составляет лишь небольшую часть (около 0,5%) от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. 2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови. 3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4– раз выше вязкости воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе.
крови.
101.Возрастные колебания общего белка крови и его фракции. Наличие фетальных белков в крови. Иммуноглобулины. Неспецифические факторы защиты.
В сыворотке крови здорового человека при электрофорезе на бумаге можно обнаружить 5 фракций: альбумины, α1-, α2-, β, γглобулины. Методом электрофореза в агаровом геле в сыворотке крови выделяют 7– 8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле –до 16–7 фракций. Альбумины. На долю альбуминов приходится более половины (55–60%) белков плазмы крови человека. Мол. масса альбумина около 70000. Сывороточные альбумины сравнительно быстро обновляются (период полурас-
пада альбуминов человека 7 дней). Благодаря высокой гидрофильности, особенно в связи с относительно
небольшим размером молекул и значительной концентрацией в сыворотке, альбумины играют важную роль в поддержании онкотического давления крови. Известно, что концентрация альбуминов в сыворотке ниже 30 г/л вызывает значительные изменения онкотического давления крови, что приводит к возникновению отеков. Альбумины выполняют важную функцию транспорта многих биологически активных веществ (в частности, гормонов). Они способны связываться с холестерином, желчными пигментами. Значительная часть кальция в сыворотке крови также связана с альбуминами.
Глобулины. Сывороточные глобулины при высаливании нейтральными солями можно разделить на 2 фракции – эуглобулины и псевдоглобулины. Фракция эуглобулинов в основном состоит из γ-глобулинов, а фракция псевдоглобулинов включает α-, β- и γ-глобулины, которые при электрофорезе, особенно в крахмальном или полиакриламидном геле, способны разделяться на ряд подфракций. α- и β-Глобулиновые фракции содержат липопротеины, а также белки, связанные с металлами. Большая часть антител, содержащихся в сыворотке, находится во фракции γ-глобулинов. При снижении уровня белков этой фракции резко понижаются защитные силы организма.
Иммуноглобулины синтезируются В-лимфоцитами или образующимися из них плазматическими клетками. Известно 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE, при этом IgG, IgA и IgM – основные классы; IgD и IgE – минорные классы иммуноглобулинов плазмы человека. Молекула иммуноглобулина состоит из двух идентичных пар полипептидных цепей. Каждая пара в свою очередь состоит из двух разных цепей: легкой (L) и тяжелой (Н).
Гиперпротеинемия – увеличение общего содержания белков плазмы. Диарея у детей, рвота при непроходимости верхнего отдела тонкой кишки, обширные ожоги могут способствовать повышению концентрации белков в плазме крови. Иными словами, потеря воды организмом, а следовательно, и плазмой приводит к повышению концентрации белка в крови (относительная гиперпротеинемия). При ряде патологических состояний может наблюдаться абсолютная гиперпротеинемия, обусловленная увеличением уровня γ-глобулинов: например, гиперпротеинемия в результате инфекционного или токсического раздражения системы макрофагов; гиперпротеинемия при миеломной болезни. В сыворотке крови больных миеломной болезнью обнаруживаются специфические ≪миеломные≫ белки. Появление в плазме крови белков, не существующих в нормальных условиях, принято называть парапротеинемией. Нередко при этом заболевании содержание белков в плазме достигает 100–160 г/л.
Гипопротеинемия, или уменьшение общего количества белка в плазме крови, наблюдается главным образом при снижении уровня альбуминов. Выраженная гипопротеинемия – постоянный и патогенетически важный симптом нефротического синдрома. Содержание общего белка снижается до 30–40 г/л. Гипопротеинемия наблюдается также при поражении печеночных клеток (острая атрофия печени, токсический гепатит и др.). Кроме того, гипопротеинемия может возникнуть при резко увеличенной проницаемости стенок капилляров, при белковой недостаточности (поражение пищеварительного тракта, карцинома и др.). Следовательно, можно считать, что гиперпротеинемия, как правило, связана с гиперглобулинемией, а гипопротеинемия – с гипоальбуминемией. При многих заболеваниях очень часто изменяется процентное соотношение отдельных белковых фракций, хотя общее содержание белка в сыворотке крови остается в пределах нормы. Такое состояние носит название диспротеинемия.
102.Ферменты крови: собственные ферменты крови, индикаторные и экскреторные ферменты. Диагностическое значение исследования их активности. Иммуноглобулины крови, их структура и функции. Диагностическое значение их исследования.
Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: секреторные, индикаторные и экскреторные.
Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза.
Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток ≪вымываются≫ в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей.
Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических
условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы, регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфераза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы.
Органоспецифическими ферментами для печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствуето поражении печеночной ткани. В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5.
103.Возрастные особенности содержание и распределения воды в организме ребенка. Лябильность водного обмена. Физиологическая потеря жидкости новорожденными.
Водный обмен — совокупность процессов всасывания воды, введенной в организм при питье и с пищевыми продуктами, распределения ее в организме, образования воды при окислении жиров, углеводов и белков в тканях и выделения воды почками, легкими, кожей и кишечником. Водный обмен — составная часть общего обмена веществ организма. Общее содержание воды во взрослом организме составляет 65—70% (у эмбрионов достигает 97%), при этом вода находится в свободном и связанном состоянии. Свободная вода легко переходит из клеток во внеклеточное пространство, плазму крови, лимфу и обратно; связанная вода прочно удерживается главным образом белками. В здоровом организме взрослого человека сохраняется состояние водного равновесия (баланс), т. е. количество воды, потребляемой и образующейся в организме, равно количеству выделяемой воды. Общее количество потребляемой при питье и с пищевыми продуктами воды равно 2000—2500 мл, в том числе при питье — 1200—1500 мл в сутки. Выделение воды происходит главным образом через почки (50—60%), остальная часть выделяется через кожу, легкие и кишечник. Водный обмен регулируется центральной нервной системой и гормонами. Водный обмен у детей. У детей водный обмен имеет ряд особенностей, связанных с большей интенсивностью обменных процессов, недостаточной концентрационной способностью почек, потерей воды в результате неощутимой перспирации (выведение воды через кожу и органы дыхания) и несовершенством нейрогуморальной регуляции усвоения и выведения воды из организма.
Ребенок рождается в состоянии физиологической гипергидратации (содержание воды составляет 75— 80% веса тела). В последующие сутки у новорожденного отмечается отрицательный водный баланс, обусловленный большой потерей воды через легкие почки (выделение изотонической мочи), с меконием. Однако общее содержание воды продолжает оставаться высоким. Интенсивность обмена воды у детей, особенно в раннем возрасте, связана с большой относительной поверхностью тела. Чем моложе ребенок, тем больше у него относительная поверхность тела и тем больше потеря воды. Так, если у взрослого в водном обмене участвует 1/7 часть внеклеточной жидкости, то у ребенка грудного возраста — половина. Незначительное содержание связанной воды во внеклеточной жидкости из-за слабого развития соединительной ткани создает условия гидролабильности.В первые шесть месяцев после рождения содержание воды постепенно снижается и в дальнейшем остается в пределах 65% независимо от возраста и пола. В период полового созревания у юношей наблюдается несколько большее содержание воды в организме, чем у девушек. Уменьшение общего содержания воды в процессе роста ребенка происходит исключительно за счет внеклеточной жидкости. Количество воды внутри клеток по отношению к весу тела практически не изменяется. Влияние возраста на водный обмен особенно интенсивно сказывается на первом году жизни. Максимальная потеря веса наблюдается у большинства доношенных новорожденных на 3–5 день жизни, восстановление массы тела происходит через 6-12 дней после рождения. У недоношенных малышей потеря массы тела зависит также от массы при рождении, но восстанавливается она лишь к второй-третьей неделе жизни, и то не у всех новорожденных. Различают три степени потери первоначальной массы тела новорожденного: первая степень (потеря веса составляет меньше 6% от веса при рождении). В этом случае у ребенка не отмечаются признаки обезвоживания, но может присутствовать жадность во время кормления, беспокойство. На клеточном уровне при лабораторных исследованиях выявляются незначительные признаки внутриклеточной гипогидратации. Большинство новорожденных относятся именно к этой группе. вторая степень (потеря веса новорожденного в пределах 6-10%). В этом случае могут проявляться некоторые признаки обезвоживания: жажда, яркость слизистых оболочек, бледность кожных покровов, учащение сердцебиения, отдышка, в поведении ребенка заметна раздражительность. В лабораторных условиях наблюдаются признаки внутриклеточной гипогидратации и внеклеточного обезвоживания. третья степень (потеря веса более 10%). В этом случае более выражено наблюдаются признаки обезвоживания: сильная жажда, сухие слизистые и кожные покровы, отдышка, выраженная тахикардия, повышение температуры, ребенок ведет себя беспокойно или заторможено. Лабораторно наблюдаются выраженные признаки внутриклеточной и внеклеточной гипогидротации. Потеря более 10% массы тела может привести к существенному ухудшению состояния ребенка, поэтому врач в индивидуальном порядке решает вопрос о необходимости дополнительного допаивания или докармливания смесью.
104.Водно-солевой обмен. Взаимосвязь воды и солей. Значение воды. Распределение ее в организме. Потребность в воде и ее выведение. Физико-химические процессы регуляции транспорта жидкости в условиях целостного организма. Минеральные соли (катионы и анионы) и осмотическое давление. Значение отдельных катионов и анионов. Буферные системы. Местные, обменные факторы регуляции водно-солевого обмена. Альдостерон и вазопрессин, механизм их действия. Роль почек в этом процессе. Нарушение обмена солей (гипер- и гипокалиемия) и воды (отеки, гипер- и гипогидратация).
Водно-солевой обмен — совокупность процессов поступления воды и солей (электролитов) в организм, распределения их во внутренней среде и выведения. Системы регуляции водно-солевого обмена обеспечивают постоянство суммарной концентрации растворенных частиц, ионного состава и кислотно-щелочного равновесия, а также объема и качественного состава жидкостей организма. Организм человека состоит в среднем на 65% из воды (от 60 до 70% от веса тела), которая находится в трех жидкостных фазах — внутриклеточной, внеклеточной и трансцеллюлярной. Наибольшее количество воды (40—45%) находится внутри клеток. Внеклеточная жидкость включает (в процентах от веса тела) плазму крови (5%), межклеточную жидкость (16%) и лимфу (2%). Трансцеллюлярная жидкость (1 — 3%) изолирована от сосудов слоем эпителия и по своему составу близка к внеклеточной. Это — спинномозговая и внутриглазная жидкости, а также жидкости брюшной полости, плевры, перикарда, суставных сумок и желудочно-кишечного тракта. Водный и электролитный балансы у человека рассчитываются по суточному потреблению и выделению воды и электролитов из организма. Вода поступает в организм в виде питья — примерно 1,2 л и с пищей — примерно 1 л. Около 0,3 л воды образуется в процессе обмена веществ (из 100 г жиров, 100 г углеводов и 100 г белков образуется 107, 55 и 41 мл воды соответственно). Суточная потребность взрослого человека в электролитах составляет примерно: натрий — 215, калий — 75, кальций — 60, магний — 35, хлор — 215, фосфат — 105 мг-экв (миллиграмм-эквивалент) в день. Эти вещества всасываются в желудочно-кишечном тракте и поступают в кровь. Временно они могут депонироваться в печени. Избыток воды и электролитов выводится почками, легкими, кишечником и кожей. В среднем за сутки выделение воды с мочой составляет 1,0— 1,4 л, с калом — 0,2 л, кожей и с потом — 0,5 л, легкими — 0,4 л. Вода, поступившая в организм, распределяется между различными жидкостными фазами в зависимости от концентрации в них осмотически активных веществ. Направление движения воды зависит от осмотического градиента и определяется состоянием цитоплазматической мембраны. На распределение воды между клеткой и межклеточной жидкостью оказывает влияние не общее осмотическое давление внеклеточной жидкости, а ее эффективное осмотическое давление, которое определяется концентрацией в жидкости веществ, плохо проходящих через клеточную мембрану. Осмотическое давление крови поддерживается на постоянном уровне — 7,6 атмосфер. Поскольку осмотическое давление определяется концентрацией осмотически активных веществ (осмолярная концентрация), которую измеряют криометрическим методом, то осмолярную концентрацию выражают в мосм/л или Δ °; для сыворотки крови человека это около 300 мосм/л (или 0,553°). Осмолярная концентрация межклеточной, внутриклеточной и трансцеллюлярной жидкостей обычно такая же, как и плазмы крови; выделения ряда желез (например, пот, слюна) гипотоничны. Моча млекопитающих и птиц, секрет солевых желез птиц и рептилий гипертоничны относительно плазмы крови. У человека и животных одной из важнейших констант является рН крови, поддерживаемый на уровне около 7,36. В крови имеется ряд буферных систем — бикарбонатная, фосфатная, белки плазмы, а также гемоглобин, — поддерживающих рН крови на постоянном уровне. Но в основном рН плазмы крови зависит от парциального давления углекислого газа и концентрации НСО–3. Отдельные органы и ткани животных и человека существенно различаются по содержанию воды и электролитов. Важнейшее значение для деятельности клеток всех органов и систем имеет поддержание ионной асимметрии между внутриклеточной и внеклеточной жидкостью. В крови и других внеклеточных жидкостях высока концентрация ионов натрия, хлора, бикарбоната; в клетках главными электролитами являются калий, магний, органические фосфаты. Различия электролитного состава плазмы крови и межклеточной жидкости обусловлены низкой проницаемостью для белков капиллярной стенки. В соответствии с правилом Доннана внутри сосуда, где находится белок, концентрация катионов выше, чем в межклеточной жидкости, где относительно выше концентрация анионов, способных к диффузии. Для ионов натрия и калия фактор Доннана составляет 0,95, для одновалентных анионов 1,05.
105.Обмен кальция и фосфора. Биологическая роль кальция и фосфора. Соотношение кальция и фосфора в норме. Роль кальцитонина и паратгормона в регуляции обмена кальция и неорганического фосфора. Значение витамина Д и активных его форм в поддержании постоянной концентрации кальция и фосфора. Взаимодействие их с паратгормонами. Патологии кальциево-фосфорного обмена (рахит, остеопороз), их биологическое различие.
К функциям кальция в организме относятся:
· структурная (кости, зубы);
· сигнальная (внутриклеточный вторичный мессенджер-посредник);
· ферментативная (кофермент факторов свертывания крови);
· нейромышечная (контроль возбудимости, выделение нейротрансмиттеров, инициация мышечного сокращения).
Главная роль в метаболизме кальция в организме человека принадлежит костной ткани. В костях кальций представлен фосфатами — Са3(РО4)2 (85%), карбонатами — СаСО3 (10%), солями органических кислот — лимонной и молочной (около 5%). Вне скелета кальций содержится во внеклеточной жидкости и практически отсутствует в клетках. В состав плотного матрикса кости, наряду с коллагеном, входит фосфат кальция — кристаллическое минеральное соединение, близкое к гидроксилапатиту Са10(РО4)6(ОН)2. Часть ионов Са2+ замещена ионами Mg2+, незначительная часть ионов ОН– — ионами фтора, которые повышают прочность кости. Минеральные компоненты костной ткани находятся в состоянии химического равновесия с ионами кальция и фосфата сыворотки крови. Клетки костной ткани могут ускорять отложение или, наоборот, растворение минеральных компонентов при локальных изменениях рН, концентрации ионов Са2+, НРО42-, хелатообразующих соединений (Д. Мецлер, 1980). В организме взрослого человека содержится 1-2 кг кальция, 98% которого находится в составе скелета (А. Уайт и соавт., 1981). Он составляет около 2% массы тела (примерно 30 моль). В крови уровень кальция — 9-11 мг/100 мл (2,2-2,8 ммоль/л), во внеклеточной жидкости — около 20 мг/100 мл. Регуляция обмена кальция между вне- и внутриклеточной жидкостью осуществляется паратгормоном, кальцитонином, 1,25-диоксихолекальциферолом. При уменьшении концентрации ионов кальция возрастает секреция паратиреотропного гормона (ПТГ), и остеокласты увеличивают растворение содержащихся в костях минеральных соединений. ПТГ увеличивает одновременно реабсорбцию ионов Са2+ в почечных канальцах. В итоге повышается уровень кальция в сыворотке крови. При увеличении содержания ионов кальция секретируется кальцитонин, который снижает концентрацию ионов Са2+ за счет отложения кальция в результате деятельности остеобластов. В процессе регуляции участвует витамин D, он требуется для синтеза кальцийсвязывающих белков, необходимых для всасывания ионов Са2+ в кишечнике, реабсорбции его в почках. Постоянное поступление витамина D необходимо для нормального течения процессов кальцификации. Изменение уровня кальция в крови могут вызывать тироксин, андрогены, которые повышают содержание ионов Са2+, и глюкокортикоиды, снижающие его. Ионы Са2+ связывают многие белки, в том числе некоторые белки системы свертывания крови. В белках системы свертывания содержатся кальций-связывающие участки, образование которых зависит от витамина К. Нарушения обмена кальция сопровождаются нарушениями обмена фосфатов и клинически проявляются в изменениях костного скелета и нервно-мышечной возбудимости. Наблюдается обратная зависимость между содержанием кальция и фосфора в сыворотке крови (одновременное повышение наблюдается при гиперпаратиреоидизме, снижение — при рахите у детей). При повышенном содержании фосфора в пище в желудочно-кишечном тракте образуется невсасывающийся трехосновной фосфорнокислый кальций. Суточная потребность в кальции взрослого человека составляет 20-37,5 ммоль (0,8-1,5 г), у беременных и кормящих в два раза выше (М. А. Базарнова и соавт., 1986). В пищевой канал ежедневно поступает 35 ммоль кальция, но всасывается только половина, в 50 раз медленнее, чем натрий, но интенсивнее, чем железо, цинк, марганец. Всасывание происходит в тонком кишечнике (максимально в 12-перстной кишке). Лучше всего всасывается глюконат и лактат кальция. Оптимум всасывания наблюдается при рН=3,0. Кальций соединяется с жирными и желчными кислотами и через воротную вену поступает в печень. Транспорту через мембрану энтероцита в кровь способствует витамин D. Всасывание снижается при недостатке фосфатов (важное значение имеет соотношение кальций/фосфор). На всасывание влияет концентрация Nа+, активность щелочной фосфатазы, Mg2+-, Са2+-АТФ-азы, содержание кальций-связывающего белка. Из организма в норме кальций выводится через кишечник. Ежедневно в пищевой канал секретируется слюнными, желудочными и поджелудочными железами и выводится около 25 ммоль Са2+(М. А. Базарнова и соавт., 1986). Выведение кальция с калом сохраняется даже при бескальциевой диете (в составе желчи). В почках за сутки фильтруется около 270 ммоль Са2+. 90% кальция, фильтруемого в почках, реабсорбируется, поэтому в целом с мочой его выделяется мало (выделение возрастает при увеличении концентрации кальция в крови и ведет к образованию камней в почках). Суточная экскреция колеблется от 1,5 до 15 ммоль и зависит от суточного ритма (максимум в утренние часы), уровня гормонов, кислотно-основного состояния, характера пищи (углеводы усиливают выведение кальция). При рассасывании минерального остова костей, реабсорбция кальция снижается. Кости являются резервуаром кальция: при гипокальциемии кальций поступает из костей и, наоборот, при гиперкальциемии он откладывается в скелете. Ионы кальция важны для течения многих процессов:
· нервно-мышечного возбуждения;
· мышечного сокращения;
· свертывания крови;
· проницаемости клеточных мембран;
· активности многих ферментов и перекисного окисления липидов.
Основные источники кальция — молоко, молочные продукты (творог, твердые сыры), рыба, яйца. Он содержится также в зеленых овощах, орехах. Одним из источников кальция является питьевая вода (в 1 литре до 350-500 мг). С питьевой водой поступает 10-30% кальция (В. И. Смоляр, 1991). Биодоступность кальция улучшают кисломолочные продукты, животные белки, снижают ее — пищевые волокна, алкоголь, кофеин, избыток жиров (образуются нерастворимые соединения), фосфаты, оксалаты. Повышенное содержание в пище магния и калия тормозит всасывание кальция: они конкурируют с кальцием за желчные кислоты. Препараты витамина D способствуют всасыванию кальция. При лечении остеопороза одновременно с назначением препаратов кальция необходимо восполнение дефицита белков, кальциферола, витаминов.
Гиперкальциемия — результат повышенного поступления кальция во внеклеточную жидкость из резорбируемой костной ткани или из пищи в условиях снижения почечной реабсорбции. Наиболее частой причиной гиперкальциемии (90% случаев) являются первичный гиперпаратиреоз, злокачественные новообразования. Часто гиперкальциемия клинически не проявляется. К редким причинам гиперкальциемии относят (У. Клаттер, 1995) гранулематозные заболевания (в том числе саркоидоз), гипервитаминоз D, тиреотоксикоз, применение тиазидных диуретиков, препаратов лития, молочно-щелочной синдром, длительную обездвиженность, наследственную гипокальциурическую гиперкальциемию, почечную недостаточность. К клиническим симптомам гиперкальциемии относятся:
· отсутствие аппетита, тошнота, рвота, боли в животе (развивается язва желудка и 12-перстной кишки, панкреатит), запоры;
· слабость, утомляемость, снижение массы тела, мышечная слабость;
· изменения личности, ухудшение концентрации внимания, сонливость, кома;
· аритмии, укорочение интервала Q-T на ЭКГ;
· нефрокальциноз, почечные конкременты, кальциноз сосудов, роговицы;
· полиурия, дегидратация, почечная недостаточность.
Роль фосфора в организме человека. В организме взрослого человека содержится около 670 г фосфора (1% массы тела), который необходим для образования костей и клеточного энергетического обмена. 90% фосфора, подобно кальцию, находится в скелете — костях и зубах (М.А. Базарнова и соавт., 1986). Вместе с кальцием они составляют основу твердого вещества кости. В костях фосфор представлен трудно растворимым фосфатом кальция (2/3) и растворимыми соединениями (1/3). Большая часть остального количества фосфора находится внутри клеток, 1% — во внеклеточной жидкости. Поэтому уровень фосфора в сыворотке крови не позволяет судить об общем его содержания в организме. Фосфаты являются структурными элементами костной ткани, участвуют в переносе энергии в виде макроэргических связей (АТФ, АДФ, креатинфосфат, гуанинфосфат и других). Фосфор и сера — два элемента в организме человека, которые входят в состав различных макроэргических соединений. С участием фосфорной кислоты осуществляется гликолиз, гликогенез, обмен жиров. Фосфор входит в структуру ДНК, РНК, обеспечивающих синтез белка. Он участвует в окислительном фосфорилировании, в результате которого образуется АТФ, фосфорилировании некоторых витаминов (тиамина, пиридоксина и других). Фосфор важен также для функционирования мышечной ткани (скелетной мускулатуры и сердечной мышцы). При нарушении обмена фосфора обнаруживаются повышение и снижение его в крови. Гиперфосфатемия часто наблюдается при почечной недостаточности, встречается при гипопаратиреозе, псевдогипопаратиреозе, рабдомиолизе, распаде опухолей, метаболическом и респираторном ацидозе. Гиперфосфатемия подавляет гидроксилирование 25-гидроксикальциферола в почках. Умеренная гипофосфатемия не сопровождается существенными последствиями. Тяжелая гипофосфатемия (менее 0,3 ммоль/л (1 мг%) сопровождается нарушением функции эритроцитов, лейкоцитов, мышечной слабостью (нарушается образование АТФ, 2,3-дифосфоглицерата). Она наблюдается при злоупотреблении алкоголем и абстиненции, респираторном алкалозе, нарушении всасывания в кишечнике, приеме средств, связывающих фосфат, возобновлении приема пищи после голодания, при переедании, тяжелых ожогах, лечении диабетического кетоацидоза (У. Клаттер, 1995). При диабетическом кетоацидозе гипофосфатемия не является признаком истощения запасов фосфата. Умеренная гипофосфатемия (1,0-2,5 мг%) может наблюдаться при инфузии глюкозы, дефиците витамина D в пище или снижении его всасывания в кишечнике, при гиперпаратиреозе, остром тубулярном некрозе, после пересадки почек, при наследственной гипофосфатемии, синдроме Фанкони, паранеопластической остеомаляции, увеличении объема внеклеточной жидкости. Респираторный алкалоз может вызвать гипофосфатемию, стимулируя активность фосфофруктокиназы и образование фосфорилированных промежуточных продуктов гликолиза. Хроническая гипофосфатемия приводит к рахиту и остеомаляции.
Гомеостаз кальция и фосфата. Гипокальциемия стимулирует секрецию паратиреоидного гормона и тем самым увеличивает продукцию кальцитриола. В результате увеличивается мобилизация кальция и фосфатов из костей, их поступление из кишечника. Избыток фосфатов экскретируется с мочой (ПТГ оказывает фосфатурическое действие), а реабсорбция кальция в почечных канальцах возрастает, и концентрация его в крови нормализуется. Гипофосфатемия сопровождается усилением секреции только кальцитриола. Увеличение под действием кальцитриола его концентрации в плазме приводит к снижению секреции паратиреоидного гормона. Гипофосфатемия приводит к стимуляции абсорбции фосфата и кальция в кишечнике. Избыток кальция выводится с мочой, так как кальцитриол усиливает реабсорбцию кальция в незначительной мере (по сравнению с ПТГ). В результате описанных процессов нормальная концентрация фосфата в плазме крови восстанавливается независимо от концентрации кальция.
106.Важность минеральных солей для обменных процессов у детей (пластическая и регуляторная роль). Значение прикорма ребенка для уменьшения дефицита минеральных солей.
Важность минерального обмена для организма ребенка определяется значением минеральных соединений для очень многих жизненных процессов. Эту роль биогенных стимуляторов минеральные вещества выполняют, находясь в тканях в виде пластического материала либо в нерастворимом или ионизированном состоянии в тканях, клетках и жидкостях организма. Сведения о процессе минерального обмена не полны и не совершенны из-за больших трудностей исследования его у детей. Наибольшее значение имеют катионы кальция, калия, натрия, железа, магния и анионы хлора, серной, фосфорной и угольной кислот. Минеральных солей задерживается тем больше, чем больше их получает организм. Суточная потребность организма в кальции равна у грудных детей 0,15—0,18 г, в возрасте 6—7 лет — 0,3—0,5 г и у детей старшего возраста до 1 г в день. Относительная потребность организма в кальции весьма своеобразна у детей первого года жизни: она в 8 раз больше, чем на 2-м году жизни, и в 13 раз больше, чем на 3-м году жизни. Количество кальция в крови здоровых детей составляет около 10 мг%, оно подвержено сезонным колебаниям, особенно снижается ранней весной, что связано с недостаточностью ультрафиолетовой радиации в зимние месяцы. 97% кальция фиксировано в основном в костной ткани и зубах; 3% активного кальция крови и тканей используются организмом для роста костной ткани, свертывания крови, поддержания определенного тонуса нервной системы и других физиологических процессов. Выводится кальций из организма главным образом с калом. Ценность фосфора для растущего организма определяется его основной ролью в жизни клеток, участием фосфора в построении скелета, в ферментативных процессах, функции железистых органов и нервной системы. Фосфор, вводимый с животными белками и жирами (органический) и растительной пищей (неорганический), задерживается в организме при искусственном вскармливании и у детей старшего возраста в 30—3596, тогда как при вскармливании грудным молоком ретенция фосфора равняется 70%.
Средняя потребность в фосфоре на 1 кг веса равняется 0,03 фосфорного ангидрида. В крови фосфора содержится 5 мг%. Выделяется фосфор из организма с мочой. Железо является катализатором окислительных процессов и материалом для образования гемоглобина. Запасы его накапливаются во время внутриутробного развития, и ребенок рождается с некоторым запасом железа в печени. Суточная потребность в железе у детей около 0,5 мг на 1 кг веса, удовлетворяется главным образом за счет мяса, желтка, растительной пищи. Всасывание железа пищи происходит в верхних отделах кишечника, а выделение его в виде окисей — в нижних отделах.
107.Клеточный состав соединительной ткани (фибропласты, тучные клетки, макрофаги), особенности их обмена. Коллаген и эластин – компоненты соеденительной ткани. Особенности аминокислотного состава коллагена. Биосинтез коллагена. Биохимические показатели, характеризующие метаболизм коллагена. Коллагенозы.
Соедини́тельная ткань — это ткань живого организма, не отвечающая непосредственно за работу какого-либо органа или системы органов, но играющая вспомогательную роль во всех органах, составляя 60—90 % от их массы. Выполняет опорную, защитную и трофическую функции. Соединительная ткань образует опорный каркас (строму) и наружные покровы (дерму) всех органов. Общими свойствами всех соединительных тканей является происхождение из мезенхимы, а также выполнение опорных функций и структурное сходство. Большая часть твёрдой соединительной ткани является фиброзной: состоит из волокон коллагена и эластина. К соединительной ткани относят костную,хрящевую, жировую и другие. К соединительной ткани относят также кровь и лимфу. Поэтому соединительная ткань — единственная ткань, которая присутствует в организме в 4-х видах — волокнистом (связки), твёрдом (кости), гелеобразном (хрящи) и жидком (кровь, лимфа, а также межклеточная, спинномозговая и синовиальная и прочие жидкости). Соединительная ткань состоит из внеклеточного матрикса и нескольких видов клеток. Клетки, относящиеся к соединительной ткани:
· фибробласты — производят коллаген и другие вещества внеклеточного матрикса, способны делиться.
· фиброкласты — клетки, способные поглощать и переваривать межклеточный матрикс; являются зрелыми фибробластами, к делению не способны.
· меланоциты — сильно разветвлённые клетки, содержащие меланин, присутствуют в радужной оболочке глаз и коже (по происхождению — эктодермальные клетки, производныенервного гребня)
· макрофаги — клетки, поглощающие болезнетворные организмы и отмершие клетки ткани (по происхождению моноциты крови)
· эндотелиоциты — окружают кровеносные сосуды, производят внеклеточный матрикс и продуцируют гепарин. Эндотелий по большинству признаков относят к эпителию.
· тучные клетки — продуцируют метахроматические гранулы, которые содержат гепарин и гистамин.
· мезенхимные клетки — клетки эмбриональной соединительной ткани
Коллаген. Характерным компонентом структуры соединительной ткани являютсяколлагеновые волокна. Они построены в основном из своеобразногобелки – коллагена. Коллаген составляет 25–33% от общего количествабелка организма взрослого человека, или 6% от массы тела.Видимые в оптическом микроскопе коллагеновые волокна состоят изразличимых в электронном микроскопе фибрилл – вытянутых в длинубелковых молекул, названных тропоколлагеном. Тропоколлаген – ос-новная структурная единица коллагена. Необходимо четкоразграничивать понятия ≪коллагеновые волокна≫ и ≪коллаген≫. Первоепонятие по существу является морфологическим и не может быть сведенок биохимическим представлениям о коллагене как о белке. Коллагеновоеволокно представляет собой гетерогенное образование и содержит, кромебелка коллагена, другие химические компоненты. Молекула тропоколла -гена – это белок коллаген. Одной из отличительных черт данного белкаявляется то, что 1/3 всех его аминокислотных остатков составляет глицин,1/3 – пролин и 4-гидроксипролин, около 1% – гидроксилизин; некоторыемолекулярные формы коллагена содержат также 3-гидроксипролин, хотяи в весьма ограниченном количестве. Молекулярная масса тропоколлагена около 285000. Тропоколлагенсостоит из трех полипептидных цепей одинакового размера, которыесливаются в спиралевидный триплет. Тройная спираль стабилизируетсямногочисленными межцепочечными поперечными сшивками между лизиновыми и гидроксилизиновыми остатками. Каждая полипептидная цепьтропоколлагена содержит около 1000 аминокислотных остатков. Такимобразом, основная структурная единица коллагена имеет очень большиеразмеры, например в 10 раз больше, чем химотрипсин.Изучение аминокислотного состава и последовательности чередованияаминокислот в полипептидных цепях тропоколлагена показало, что существует два типа цепей – цепи α1 и α2, а также четыре разновидности цепиα1: α1 (I), α1 (II), α1 (III) и α1 (IV). В табл. 21.1 представлены данныео структуре коллагенов различных тканей. Как и все белки, коллаген синтезируется клетками из свободных аминокислотных остатков. Аминокислотные остатки, специфичные для молекулы коллагена, гидроксипролин и гидроксилизин не образуются из соответствующих свободных аминокислот. Эти аминокислотные остатки появляются после включения пролина и лизина в полипептидную цепь с участием ферментов пролилгидроксилазы или лизилгидроксилазы и кофактора – аскорбиновой кислоты. Эластин – основной белковый компонент, из которого состоят эластические волокна. Он отличается от коллагена по химическому составу и молекулярной структуре. Общими для эластина и коллагена являются большое содержание глицина и пролина, наличие оксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем в коллагене. Как и в коллагене, в эластине
мало метионина и отсутствуют триптофан и цистеин. В отличие от коллагена в эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина. В целом характерной особенностью первичной структуры эластина является слишком малое содержание полярных аминокислотных остатков. При ферментативном гидролизе эластина в гидролизате обнаруживаются десмозин и изодесмозин. Эти соединения содержатся только в эластине. Эластин вместе с коллагеном, протеогликанами и рядом глико- и мукопротеинов является продуктом биосинтетической деятельности фибробластов. Непосредственным продуктом клеточного биосинтеза считается не
эластин, а его предшественник – тропоэластин (в коллагене – проколлаген). Тропоэластин не содержит поперечных связей, обладает растворимостью. В последующем тропоэластин превращается в зрелый эластин, нерастворимый, содержащий большое количество поперечных связей.
108.Интенсивный обмен всех структур соединительной ткани ребенка. Повышенное содержание коллагена.
109.Межклеточный матрикс соединительной ткани. Глюкозаминогликаны и протеогликаны: характеристика их полисахаридных групп. Гиалуроновая и хондроитинсерная кислоты, их функции. Образование и катаболизм протеогликанов. Роль гиалуронидазы в метаболизме основного вещества соединительной ткани. Нарушения обмена протеогликанов при патологии.
Протеогликаны – высокомолекулярные углеводно-белковые соединения. Они образуют основную субстанцию межклеточного матрикса соединительной ткани. На долю протеогликанов приходится до 30% от сухой массы соединительной ткани. Полисахаридная группа протеогликанов сначала получила название мукополисахаридов. В дальнейшем эти соединения стали называть гликозаминогликанами. Это название и принято в настоящее время. Гликозаминогликаны (мукополисахариды) Гликозаминогликаны соединительной ткани – это линейные неразветвленные полимеры, построенные из повторяющихся дисахаридных единиц. В организме гликозаминогликаны не встречаются в свободном состоянии, т.е. в виде ≪чистых≫ углеводов. Они всегда связаны с большим или меньшим количеством белка. В их состав обязательно входят остатки мономера либо глюкозамина, либо галактозамина. Второй главный мономер дисахаридных единиц также представлен двумя разновидностями: D-глюкуроновой и L-идуроновой кислотами. В настоящее время четко расшифрована структура шести основных классов гликозаминогликанов. Гиалуроновая кислота впервые была обнаружена в стекловидном теле глаза. Из всех гликозаминогликанов гиалуроновая кислота имеет большую мол. массу (100000–10000000). Доля связанного с гиалуроновой кислотой белка в молекуле (частице) протеогликана составляет не более 1–2% от его общей массы. Считают, что основная функция гиалуроновой кислоты в соединительной ткани – связывание воды. В резу
 2015-04-30
2015-04-30 9994
9994







