Белки? — ВМС, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот, в состав входит 20 АК.
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка. Консервати?вные моти?вы — короткие последовательности нуклеотидов в ДНК или аминокислот в белке, которые сохраняются в процессе эволюции, поскольку эти нуклеотиды или аминокислоты незаменимы для выполнения каких-либо процессов в клетке.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. β- листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток) в первичной структуре аминокислотами или разными цепями белка.
|
|
|
Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи; гидрофильно-гидрофобные взаимодействия при взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура - (субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру.
АК состав белков, пептидная связь и ее физико-хим. хар-ка.
Основными частями и структурными компонентами белковой молекулы являются аминокислоты. В состав пищевых продуктов входит 20 аминокислот, из них 8 не синтезируются в организме человека и являются незаменимыми факторами питания(валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин, лизин). Для детей незаменимой аминокислотой является гистидин. Остальные аминокислоты являются заменимыми, т. е. могут синтезироваться в организме (аланин, аспарагиновая кислота, гликол, глицин, глютаминовая кислота, пролин, серии, тирозин, цистин, цистеин)
|
|
|
Потребность в заменимых аминокислотах удовлетворяется в основном за счет синтеза в организме и частично за счет поступления их в составе пищи. Для изучения аминокислотного состава белков пользуются сочетанием кислотного (НС1), щелочного [Ва(ОН)2] и, реже, ферментативного гидролиза. Гидрофобнае (неполярные, незаряженные): глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, триптофан. Гидрофильные (полярные, незаряженные): аспарагин, глутамин, серин, треонин, тирозин, цистеин. Гидрофильные (отр. заряд.): аспарагиновая, глутаминовая к-ты. Гидрофильные (пол. заряд.): лизин, аргинин, гистидин.
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу. Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, существующих в клетках (нейтральная среда, температура тела). В лабораторных условиях гидролиз пептидных связей белков проводят в запаянной ампуле с концентрированной (6 моль/л) соляной кислотой, при температуре более 105 °С, причём полный гидролиз белка до свободных аминокислот проходит примерно за сутки. В живых организмах пептидные связи в белках разрываются с помощью специальных протеолитических ферментов (от англ, protein - белок, lysis - разрушение), называемых также протеазами, или пептидгидролазами.
Цветные реакции на аминокислоты.
Нингидриновая реакция: цветная р-ция на a-аминокислоты, при нагревании (синее окрашивание).
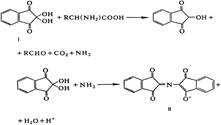
Ксантопротеиновая реакция, жёлтое окрашивание, при кипячении с концентрированной азотной кислотой. После добавления концентрированной щёлочи жёлтое окрашивание переходит в оранжевое. Ароматические АК (фенилаланина, тирозина и триптофана).
Р-ция Адамкевича, триптофан в кислой среде, взаимодействуя с альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
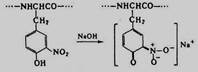
Р-ция Фоля, Аминокислоты, содержащие сульфгидрильные группы - SH, подвергаются щелочному гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и NaOH), образует осадок сульфида свинца PbS черного или бурого цвета.
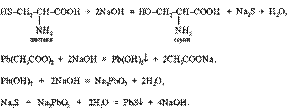
Р-ция Миллона, Это реакция на аминокислоту тирозин. Реактив Миллона (раствор HgNO3 и Hg(NO2)2 в разбавленной HNO3, содержащей примесь HNO2) взаимодействует с тирозином с образованием ртутной соли нитропроизводного тирозина, окрашенной в розовато-красный цвет.
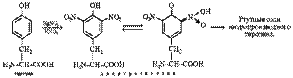
Зависимоть конформации белков от их первичной структуры.
В основе каждого белка лежит полипептидная цепь. Она не просто вытянута в пространстве, а организована в трехмерную структуру. Методом рентгеноструктурного анализа Полинг и Кори определили углы пептидных связей, доказав наличие жесткой, планарной(плоской) структуры полипептидной цепи. Несмотря на то что ее конформационная подвижность ограничена, подвижность вокруг одинарных связей при альфа- углеродном атоме возможна. Углы вращения одинарных связей называются торсионными: угол вращения вокруг связи N-C обозначают φ, угол вращения вокруг связи С-С – ψ. Заместители по отношению к пептидной связи могут находится в цис- или транс- положении, причем транс – пептидная связь более стабильна.
|
|
|
Конфигурация - жестко закрепленное ковалентными связями пространственное взаимное расположение частей молекулы (например: принадлежность к L-ряду стереоизомеров или к D-ряду). Для белков также используется понятие Конформация белковой молекулы - определенное, но не застывшее, не неизменное взаимное расположение частей молекулы. Так как конформация белковой молекулы формируется при участии слабых типов связей, то она является подвижной (способной к изменениям), и белок может изменять свою структуру. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят друг в друга. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие.
Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой молекулы. Это обратимые конформационные изменения (встречаются в организме, например, при проведении нервного импульса, при переносе кислорода гемоглобином). При изменении конформации часть слабых связей разрушается, и образуются новые связи слабого типа. Фибриллярные белки - это устойчивые, нерастворимые в воде и в разбавленных солевых растворах вещества. Располагаясь параллельно друг другу вдоль одной оси, полипептидные цепи образуют длинные волокна (фибриллы) или слои с конформацией b-структуры. Примеры фибриллярных белков: коллаген сухожилий и костной ткани, кератин волос, роговых образований, кожи, ногтей и перьев, эластин упругой соединительной ткани.
|
|
|
Глобулярные белки – это соединения, полипептидные цепи которых плотно свернуты в компактные сферические или глобулярные структуры с конформацией a-спирали. Большинство глобулярных белков растворимо в водных растворах и легко диффундирует. К ним относятся почти все известные в настоящее время ферменты, а также антитела, некоторые гормоны и многие белки, выполняющие транспортную функцию, например, сывороточный альбумин и гемоглобин. Некоторые белки принадлежат к промежуточному типу. Подобно фибриллярным белкам, они состоят из длинных, палочковидных структур, и в то же время они, как глобулярные белки, растворимы в водных солевых растворах. К таким белкам относятся: миозин - структурный элемент мышц, фибриноген - предшественник фибрина, участвующего в свертывании крови.
 2015-04-30
2015-04-30 15794
15794