| № п/п | Вопросы | |
| 1. | Раствор – это гомогенная система: 1. постоянного состава, состоящая из двух и более компонентов; 2. переменного состава, состоящая из двух компонентов 3. переменного состава, состоящая из двух и более компонентов. | |
| 2. | Растворитель – это компонент, агрегатное состояние которого при образовании раствора: 1. не изменяется; 2. изменяется; 3. концентрация которого больше; 4. концентрация которого меньше; 5. концентрация которого постоянна. | |
| 3. | Растворенное вещество – это компонент, агрегатное состояние которого при образовании раствора: 1. может не изменяться; 2. не изменяется; 3. концентрация которого в растворе больше; 4. концентрация которого в растворе меньше. | |
| 4. | Количество вещества (моль) в одном литре раствора - это 1. молярность; 2. моляльность; 3. титр; 4. нормальность; 5. мольная доля. | |
| 5. | Количество вещества (моль) в 1 кг растворителя 1. молярность; 2. моляльность; 3. титр; 4. массовая доля; 5. нормальность. | |
| 6. | Масса вещества в граммах, содержащаяся в 100 г раствора - это 1. молярность; 2. моляльность; 3. титр; 4. массовая доля; 5. нормальность. | |
| 7. | Масса вещества, содержащаяся в 1 мл. раствора - это 1. молярность; 2. моляльность; 3. титр; 4. массовая доля; 5. нормальность. | |
| 8. | Раствор, содержащий 0,89 % nacl означает, что 1. в 100 г раствора содержится 0,89 г NaCl; 2. в 100 мл раствора содержится 0,89 г NaCl; 3. в 1л раствора содержится 0,89 г NaCl; 4. в 1 кг растворителя содержится 0,89 г NaCl; 5. в любой массе раствора содержится 0,89 г NaCl. | |
| 9. | Раствор глюкозы с молярной концентрацией 3 моль/л означает, что 1. в 1 л раствора содержится 3 моль глюкозы; 2. в 100 мл раствора содержится 3 моль глюкозы; 3. в 1 кг раствора содержится 3 моль глюкозы; 4. в 100 г раствора содержится 3 моль глюкозы; 5. в 1 мл раствора содержится 0,3 моль глюкозы. | |
| 10. | Раствор h2so4 с молярной концентрацией эквивалента 0,25 н означает, что 1. в 1 л раствора содержится 0,25 моль H2SO4; 2. в 1 кг растворителя содержится 0,25 моль эквивалента H2SO4; 3. в 1 л раствора содержится 0,25 моль эквивалента H2SO4; 4. в 1 л растворителя содержится 0,25 моль H2SO4; 5. в 2 л раствора содержится 0,25 моль H2SO4 | |
| 11. | Фактор эквивалентности al(oh)3 в реакции al(oh)3 + 3hcl → … равен … 1. 1/3; 2. 1/2; 3. 1/6; 4. 2; 5. 3. | |
| 12. | Фактор эквивалентности h3po4 в реакции h3po4 + 3naoh → … равен … 1. 1/3; 2. 1/2; 3. 1/6; 4. 2; 5. 3. | |
| 13. | Фактор эквивалентности ca(oh)2 в реакции ca(oh)2 + 2hcl → … равен … 1. 1/3; 2. 1/2; 3. 1/6; 4. 2; 5. 3 | |
| 14. | Титриметрический анализ – это метод количественного анализа основанный на 1. точном измерении объема раствора определяемого вещества; 2. точном измерении объема раствора – титранта; 3. определении массы раствора реагента; 4. определении массы определяемого вещества; 5. определении плотности раствора. | |
| 15. | Основой титриметрического анализа является закон 1. сохранения массы; 2. кратных отношений; 3. эквивалентов; 4. постоянства состава; 5. Авогадро. | |
| 16. | Метод нейтрализации основан на реакции 1. кислотно-основного взаимодействия; 2. окислительно-восстановительной; 3. осаждения; 4. комплексообразования; 5. гидрирования | |
| 17. | Титрант – это 1. раствор реагента с точно известной концентрацией; 2. химически чистое вещество; 3. раствор реагента с неизвестной концентрацией; 4. смесь веществ; 5. растворитель. | |
| 18. | Скачок титрования – это 1. резкое изменение рН среды в области точки нейтральности; 2. изменение рН среды от добавления небольшой порции титранта; 3. изменение окраски индикатора от добавления небольшой порции титранта; 4. резкое изменение рН среды в области точки эквивалентности; 5. изменение окраски без добавления индикатора. | |
| 19. | Реакция, лежащая в основе алкалиметрии 1) Н++ОН-=Н2О; 2) 2Н++СО32-=Н2О+СО2; 3) MnO4-+8H+=Mn2++4H2O; 4) Ca2++CO32-=CaCO3; 5) Ba2++CO32-=BaCO3. | |
| 20. | Цвет универсального индикатора в кислой среде 1. красный; 2. желтый; 3. синий; 4. оранжевый; 5. фиолетовый | |
| 21. | Метод нейтрализации основан на реакции 1. замещения; 2. соединения; 3. обмена; 4. разложения; 5. экзотермической | |
| 22. | Среда, в которой фенолфталеин меняет окраску 1. кислая; 2. нейтральная; 3. сильнощелочная; 4. сильнокислая; 5. слабокислая. | |
| 23. | Коллигативные свойства - это 1. осмотическое давление; 2. давление; 3. температура; 4. ионная сила; 5. рН растворов | |
| 24. | Коллигативные свойства растворов зависят от 1. природы растворителя; 2. температуры; 3. числа частиц растворенного веществ; 4. давления | |
| 25. | Одностороннее движение молекул растворителя через полупроницаемую мембрану под действием разности концентраций - это 1. броуновское движение; 2. диффузия; 3. осмос; 4. хаотическое движение | |
| 26. | Растворы с одинаковым осмотическим давлением 1. изотонические; 2. гипертонические; 3. гипотонические; 4. насыщенные; 5. пересыщенные | |
| 27. | Изотонический коэффициент больше 1 для раствора 1. мочевина; 2. C2H5OH; 3. глюкоза; 4. сахароза; 5. Cu(NO3)2 | |
| 28. | Раствор nacl, изотоничный крови человека 1. 0,9%; 2. 1,1%; 3. 1,3%; 4. 1,5%; 5. 1,7% | |
| 29. | Осмотическое давление пропорционально 1. молярной концентрации; 2. моляльной концентрации; 3. молярной концентрации эквивалента; 4. молярной доле; 5. массовой доле | |
| 30. | Давление пара над раствором 1. увеличивается; 2. уменьшается; 3. не изменяется | |
| 31. | Температурой кипения жидкости является температура, при которой давление пара над ней становится 1. равным внешнему давлению; 2. больше внешнего давления; 3. меньше внешнего давления; 4. температура кипения не зависит от внешнего давления | |
| 32. | Повышение температуры кипения и понижение температуры замерзания раствора пропорционально 1. молярной концентрации; 2. молярной концентрации эквивалента; 3. моляльной концентрации; 4. молярной доле; 5. массовой доле | |
| 33. | Криоскопические и эбуллиоскопические.константы зависят от 1. природы растворителя; 2. температуры; 3. природы растворенного вещества; 4. концентрации; 5. давления. | |
| 34. | При помещении клеток в гипертонический раствор наблюдается 1. плазмолиз; 2. лизис; 3. гемолиз; 4. клетка не изменяется | |
| 35. | При помещении клеток в гипотонический раствор наблюдается 1. плазмолиз; 2. лизис; 3. гемолиз; 4. клетка не изменяется | |
| 36. | Закон Рауля 1. Pосм.=СRT; 2. (P0-P)P0=x 3. Δtкип.=ЕСm; 4. Δtкр.=КСm | |
| 37. | Сильный электролит: 1. H2SO4 (к.); 2. H2SO4 (p).; 3. CH3COOH; 4. HCOOH; 5. H3PO4 | |
| 38. | Закон вант-гоффа для неэлектролитов 1. Pосм=CmRT; 2. Pосм=CмRT; 3. Pосм=wRT; 4. Pосм=iCmRT; 5. Pосм=iCмRT | |
| 39. | Закон разведения оствальда 1. α=К/С; 2. α=К∙С; 3. α= 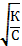 ; 4. α= ; 4. α= 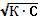 ; 5. α= С/К ; 5. α= С/К | |
| 40. | Реакция необратима 1. CuCl2+Na2SO4; 2. HCl+NaCl; 3. BaCl2+HNO3; 4. BaCl2+CH3COOH; 5. Cu(NO3)2+HCl | |
| 41. | Закон вант-гоффа для электролитов 1. Pосм=iCRT; 2. Pосм=CRT; 3. Pосм=iwRT; 4. Pосм=C/RT; 5. Pосм=CmRT | |
| 42. | Слабые электролиты 1. α>40%; 2. α>30%; 3. α>3%; 4. α<3%; 5. α>50% | |
| 43. | Сокращенное ионное уравнение H++OH¯→H2O соответствует реакции 1. HCl+Al(OH)3; 2. HCl+Na2CO3; 3. HCl+NaHCO3; 4. HCl+Cu(OH)2; 5. HCl+NaOH | |
| 44. | Ионная сила раствора рассчитывается по формуле 1. I=  (С1 (С1 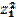 + C2 + C2 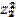 +…); 2. I= +…); 2. I=  (С1 (С1 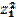 + C2 + C2 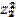 +…); 3. I= +…); 3. I=  (ω1 (ω1 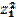 + ω2 + ω2 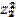 +…); 4. I= α(С1 +…); 4. I= α(С1 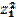 + C2 + C2 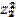 +…); 5. I=С1 +…); 5. I=С1 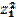 + C2 + C2 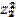 +…; +…; | |
| 45. | Плазмолиз не вызывают растворы 1. насыщенные; 2. ненасыщенные; 3. изотонические; 4. гипотонические; 5. гипертонические | |
| 46. | Доля молекул электролита, распавшихся на ионы 1. мольная доля; 2. степень диссоциации; 3. степень гидролиза; 4. константа диссоциации; 5. константа гидролиза | |
| 47. | При разбавлении раствора степень диссоциации 1) уменьшается; 2) не изменяется; 3) увеличивается | |
| 48. | Ионное произведение воды при 25°с 1) 10–7; 2) 10–10; 3) 10–12; 4) 10–14; 5) 10–16. | |
| 49. | Общая кислотность – это концентрация ионов н+ 1. свободных в растворе; 2. связанных в недиссоциируемых молекулах; 3. свободных в растворе и связанных в недиссоциируемых молекулах | |
| 50. | Потенциальная кислотность – это концентрация ионов н+ 1. свободных в растворе; 2. связанных в недиссоциируемых молекулах; 3. свободных в растворе и связанных в недиссоциируемых молекулах | |
| 51. | Активная кислотность – это концентрация ионов н+ 1. свободных в растворе; 2. связанных в недиссоциируемых молекулах; 3. свободных в растворе и связанных в недиссоциируемых молекулах | |
| 52. | рН раствора - это 1. натуральный логарифм активной концентрации ионов водорода; 2. десятичный логарифм активной концентрации ионов водорода; 3. отрицательный натуральный логарифм активной концентрации ионов водорода; 4. отрицательный десятичный логарифм активной концентрации ионов водорода; 5. отрицательный десятичный логарифм общей кислотности. | |
| 53. | рН = 7 в растворе 1. NaNO3; 2. CaSO4; 3. Sr(NO3)3; 4. K2CO3; 5. Na2SO3 | |
| 54. | рН > 7 в растворах солей 1. Na NO3; 2. Ca(NO3)2; 3. K2SiO3; 4. Na2SO4; 5. K2SO4 | |
| 55. | Константа гидролиза буры (na2b4o7) рассчитывается по формуле 1. К=Кводы / Ккисл; 2. К=Кводы / Ккисл *Косн; 3. К=Кводы / Косн | |
| 56. | Константа гидролиза ацетата аммония рассчитывается по формуле 1. К=Кводы / Ккисл; 2. К=Кводы / Ккисл *Косн; 3. К=Кводы / Косн | |
| 57. | Соль, гидролизующаяся и по катиону, и по аниону 1. Al2S3; 2. KCl; 3. Na2CO3; 4. K2 SiO3; 5. NH4Cl | |
| 58. | Степень гидролиза alcl3 при подкислении 1. уменьшается; 2. увеличивается; 3. не изменяется; 4. сначала увеличивается, затем уменьшается; 5. сначала уменьшается, затем увеличивается | |
| 59. | Кислота льюиса (акцептор электронов): 1. Cl–; 2. AlCl3; 3. I–-; 4. NH3; 5. Br– | |
| 60. | Степень гидролиза с увеличением температуры: 1. уменьшается, т.к. гидролиз – эндотермический процесс; 2. увеличивается, т.к. гидролиз – эндотермический процесс; 3. уменьшается, т.к. гидролиз – экзотермический процесс; 4. увеличивается, т.к. гидролиз – экзотермический процесс | |
| 61. | При гидролизе молекулы выступают согласно протолитической теории 1. как кислоты; 2. как основания; 3. как кислоты или как основания | |
| 62. | Степень гидролиза при уменьшении концентрации соли 1. уменьшается; 2. увеличивается; 3. не изменяется | |
| 63. | Гетерогенное равновесие создается при соприкосновении твердой фазы с раствором 1. ненасыщенным; 2. насыщенным; 3. пересыщенным; 4. разбавленным; 5. концентрированным | |
| 64. | Раствор пересыщен, если 1. ИП>ПР; 2. ИП=ПР; 3. ИП<ПР; 4. ИП=2ПР; 5. 2ИП=ПР | |
| 65. | Раствор насыщен, если 1. ИП>ПР; 2. ИП=ПР; 3. ИП<ПР; 4. ИП=2ПР; 5. 2ИП=ПР | |
| 66. | Пр = s2 для вещества 1. AgCl; 2. Ag2SО4; 3. Ag2CrO4; 4. Ag2S; 5. AgNO3 | |
| 67. | С увеличением температуры произведение растворимости(пр) 1. увеличивается; 2. уменьшается; 3. не изменяется; 4. увеличивается в 10 раз; 5. уменьшается в 10 раз | |
| 68. | Из перечисленных растворов первой выпадает соль 1. PbSO4 (ПР = 1,6 * 10-8); 2. SrSO4 (ПР = 3,2 * 10-7); 3. CaSO4 (ПР = 1,3 * 10-4); 4. BaSO4 (ПР = 1,1 * 10-10) | |
| 69. | При рентгеноскопии желудка используют суспензию 1. CaSO4; 2. SrSO4; 3. BaSO4; 4. MgSO4; 5. CaSO4 | |
| Способность сходных по свойствам веществ образовывать смешанные кристаллы - это 1. гомеостаз; 2. седиментация; 3. изоморфизм; 4. коагуляция | ||
| 71. | Радиоактивный sr90 опасен, так как замещает в костной ткани атомы 1. Ca; 2. P; 3. O; 4. H | |
| 72. | Растворы, рн которых сохраняется примерно постоянным при разбавлении и добавлении небольших количеств кислот или оснований 1. сопряженные; 2. буферные; 3. разбавленные; 4. концентрированные; 5. нейтральные | |
| 73. | Значение рн буферных растворов при разбавлении 1. не изменяется; 2. увеличивается на 1; 3. уменьшается на 1; 4. увеличивается на 2; 5. уменьшается на 2 | |
| 74. | Максимальную буферную емкость системы имеют при 1. рН=рК; 2. рН=рОН; 3. рН>рК; 4. рН<рК; эти параметры не связаны между собой | |
| 75. | Максимальной буферной емкостью при физиологическом значении рн обладает пара 1. H3PO4|H2P 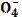 , pK=2,1; 2. H2PO4|HP , pK=2,1; 2. H2PO4|HP 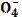 , pK=6,8; 3. HPO42-|P , pK=6,8; 3. HPO42-|P 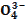 , pK=12,3; 4. HCOO-|HCOOH, pK=3,74; 5. CH3COO-|CH3COOH, pK=4,74; , pK=12,3; 4. HCOO-|HCOOH, pK=3,74; 5. CH3COO-|CH3COOH, pK=4,74; | |
| 76. | Буферные системы поддерживают в организме равновесия 1. кислотно-основные; 2. окислительно-восстановительные; 3. гетерогенные; 4. лигандообменные; 5. кислотно-солевые | |
| 77. | В организме имеет место равновесие h+ + hco-3 ↔ h2co3 ↔ h2o + co2 (плазма) ↔ co2 (легкие). гиповентиляция легких приводит 1. к увеличению щелочного резерва крови; 2. к уменьшению рОН мочи; 3. к уменьшению щелочного резерва крови; 4. к увеличению рН мочи; 5. рН мочи не изменяется | |
| 78. | Бронхит приводит к увеличению содержания co2 в лёгких, наблюдается 1. дыхательный ацидоз; 2. уменьшение рОН; 3. рН не изменяется; 4. дыхательный алкалоз 5. метаболический алкалоз | |
| 79. | Фосфатная буферная система действует 1. в плазме крови; 2. в лейкоцитах; 3. в моче; 4. в селезенке | |
| 80. | Гемоглобиновая буферная система действует 1. в плазме крови; 2. в эритроцитах; 3. в лейкоцитах; 4. в печени; 5. в кишечном тракте | |
| 81. | 75% буферной емкости крови обеспечивается буфером 1. бикарбонатным; 2. ацетатным; 3. фосфатным; 4. белковым; 5. гемоглобиновым | |
| 82. | Формула для расчета рн буферных систем i типа 1. рН=–lg [H+]; 2. pH=pK+lg 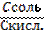 ; 3. pH=14–pK–lg ; 3. pH=14–pK–lg  ; 4. рН=–ln [H+]; 5. pH=pK–lg ; 4. рН=–ln [H+]; 5. pH=pK–lg  | |
| 83. | Количество кислоты или щелочи, добавление которого к 1 л буферного раствора изменяет рн на единицу – это 1. молярность; 2. моляльность; 3. буферная емкость; 4. молярная концентрация эквивалента | |
| 84. | Буферная система: 1. NH3·H2O и NH4Cl; 2. NH4Cl и HCl; 3. NH3·H2O и NaOH; 4. C6H5COOH и HCl; 5. HCOOH и HCl | |
| 85. | рН буферной системы при разбавлении в 10 раз 1. увеличится в 10 раз; 2. увеличится на единицу; 3. уменьшится на единицу; 4. практически не изменится; 5. уменьшится в 10 раз | |
| 86. | Уравнение гендерсона-гассельбаха для буферных систем 2 типа 1. pH=pK+lg  ; 2. pH=14–pK–lg ; 2. pH=14–pK–lg  ; 3. рН=рК±1; 4. pH=pK–lg ; 3. рН=рК±1; 4. pH=pK–lg 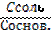 5. pH=14–pK+lg 5. pH=14–pK+lg 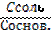 ; ; | |
| 87. | Максимальная буферная емкость наблюдается при соотношении ссопр.осн.: скисл. 1. 1:1; 2. 1:10; 3. 10:1; 4. 5:10; 5. 1:2 | |
| 88. | Наиболее быстродействующей в организме является буферная система 1. фосфатная; 2. гидрокарбонатная; 3. гидрофосфатная; 4. гемоглобиновая; 5. белковая | |
| 89. | Формула для расчета буферной емкости по кислоте 1. Вк=; 2. Вк= 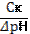 ; 3. Вк= ; 3. Вк= 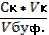 ; 4. Вк= ; 4. Вк= 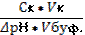 ; 5. Вк= ; 5. Вк= 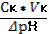 | |
| 90. | При заболеваниях, связанных с нарушением дыхательной функции легких, приводящим к увеличению содержания со2 в легких, наблюдается 1. дыхательный ацидоз; 2. рН не изменяется; 3. дыхательный алкалоз; 4. метаболический алкалоз; 5. метаболический ацидоз. | |
| 91. | У больных сахарным диабетом за счет накопления в организме β-гидроксимасляной кислоты развивается 1. метаболический алкалоз; 2. респираторный алкалоз; 3. метаболический ацидоз; 4. респираторный ацидоз; 5. рН не изменяется. | |
| 92. | Система, которая не обменивается ни веществом, ни энергией с окружающей средой 1. закрытая; 2. открытая; 3. изолированная; 4. равновесная; 5. стационарная | |
| 93. | Система, которая не обменивается веществом, но обменивается энергией с окружающей средой 1. закрытая; 2. открытая; 3. изолированная; 4. равновесная; 5. стационарная | |
| 94. | Система, обменивающаяся и веществом и энергией 1. закрытая; 2. открытая; 3. изолированная; 4. равновесная; 5. стационарная | |
| 95. | Реакция, тепловой эффект которой равен теплоте образования глюкозы 1. 6С + 6H2 + 3O2 = C6H12O6; 2. 6СO2 + 6H2O = C6H12O6 + 6O2; 3. 6С + 6H2O = C6H12O6; 4. С12 H22O11 + H2O = C6H12O6 + C6H12O6 | |
| 96. | При растворении твердых веществ энтропия 1. убывает; 2. возрастает; 3. не изменяется | |
| 97. | Энтропия при кариесе 1. убывает; 2. возрастает; 3. не изменяется | |
| 98. | Критерий самопроизвольно протекающих процессов 1. энтальпия 2. энергия Гиббса 3. энтропия 4. внутренняя энергия | |
| 99. | Направления протекания реакции h3po4 + аденозин = амф + H2O, ∆ G0 = 14 кДж/моль 1. прямое; 2. обратное; 3. реакция находится в состоянии равновесия; 4. любое; 5. требуются дополнительные условия | |
| 100. | Реакция экзотермическая, если 1. DН>0; 2. DН=0; 3. DН<0; 4. DG>0; 5. DG<0 | |
| Энтальпия образования равна 0: 1. O2; 2. H2O; 3. NaCl; 4. CH4; 5. HCl | ||
| Энтропия увеличивается в реакции: 1. 2H2+O2=2H2O; 2. 4HCl+O2=2Cl2+2H2O; 3. CaO+CO2=CaCO3; 4. NH4NO2=N2+2H2O; 5. BaO+SO3=BaSO4 | ||
| Тепловой эффект процесса не зависит от пути процесса, а определяется начальным и конечным состоянием системы – это закон 1. Клайперона; 2. Гесса; 3. Фика; 4. Дальтона | ||
| Экзергонический процесс, если 1. DG>0; 2. DG<0; 3. DG=0; 4. DH>0; 5. DH<0 | ||
| Закон, лежащий в основе расчетов калорийности продуктов питания: 1. Вант-Гоффа; 2. Гесса; 3. Сеченова; 4. Рауля; 5. Клайперона | ||
| 106. | Для обратимых процессов: 1. DG<0; 2. DG>0; 3. DG=0; | |
| 107. | Эндэргонические реакции в организме требуют подвода энергии, так как 1. DG>0; 2. DG<0; 3. DG=0; 4. DG£0 | |
| 108. | При гидролизе любого пептида Dh<0, Ds>0, протекает ли процесс самопроизвольно? 1. да, т.к. DG>0; 2. нет, т.к. DG>0; 3. да, т.к. DG<0; 4. нет, т.к. DG<0 | |
| 109. | Для процесса фотосинтеза Dh>0, Ds<0, протекает ли процесс самопроизвольно? 1. процесс неосуществим при любых температурах; 2. процесс осуществим при любых температурах; 3. процесс осуществим при высоких температурах; 4. процесс осуществим при низких температурах | |
| 110. | Изменение концентрации вещества за единицу времени это 1. константа скорости; 2. энергия активации; 3. скорость реакции; 4. константа равновесия | |
| 111. | Размерность скорости химических реакций 1. моль/л*с; 2. км/час; 3. кДж/моль; 4. с-1 | |
| 112. | Число молекул, участвующих в элементарном акте химического взаимодействия 1. порядок реакции; 2. скорость реакции; 3. молекулярность реакции; 4. стехиометрия | |
| 113. | Время, за которое прореагирует половина вещества – это 1. ПЕРИОД ПОЛУПРЕВРАЩЕНИЯ; 2. ПОРЯДОК РЕАКЦИИ; 3. КОНСТАНТА СКОРОСТИ; 4. КОНСТАНТА РАВНОВЕСИЯ | |
| 114. | Молекулярность элементарной реакции 2NO + O2 = 2NO2 1. 0; 2. 1; 3. 2; 4. 3 | |
| 115. | Закон действующих масс устанавливает зависимость между скоростью химической реакции и 1. температурой; 2. концентрацией реагирующих веществ; 3. массой реагирующих веществ; 4. количеством реагирующих веществ; 5. количеством продуктов реакции | |
| 116. | Сумма показателей степеней при концентрациях, входящих в кинетическое уравнение называется 1. общим кинетическим порядком реакции; 2. молекулятностью реакции; 3. порядком реакции по веществу; 4. стехиометрическими коэффициентами; 5. константой скорости реакции | |
| 117. | Биохимические реакции, протекающие в организме, являются реакциями 1. 1 порядка; 2. 0 порядка; 3. 1 порядка, переходящие в реакции 0 порядка; 4. 2 порядка, переходящие в реакции 1 порядка; 5. обратимыми | |
| 118. | Лимитирующая стадия сложной химической реакции является 1. самой быстрой; 2. самой медленной; 3. самой сложной; 4. стадией, имеющей высокую энергию активации; 5. стадией, имеющей первый порядок | |
| 119. | Выход мочевины при увеличении давления CO2 + 2NH3 ↔ H2O + CO(NH2)2 1. увеличится; 2. уменьшится; 3. не изменится | |
| 120. | ∆G0 = - RTlnK это уравнение 1. изотермы; 2. изобары; 3. изохоры химической реакции | |
| Константа равновесия при 298 К равна 1, тогда ∆G 1. ∆G < 0 2. ∆G = 0 3. ∆G > 0 | ||
| 122. | Соотношение, при котором система находится в состоянии равновесия 1. DH=–TDS; 2. DH>–TDS; 3. DH<–TDS; 4. DH=TDS; 5. DH=DS | |
| 123. | Выход продукта реакции 2so2+o2«2so3 уменьшит 1. увеличение концентрации О2; 2. увеличение концентрации SO2; 3. увеличение давления; 4. уменьшение температуры | |
| 124. | Константа скорости реакции зависит от: 1. времени реакции, температуры, катализатора; 2. природы веществ, температуры; концентрации; 3. природы веществ, температуры, катализатора; 4. природы веществ, температуры. | |
| 125. | Константа равновесия изменится при: 1. введении катализатора; 2. изменении концентраций; 3. повышении температуры; 4. понижении температуры. | |
| 126. | При изменении количества вещества а скорость не изменится для реакции: 1. А(г)+В(г)® 2. 2А(г)+В2(г)® 3. 2А(г)+2В(г)® 4. 3А(г)+В2(г)® | |
| 127. | Соотношение между равновесными концентрациями определяет закон: 1. Вант-Гоффа; 2. Рауля; 3. действующих масс; 4. Гесса | |
| 128. | Соединение постоянного состава, образованные с участием донорно – акцепторных связей 1. комплексные; 2. двойные; 3. смешанные; 4. бинарные; 5. кластерные | |
| 129. | Число ионов или молекул, расположенных вокруг центрального атома 1. дентантность; 2. координационное число; 3. заряд ядра; 4. заряд катиона; 5. заряд аниона | |
| 130. | Комплексообразователь в гемоглобине 1. Cu0; 2. Fe3+; 3. Fe0; 4. Fe2+; 5. Mg2+ | |
| 131. | Связь между комплексообразователем и лигандами 1. ковалентная по донорно – акцепторному механизму; 2. ковалентная по обменному механизму; 3. ионная; 4. водородная; 5. атомная | |
| 132. | Дентантность – это 1. число связей между комплексообразователем и лигандами; 2. число электронодонорных атомов в лиганде; 3. заряд коплексообразователя; 4. заряд комплексного иона; 5. число лигандов | |
| 133. | В хелатные соединения входят лиганды 1. монодентантные; 2. полидентантные; 3. нейтральные; 4. положительно заряженные | |
| 134. | Название Na [Co(NH3)2 (N02)4] 1. диамминкобальтат натрия; 2. тетранетрокобальтат натрия; 3. диамминтетранитрокобальтат (II) натрия; 4. диамминтетранитрокобальтат (III) натрия; 5. диамминтетранитрокобальтат натрия | |
| 135. | Число моль ионов, образующихся при первичной диссоциации одного моля гексацианоферрата (ii) калия 1. 1; 2. 2; 3. 3; 4. 4; 5. 5 | |
| 136. | Степень окисления комплексообразователя в соединении [Pt(NH3)5B]r(N03)3 1. +1; 2. +2; 3. +3; 4. +4; 5. +6 | |
| 137. | Координационное число комплексообразователя в комплексе Na3[Co(СN)6] равно 1. 3; 2. 2; 3. 6; 4. 9; 5. 4 | |
| 138. | Комплексообразователь в хлорофилле: 1. Сu0; 2. Cu2+; 3. Fe3+ ; 4. Fe2+ | |
| 139. | Лиганды-это 1. молекулы, доноры электронных пар; 2. ионы, акцепторы электронных пар; 3. молекулы и ионы-акцепторы электронных пар; 4. молекулы и ионы-доноры электронных пар | |
| 140. | Координационное число центрального атома и его заряд в соединении [Pt(NH3)4Cl2]Cl2 1. 6,+4; 2. 6,+2; 3. 4,+4; 4. 4,+2 5. 6, +2 | |
| 141. | Чем меньше кн., тем комплекс более: 1. устойчивый; 2. устойчивость не определяется Кн, 3. неустойчивый; 4. растворимый. | |
| 142. | Заряд внутренней сферы в соединении К4[Fe(CN)6]: 1. +4; 2. –4; 3. –3; 4. –2. 5. +3 | |
| 143. | Координационное число центрального атома и его заряд в соединении [Co(NH3)3Cl3]: 1. 6,+3; 2. 4,+3; 3. 6,+2; 4. 4,+3; 5. 6; +2 | |
| 144. | Устойчивость комплекса с увеличением числа донорных атомов в полидентантном лиганде: 1. увеличивается; 2. уменьшается; 3. не изменяется | |
| 145. | Соединение, которое не подвергается первичной диссоциации 1. K2[PtCl6]; 2. [Co(NH3)6]Cl3; 3. [Pt(NH3)2Cl2]; 4. [Ag(NH3)2]OH; 5. К3[Fe(CN)6]: | |
| 146. | Лучший комплексообразователь из: Na, Mg, Co,Al 1. Na; 2. Mg; 3. Co; 4. Al | |
| 147. | Связь между комплексообразователем и лигандами: 1. ковалентная по донорно-акцепторному механизму 2. ковалентная по обменному механизму 3. ионная 4. водородная | |
| 148. | Координационное число центрального атома и его заряд в соединении [Cr(NH3)2Cl2] 1. 4,+2; 2. 6,+3; 3. 2,+2; 4. 6,+2 5. 6, +4 | |
| 149. | Степень окисления и тип гибридизации центрального атома в соединении [Ag(NH3)2]Cl: 1. +1,sp; 2. +1,sp2; 3. +2,sp; 4. 0,sp; 5. 0,sp2 | |
| 150. | Наименьшая комплексообразующая способность у: 1. s-элементов; 2. p-элементов; 3. d-элементов; 4. f-элементов | |
| 151. | Наиболее прочный ион: 1. Кн [Zn(OH)4 ]2- =1,99·10-18 ; 2. Кн [Zn(CN)4]2- =2,4 ·10-20; 3. Кн [Zn(NH3)4]2+ =8,3 ·10-12; 4. Кн [Zn(H2O)4]2+ =2,1 ·10-10 | |
| 152. | Комплексообразователь в молекуле витамина В12: 1. Fe+2; 2. Co+2; 3. Ni+2; 4. Mg+2 | |
| 153. | Ряд, в котором способность к комплексообразованию увеличивается 1. f>d>p>s 2. d>f>p>s 3. s>p>d>f 4. p>s>d>f | |
| 154. | Поверхностно – активные вещества по отношению к воде 1. этанол; 2. хлорид натрия; 3. фруктоза; 4. сахароза; 5. глюкоза | |
| 155. | Вещества, понижающие поверхностное натяжение растворителя 1. Активаторы; 2. Поверхностно – неактивные; 3. Поверхностно – активные | |
| 156. | Поверхностная активность пав с увеличением углеводородного радикала 1. увеличивается; 2. уменьшается; 3. не изменяется | |
| 157. | Самопроизвольное увеличение концентрации растворенного вещества на границе раздела фаз по сравнению с объемной концентрацией 1. абсорбция; 2. адгезия; 3. адсорбция; 4. возгонка | |
| 158. | Поверхностное натяжение воды при добавлении спирта C2H5OН 1. увеличится; 2. уменьшится; 3. не изменится | |
| 159. | Адсорбент, поглощающий из раствора катионы, выделяя одновременно в раствор эквивалентное количество катионов другого рода 1. анионит; 2. катионит; 3. мембрана | |
| 160. | Вещество, на поверхности которого происходит адсорбция, называется 1. адсорбатом; 2. адсорбентом; 3. десорбцией | |
| 161. | Системы, состоящие из твердой дисперсной фазы и жидкой дисперсионной среды 1. аэрозоли; 2. лиозоли; 3. криозоли; 4. пены; 5. суспензия | |
| 162. | Движения дисперсионной среды в постоянном электрическом поле к противоположно заряженному электроду – это 1. электроосмос; 2. электрофорез; 3. потенциал течения | |
| В крови дисперсионной среды является 1. вода; 2. эритроциты; 3. кислород; 4. СО2 | ||
| 164. | Поглощение вещества всей массой адсорбента: 1. адсорбция; 2. абсорбция; 3. сорбция; 4. десорбция | |
| 165. | Пермутит (Na2O·Al2O3·SiO2·H2O), используемый для умягчения воды обменивает на ионы Са2+: 1. Na+; 2. Al3+ ; 3. Si4+ ; 4. различные ионы. | |
| 166. | Единицы измерения поверхностного натяжения: 1. н/м; Дж/м2; 2. н/м2; Дж/м; 3. Дж/моль·К; 4. Дж/м; Дж/м2 | |
| 167. | Из ионов: К+, Ca2+, Al3+ минимальной адсорбционной способностью обладает: 1. К+ ; 2. Ca2+ ; 3. Al3+; 4. адсорбционная способность одинакова. | |
| 168. | Изотерма адсорбции фрейндлиха: 1. Г= Г∞ С / I+αС; 2. Г=κ ·С; 3. х/ m = κ·С1|n ; 4. Г=ΔС·V/ m | |
| 169. | Из ионов одинакового заряда минимальную адсорбционную способность проявляют ионы: 1. наибольшего радиуса; 2. величина радиуса не имеет значения; 3. наименьшего радиуса. | |
| 170. | Поверхностое натяжение жидкостей с повышением температуры 1. увеличивается; 2. уменьшается; 3. не изменяется; 4. изменяется неоднозначно. | |
| 171. | Изотерма адсорбции Лэнгмюра: 1. Г= Г∞ С / I+αС; 2. Г=κ ·С; 3. х/ m = κ·С1|n ; 4. Г=ΔС·V/ m. | |
| 172. | Активированный уголь- гидрофобный сорбент и лучше адсорбирует: 1. полярные вещества из неполярных растворителей; 2. неполярные вещества из полярных растворителей; 3. полярные вещества из полярных растворителей; 4. неполярные вещества из неполярных растворителей. | |
| 173. | К ПНВ относятся: 1. сахароза; 2. фосфолипиды; 3. желчные кислоты; 4. белки. | |
| 174. | Поверхностная активность бутанола больше поверхностной активности этанола в 1. 4 раза; 2. 6 раз; 3. 9 раз; 4. 12 раз; 5. 15 раз | |
| 175. | Метод очистки коллоидных растворов и растворов вмс с помощью мембран, по принципу которого работает «искусственная почка» 1. хроматография; 2. фильтрация; 3. диализ | |
| 176. | Оптическое свойство всех коллоидных растворов 1. отражение света; 2. рассеяние света; 3. поглощение света | |
| 177. | Движения частиц дисперсной фазы в постоянном электрическом поле к противоположно заряженному электроду 1. диализ; 2. электроосмос; 3. электрофорез | |
| 178. | Устойчивость, характеризующая способность системы сохранять постоянным размер частиц 1. кинетическая; 2. агрегативная; 3. оптическая | |
| 179. | Укрупнение коллоидных частиц за счет их слипания седиментацией 1. коагуляция; 2. опалесценция; 3. солюбилизация | |
| 180. | Значения рн раствора белка, при котором молекула становится электронейтральной 1. золотое число; 2. изоэлектическая точка; 3. критическое | |
| 181. | Проникновение растворителя в полимерное вещество, приводящее к увеличению массы и объема образца 1. набухание; 2. седиментация; 3. высаливание | |
| 182. | Максимальная коагулирующая способность у иона 1. Сl- 2. SO42- 3. PO43- 4. [Fe(СN)6]4- | |
| 183. | Колларгол – это 70% золь серебра, стабилизированный 1. белками; 2. порошком угля; 3. силикагелем | |
| 184. | Мыла, синтетические моющие средства, фосфолипиды 1. пептизаторы; 2. электролиты; 3. коллоидные ПАВ | |
| 185. | Коагуляция, невидимая невооруженным взглядом 1. скрытая; 2. явная; 3. медленная; 4. быстрая | |
| 186. | Размер коллоидных частиц: 1. менее 10-9м; 2. 10-9 – 10-7м; 3. более 10-7м; 4. 10-5 – 10-7м. | |
| 187. | Дисперсная система, состоящая из твердой дисперсной фазы и жидкой дисперсной среды: 1. эмульсия; 2. пена; 3. аэрозоль; 4. суспензия | |
| 188. | Рассеивание света в коллоидных системах и наблюдающееся при этом изменение окраски: 1. эффект Тиндаля; 2. диффузия; 3. седиментация; 4. опалесценция. | |
| 189. | Дисперсная система, состоящая из жидкой дисперсной фазы и жидкой дисперсионной среды: 1. эмульсия; 2. пена; 3. аэрозоль; 4. суспензия. | |
| 190. | Коагулирующие действие электролита определяется правилом: 1. Панета – Фаянса; 2. Шульце – Гарди; 3. Ребиндера; 4. Шилова. | |
| 191. | Дисперсная система состоящая из газообразной дисперсной фазы и жидкой дисперсионной среды: 1. эмульсия; 2. пена; 3. аэрозоль; 4. суспензия. | |
| 192. | Ионы, первыми адсорбирующиеся на поверхности агрегата: 1. потенциалопределяющие; 2. диффузный слой; 3. противоионы; 4. катионы. | |
| 193. | Седиментация – это: 1. оседание частиц; 2. укрупнение частиц; 3. отталкивание частиц; 4. диссоциация частиц. | |
| 194. | Дисперсная система, состоящая из жидкой дисперсной фазы и газообразной дисперсной среды: 1. эмульсия; 2. пена; 3. аэрозоль; 4. суспензия. | |
| 195. | Синтетический полимер: 1. целлюлоза; 2. крахмал; 3. ДНК; 4. полиметилакрилат. | |
| 196. | Значение рн раствора белка, при котором молекула становится электронейтральной: 1. золотое число; 2. порог коагуляции; 3. изоэлектрическая точка; 4. ККМ. | |
| 197. | Уравнение галлера: 1. [η]=KM2; 2. Pосм.=СRT; 3. Росм.=(С/М) ·RT+КС2; 4. α = mm0/m0·100% | |
| 198. | При синерезисе объем студня: 1. уменьшается; 2. увеличивается; 3. не изменяется. | |
| 199. | При денатурации белков разрываются связи: 1. ковалентные; 2. водородные; 3. ионные; 4. пептидные. | |
| 200. | [η]=KM2 1. степень набухания; 2. уравнение Штаудингера; 3. уравнение Галлера; 4. Уравнение Клайперона. | |
| 201. | Слияние водных оболочек нескольких частиц вмс без объединения самих частиц: 1. желатинирование; 2. синерезис; 3. коацервация; 4. тиксотропия | |
| 202. | Осаждение вмс из раствора под действием электролитов: 1. высаливание; 2. тиксотропия; 3. коацервация; 4. синерезис. | |
| 203. | При набухании масса полимера: 1. не изменяется; 2. увеличивается; 3. уменьшается; 4. зависит от полимера. | |
| 204. | Анион, способствующий наибольшей степени набухания белков: 1. Сl- ; 2. NO3- ; 3. SO42-; 4. CNS-. | |
| 205. | Потеря раствором вмс текучести и переход в студень – это: 1. желатинирование; 2. тиксотропия; 3. синерезис; 4. коацервация. | |
| 206. | Наиболее вероятная форма молекулы вмс вследствие теплового движения звеньев: 1. глобула; 2. спираль; 3. палочка; 4. нить. | |
| 207. | Процесс отделения низкомолекулярного растворителя из студня: 1. застудневание 2. синерезис; 3. тиксотропия; 4. денатурация. | |
| 208. | Молярная маса вмс лежит в пределах 1. 104–106; 2. 102–104; 3. 103–107; 4. 106–108 | |
| 209. | Пластификация полимера – это: 1. повышение гибкости при нагревании; 2. повышение пластичности при нагревании; 3. повышение пластичности при добавлении НМС; 4. понижение пластичности при понижении температуры. | |
| 210. | Степень набухания полимера 1. a= 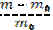 ; 2. a= ; 2. a= 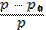 ; 3. a= ; 3. a= 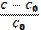 ; ; | |
| 211. | При набухании полимера: 1. DG>0; 2. DG=0; 3. DG<0; 4. DS=0 | |
| 212. | Степень набухания белка минимальна в: 1. изоэлектрической точке; 2. нейтральной точке; 3. точке эквивалентности | |
| 213. | НСООН относится к классу 1. спиртов; 2. кислот; 3. аминов; 4. альдегидов | |
| 214. | Фенилацетат: 1. С6Н5ОСН3 2. НСООС6Н5 3. СН3СООС6Н5 4. С6Н5СООН | |
| 215. | Тип сопряжения в молекуле пиридина: 1. р,p 2. p,p 3. р,р 4. p,р | |
| 216. | Функциональные группы расположены по убыванию старшинства в ряду: А) –SH; Б) >С=O; В) –СООН; Г) –ОН 1. в, б, г, а 2. а, в, г, а 3. б, в, г, а 4. в, б, а, г | |
| 217. | Ароматическое соединение: 1. циклогексан; 2. циклопентан; 3. циклоооктан; 4. пиридин | |
| 218. | Фениламин: 1. C6H5NH2; 2. C6H5NO2; 3. C6H5OCH3; 4. C2H4NH2 | |
| 219. | Тип сопряжения в молекуле амида уксусной кислоты: 1. p,p 2. p,p 3. p,p | |
| 220. | Ароматическое соединение 1. пирролидин; 2. пиррол; 3. пиперидин; 4. циклогексан | |
| 221. | С6Н5–О–СН3 относится к классу: 1. спиртов; 2. фенолов; 3. простых эфиров; 4. сложных эфиров | |
| 222. | Метилбензоат 1. С6Н5ОСН3; 2. С6Н5ОС2Н5; 3. С6Н5СООСН3; 4. С6Н5СООС2Н5 | |
| 223. | Тип сопряжения в молекуле пиррола: 1. р,p 2. p,p 3. р,р; 4. p,р | |
| 224. | Тринитроглицерин относится к классу: 1. нитросоединений; 2. простых эфиров; 3. сложных эфиров; 4. ацеталей | |
| 225. | Амид уксусной кислоты: 1. HCOONH4; 2. C2H5NO2; 3. CH3C(O)NH2; 4. CH3COONH4 | |
| 226. | Ароматическое соединение 1. циклогексан; 2. циклогексанол; 3. стирол; 4. пиперидин | |
| 227. | Простой эфир 1. С2Н5ОН; 2. СН3NН2; 3. СН3СООС2Н5; 4. СН3ОСН3; 5. СН3СООН | |
| 228. | Сложный эфир 1. СН3ОС3Н7; 2. СН3СООН; 3. С6Н5СООС2Н5; 4. С2Н5ОН; 5. С6Н5ОН | |
| 229. | Соединение СН3СН(СН3)ОС2Н5 1. 2- этоксипропан; 2. пропилэтиловый эфир; 3. пентанол – 3; 4. пентанон – 3; 5. пропоксиэтан | |
| 230. | Название соединения НООС – СН2 – С(О) – СООН 1. бутандиовая кислота 2. оксобутандиовая кислота 3. бутановая кислота 4. бутанон – 2 – диовая кислота 5. 3 – карбокси – 2 – оксопропановая кислота | |
| 231. |  Название соединения С6Н5 – СН – СН2NН2ОН 1. фениламин 2. 2 –гидрокси–2–фенилэтиламин 3. 2 –амино – 1–фенилэтанол 4. 2 –гидрокси–2–фенилэтан 5. 2 –амино–1-фенилэтан Название соединения С6Н5 – СН – СН2NН2ОН 1. фениламин 2. 2 –гидрокси–2–фенилэтиламин 3. 2 –амино – 1–фенилэтанол 4. 2 –гидрокси–2–фенилэтан 5. 2 –амино–1-фенилэтан | |
| 232. | Состояние sр2 гибридизации всех атомов углерода в соединении 1. СН≡ С – СН3 2. СН2 = СН – СН = СН2 3. СН2 = СН – СН2 – СН = СН2 4. С6Н5СН3 5. С6Н5 – СН2Сl | |
| 233. | Все утверждения о молекуле бутадиена – 1,3 верны, кроме 1. цепи сопряжения содержатся только sр2 – гибридизованные атомы углерода 2. все сигма – связи лежат в одной плоскости 3. молекула содержит π,π – сопряженную систему, охватывающую 4 атома углерода 4. π,π – сопряжение приводит к выравниванию длины связей 5. молекула обладает пониженной термодинамической устойчивостью | |
| 234. | Вид сопряжения изменение электронной плотности в молекуле акролеина СН2 = СН – СН = О 1. π,π; уменьшается 2. р,π; уменьшается 3. π,π; увеличивается 4. р,π; увеличивается | |
| 235. | Только ароматические соединения расположены в ряду: 1. С6Н5СН3, С2Н5NН2 2. Н2N – С6Н4 – SO3Н, СН5NН2 3. С2Н5ОН, С6Н5СООН 4. С6Н5СООН, С6Н5СООСН3 5. С6Н5Сl, С2Н5Сl. | |
| 236. | Условия ароматичности 1. sр2 – гибридизация всех атомов углерода, неплоский характер кольца 2. sр3 – гибридизация атомов углерода, отвечают правилу Хюккеля 3. содержат плоский замкнутый цикл, имеют единую π – электронную систему, отвечают правилу Хюккеля 4. цикл замкнут, атомы углерода находятся в sр3 - гибридизации | |
| 237. | электронный эффект гидроксильной группы в С6Н5 – СН2 – ОН 1. +J 2. +J; +М 3. –J; +М 4. –J 5. –J; -М | |
| 238. | Электронные эффекты гидроксильной группы в соединении 1. Н3С – С6Н4 –ОН 2. +J 3. +J; +М 4. –J; +М 5. –J 6. -J; -М | |
| 239. | Функциональная группа прояввляет отрицательный мезомерный эффект в соединении 1. СН3СН2СООН 2. НSСН2СН2NН2 3. СН2 = СНСН = О 4. СН2 = СНN(СН3)2 5. СН3СН2ОН | |
| 240. | Электроноакцепторные свойства этоксигруппа апоявляет в соединении 1. СН2СНСН2ОС2Н5 2. СН2 = СНОС2Н5 3. С6Н5ОС2Н5 4. СН3СН = СНОС2Н5 5. СН3С6Н4ОС2Н5 | |
| 241. | Все заместители проявляют электронодонорные свойсва 1. С2Н5 – О – С6Н4 – СООН 2. Н2N – С6Н4 – СООН 3. О2N – C6Н4 – СНО 4. Н2N – С6Н14 – С2Н5 5. НООС – С6Н4 - СНО | |
| 242. | Электронная плотность в этиленовом фрагменте повышена по сравнению с этиленом 1. СН2 = СНСl 2. СН2 = СНNО2 3. СН3 – СН = СН2 4. СН2 = СН – СНО 5. СН2 = СН - СООН | |
| 243. | При хлорировании толуола в присутствии катализатора преимущественно образуется 1. хлористый бензол 2. о- хлортолуол 3. м – хлортолуол 4. n – хлортолуол 5. 3 - хлортолуол | |
| 244. | При хлорировании бензойной кислоты в присутствии катализатора образуется 1. хлористый бензол 2. о- хлорбензойная кислота 3. м – хлорбензоиная кислота 4. n – хлорбензойная кислота 5. хлорангидрид бензойной кислоты | |
| 245. | При гидратации СН2 = СН – СНО образуется 1. 2 – гидроксипропаналь; 2. 3 – гидроксипропаналь; 3. 2-гидроксипропановая кислота; 4. 3-гидроксипропановая кислота; 5. пропен-2-ол-1 | |
| 246. | Кислоты бренстеда 1. окрашивают лакмус в синий цвет 2. акцепторы протонов 3. доноры протонов 4. не взаимодействуют с растворами щелочей 5. присоединяют протон | |
| 247. | С гидроксидом меди (ii) взаимодействует 1. С2H5OH 2. HOCH2CH(OH)CH2OH 3. C6H5OH 4. HOCH2CH2CH2Сl 5. C6H5CH2OH | |
| 248. | Наибольшей активностью обладает 1. С6H5NH2 2. NH3 3. CH3NH2 4. (CH3)2NH 5. Cl-C6H5-NH2 | |
| 249. | Обладает амфотерными свойствами соединение 1. CH2=CH-COOH 2. ClCH2COOH 3. H2N-C6H4-COOH 4. NH2CH3 5. C6H5CH2NH2 | |
| 250. | В реакцию альдольной конденсации вступает 1. СН3СНО 2. (СН3)3С СНО 3. СН3СОС2Н5 4. С6Н5СНО 5. С6Н5СОСН3 | |
| 251. | Полифункциональное соединение 1. коламин (аминоэтанол) 2. фенол 3. уксусная кислота 4. гидрохинон 5. винная кислота | |
| 252. | Электронодонорный заместитель 1. --CH3; 2. –COOH; 3. –NO2; 4. –SO3H | |
| 253. | В реакции: толуол+HNO3 –NO2 (преимущественно) поступает в положение 1. орто- 2. мета- 3. пара- | |
| 254. | Наиболее сильными кислотными свойствами обладает 1. CH3COOH; 2. ClCH2COOH; 3. Cl2CHCOOH; 4. Cl3CCOOH | |
| 255. | В реакции C6H5COOH+HNO3, нитрогруппа поступает в положение: 1. орто- 2. мета- 3. пара- | |
| 256. | Наиболее сильными кислотными свойствами обладает 1. HCOOH; 2. C6H5COOH; 3. CH3COOH; 4. C2Н5COOH | |
| 257. | Электронодонорная группа: 1. -NH2; 2. -SO3H; 3. -NO2; 4. -COOH | |
| 258. | В реакции: C6H5Cl+CH3Cl, метильный радикал (преимущественно) поступает в положение 1. орто- 2. мета- 3. пара- | |
| 259. | С NaOH реагирует: 1. CH3OH; 2. C6H5OH 3. CH3OCH3 4. C2H5OH | |
| 260. | В виде цис- и транс-изомеров могут существовать: 1. 2-метилпентан; 2. пентин-2; 3. пентен-2; 4. бутандиовая кислота | |
| 261. | Открытые системы 1. термос; 2. вскрытая ампула с аммиаком; 3. ампула; 4. человек | |
| 262. | Процесс окисления глюкозы в организме 1. экзотермический; 2. изотермический; 3. изобарный; 4. изохорный; 5. эндотермический | |
| 263. | Теплота образования протсых веществ в стандартных условиях равна 1. 0; 2. 5 кДж/моль; 3. 10 кДж/моль; 4. 15 кДж/моль; 5. 20 кДж/моль. | |
| 264. | При растворении твердых веществ энтропия 1. увеличивается; 2. уменьшается; 3. не изменяется. | |
| 265. | Реакция не может протекать самопроизвольно при любых температурах, если: 1) DН > 0, DS < 0; 2) DН > 0, DS > 0; 3) DН < 0, DS > 0; | |
| 266. | Соотношение скоростей реакций при динамическом равновесии в системе 1. V1>V2; 2. V1=V2; 3. V1<V2; 4. V1=2V2; 5. 2V1=V2 | |
| 267. | Принцип смещения химического равновесия сформулировал 1. Менделеев; 2. Ле-Шателье; 3. Аррениус; 4. Сеченов; 5. Дальтон | |
| 268. | При повышении давления в системе 4Fe+3O2«2Fe2O3 равновесие смещается 1. вправо; 2. влево; 3. не смещается | |
| 269. | Повышение температуры в системе C2H2+H2«C2H4-Q смещает равновесие 1. вправо; 2. влево; 3. не смещает; 4. в любую сторону; 5. требуются дополнительные условия | |
| 270. | Константа равновесия для реакции СaCO3«CaO+CO2 1. K=[CO2]; 2. K=[CaO][CO2]/[CaCO3]; 3. K=1/[CO2]; 4. K=[CaO][CO2] | |
| 271. | Учение о скоростях химических реакций, её зависисмость от различных факторов – это химическая… 1. термодинамика; 2. кинетика; 3. адсорбция; 4. хроматография | |
| 272. | Кинетическое уравнение реакции второго порядка 1. u=k 2. u=k*c 3. u=k*c2 4. u=k*c3 | |
| 273. | Бимолекулярная реакция – это реакция 1. H2+I2=2HI; 2. 2NO+O2=2NO2; 3. СaCO3=CaO+CO2; 4. C+O2=CO2; 5. Сa(HCO3)= СaCO3+CO2+H2O | |
| 274. | Средняя сокрость гомогенной реакции по изменению продуктов вычисляется по формуле… 1. u=+DС/t 2. u=-DС/Dt 3. u=+Dn/Dt 4. u=--Dn/Dt 5. u=+Dn/t | |
| 275. | Средняя скорость гетерогенной реакции по изменению количества исходных веществ вычисляется по формуле: 1. u=+Dn/Dt; 2. u=-Dn/(Dt*S); 3. u=+Dn/(Dt*S); 4. u=-Dn/(u*Dt); | |
| 276. | Реакции гидролиза белков представляют собой 1. последовательные реакции; 2. параллельные; 3. сопряженные; 4. простые; 5. цепные. | |
| 277. | Повышение температуры на каждые 10 градусов приведет 1. к увеличению скорости в 2-4 раза; 2. скорость не изменится; 3. к уменьшению скорости в 2-4 раза; 4. к увеличению скорости в 5-6 раз; 5. к уменьшению скорости в 5-6 раз. | |
| 278. | Уравнение аррениуса 1. 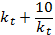 =g 2. k=A* =g 2. k=A* 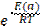 ; 3. u=k*Ca*Cb; 4. u2=u1* ; 3. u=k*Ca*Cb; 4. u2=u1* | |
| 279. | Ускоряющее
 Сейчас читают про:
|
 2015-06-05
2015-06-05 1637
1637





