Спирты
Спирты - это класс соединений, в состав которых входит функциональная группа - ОН.
Например:
Предельные спирты:
СН3-ОН метиловый спирт, метанол
СН3-СН2-ОН этиловый спирт, этанол
СН3-СН2-СН2-ОН пропиловый спирт, пропанол-1
СНз-СН(ОН)-СНз изопропиловый спирт, пропанол-2
Непредельные спирты:
СН2=СН-СН2-ОН - аллиловый спирт
Соединения, в которых гидроксильная группа связана непосредственно с углеродным атомом ароматического кольца, называют фенолами, а если гидроксильная группа находится в боковой цепи - ароматическими спиртами.
Например:
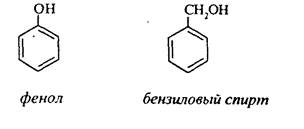
Приведенные выше спирты имеют в своем составе только одну гидроксильную группу, поэтому их называют одноатомными спиртами.
Спирты, имеющие в молекуле две гидроксильные группы, называют двухатомными спиртами или гликолями.
Например:
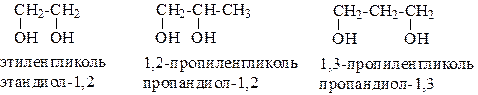
Соединения с тремя гидроксильными группами в молекуле – это трехатомные спирты. Например: СН2(ОН) –СН(ОН)-СН2(ОН) – глицерин.
Методы получения спиртов
1. Спирты можно получить действием воды на алкены. Реакцию проводят в присутствии серной кислоты, при этом сначала образуется эфир серной кислоты, а затем под действием воды - соответствующий спирт.
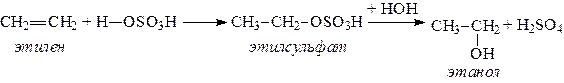
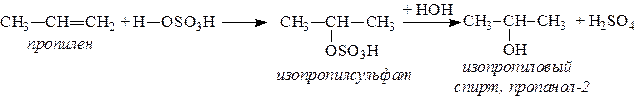
Этот метод используют в промышленности для получения этилового и изопропилового спирта. Он называется методом сернокислотной гидратации.
2. Кроме того, спирты можно получать действием водного раствора щелочи на галогенпроизводные (гидролиз галогенпроизводных):
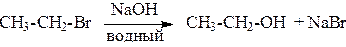
3. Этиловый спирт получают брожением глюкозы:
С6Н12О6 ® 2 С2Н5-ОН + 2СО2
Основные реакции спиртов - это реакции по гидроксильной группе.
1. Спирты реагируют с металлическим натрием. При этом водород в гидроксильной группе замещается на металл - образуется алкоголят и выделяется водород:
2CH3-CH2-OH + 2Na ® 2 CH3-CH2-ONa + Н2
этилат натрия
2. Спирты взаимодействуют с минеральными и органическими кислотами, при этом происходит образование сложных эфиров:
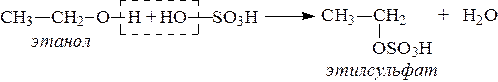
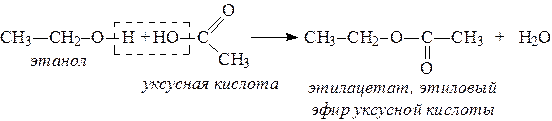
3. При нагревании спиртов с водоотнимающими средствами происходит отщепление молекулы воды от молекулы спирта и образуется алкен:
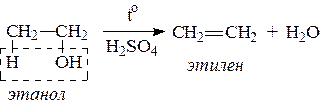
4. Если эту реакцию проводить в избытке спирта и при температуре, не превышающей 160°С, происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир:
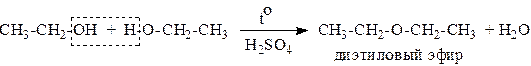
5. При действии галогенводородов (НС1, HBr, HI) гидроксильная группа замещается на галоген (Cl. Br, I)
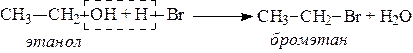
6. Спирты окисляются сильными окислителями или кислородом воздуха при температуре 300-500°С на катализаторах. При этом первичные спирты образуют альдегиды, вторичные - кетоны.
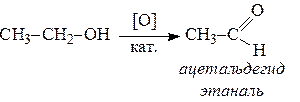
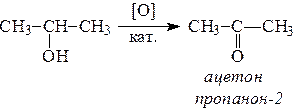
Для получения двухатомных спиртов (гликолей) применимы те же способы, что и для одноатомных спиртов.
Этиленгликоль обычно получают из этилена следующими методами:
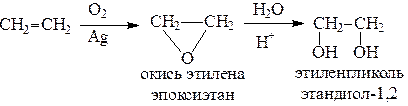
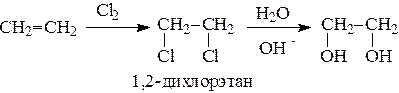
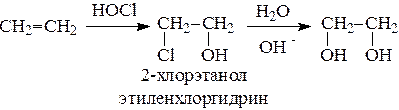
Гликоли дают все реакции одноатомных спиртов с тем лишь различием, что в реакции могут участвовать как одна, так и две гидроксильные группы.
При действии на гликоли гидрата окиси меди образуется голубой осадок комплексного соединения. Эта реакция используется как качественная реакция на гликоли.
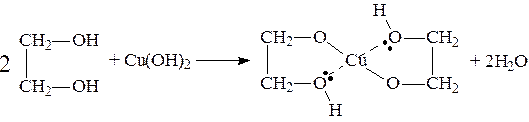
Этиленгликоль применяется как антифриз для автомобильных двигателей, т.к. понижает температуру застывания воды. Полиэфиры этиленгликоля находят применение в различных отраслях промышленности.
Первым представителем трехатомных спиртов является глицерин. Его получают гидролизом жиров, которые представляют собой сложные эфиры глицерина и высших жирных кислот.
Гидролиз жиров обычно называют омылением, поскольку образующиеся при этом натриевые соли высших жирных кислот являются мылами. Глицерин также получают из пропилена, который выделяют из газов процессов крекинга.
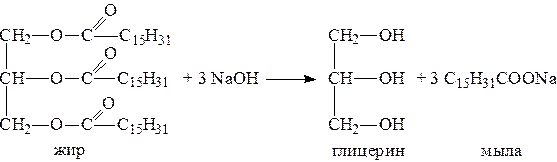
Химические свойства глицерина обусловлены наличием трех гидрок-сильных групп, при этом глицерин может давать три ряда производных: моно-, ди- и трипроизводные. Глицерин применяется в парфюмерии, кондитерском производстве, для получения нитроглицерина.
Ароматические соединения, у которых гидроксильная группа находится при углеродном атоме в боковой цепи, называют ароматическими спиртами. Их простейшими представителями являются:
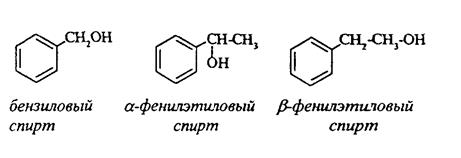
Для этих спиртов присущи способы получения и химические свойства, которые характерны для алифатических спиртов. Эти спирты представляют практический интерес, поскольку в свободном виде и в виде эфиров широко распространены в растительном мире и часто в виде сложных эфиров применяются в парфюмерии из-за приятного запаха. Например, бензиловый спирт в свободном виде или в виде эфиров встречается в масле жасмина. b-Фенил-этиловый спирт является основной составляющей в розовом масле.
Фенолы
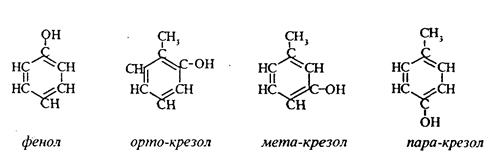
Фенолы - органические соединения, в которых гидроксильная группа связана непосредственно с углеродным атомом ароматического кольца.
Простейшие представители:
Фенол получают сплавлением солей сульфокислот со щелочами:
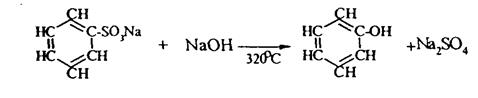
Этот метод применяется в промышленности.
Фенол можно получить окислением изопропилбензола (кумола) кислородом воздуха в присутствии катализатора с последующим разложением образующегося гидропероксида кумола.
В результате получаются фенол и ацетон:
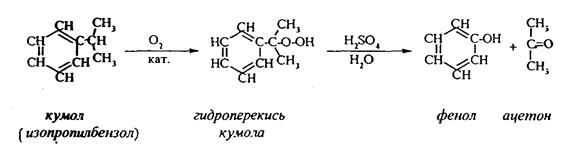
Этот метод, применяемый в промышленности для получения фенола и ацетона, называется кумольный метод.
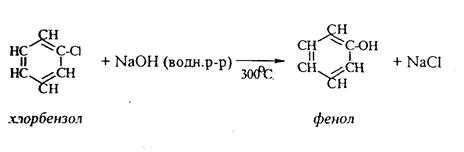
С хорошим выходом можно получить фенол пиролизом хлорбензола.
Химические свойства
1. Фенолы проявляют большую кислотность, чем спирты, однако они слабее, чем карбоновые кислоты.
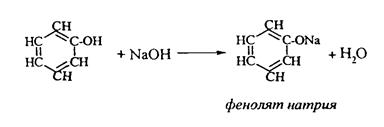
Фенолы реагируют со щелочами, с образованием фенолятов:
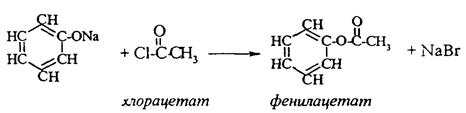
2. Феноляты реагируют с галогенпроизводными с получением эфиров фенолов:
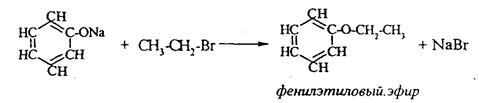
3. С галогенангидридами кислот феноляты образуют сложные эфиры:
4. С хлоридом железа (III) FeCl3 фенол дает комплексные соединения с фиолетовым окрашиванием.
Реакция используется как качественная при определении фенолов:
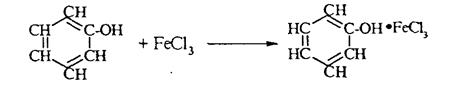
Кроме того, для фенолов характерны реакции замещения (сульфирования, нитрования, галогенирования) в ароматическом кольце, при этом группа ОН проявляет себя как очень активный заместитель первого рода, и эти реакции замещения для фенола проходят намного легче, чем для бензола.
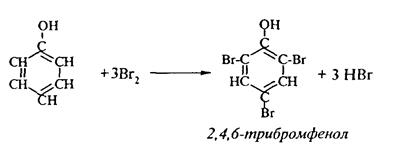
1. Так, при действии на фенол бромной воды идет замещение сразу трех атомов водорода при углеродных атомах ароматического кольца на бром, и образуется 2,4,6-трибромфенол:
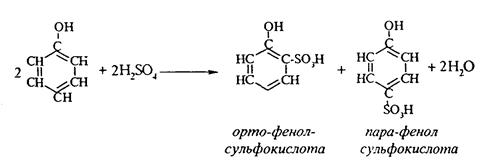
2. При сульфировании фенола получают орто- и пара-фенолсульфокислоты:
3. Нитрование фенола идет уже при действии разбавленной азотной кислоты.
Получается смесь орто- и пара-нитрофенолов:
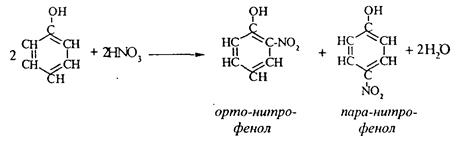
4. В присутствии кислых катализаторов фенол вступает в реакцию поликонденсации с формальдегидом:
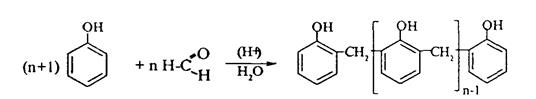
По такой схеме в промышленности получают фенол-формальдегидные смолы.
 2015-07-14
2015-07-14 17231
17231